Similar presentations:
Ферменты This presentation is prepared by Ali Tilek
1.
ФерментыThis presentation is prepared by Ali Tilek
2.
• Для существования жизни необходимо выполнение двух основных условий. Во-первых,живой организм должен обладать способностью к самовоспроизведению. Во-вторых,
организм должен уметь эффективно и селективно катализировать химические реакции.
• Сахар не распадаясь хранится в полках кухни
• Однако попадая в организм он расщепляется
• Хотя термодинамически распад сахара спонтанный процесс, этот процесс очень медленен.
• Они проявляют высокую специфичность к субстратам, многократно ускоряют химические
реакции и действуют в водных растворах в мягких условиях (температура и рН). Из
небиологических катализаторов лишь немногие обладают подобными свойствами.
3.
• Изучение ферментов имеет огромное практическое значение.• Некоторые заболевания, особенно наследственные генетические нарушения, могут быть
связаны с дефектом или полным отсутствием одного или нескольких ферментов.
• Причиной других заболеваний может быть слишком высокая активность фермента.
• Определение активности ферментов в плазме крови, эритроцитах или тканях играет важную
роль в медицинской диагностике. Механизм действия многих лекарств включает их
взаимодействие с ферментами в организме.
• Кроме того, ферменты находят практическое применение в химической и пищевой
промышленности и в сельском хозяйстве.
4.
Большинство ферментов являются белками• За исключением немногочисленной группы молекул РНК, обладающих каталитической
активностью, все остальные ферменты являются белками.
• Некоторым ферментам для проявления каталитической функции не нужны никакие
химические группы, кроме собственной аминокислотной последовательности.
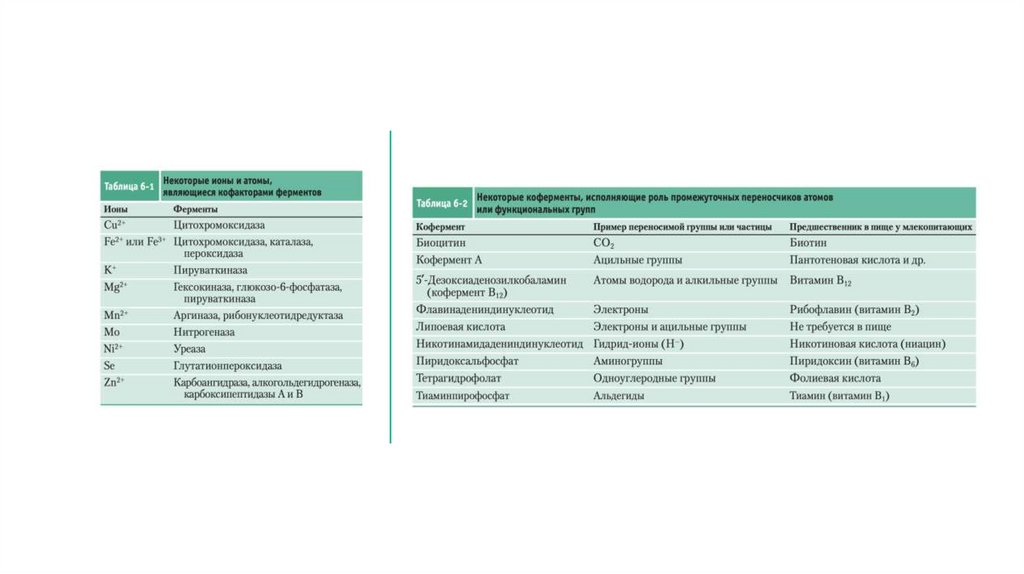
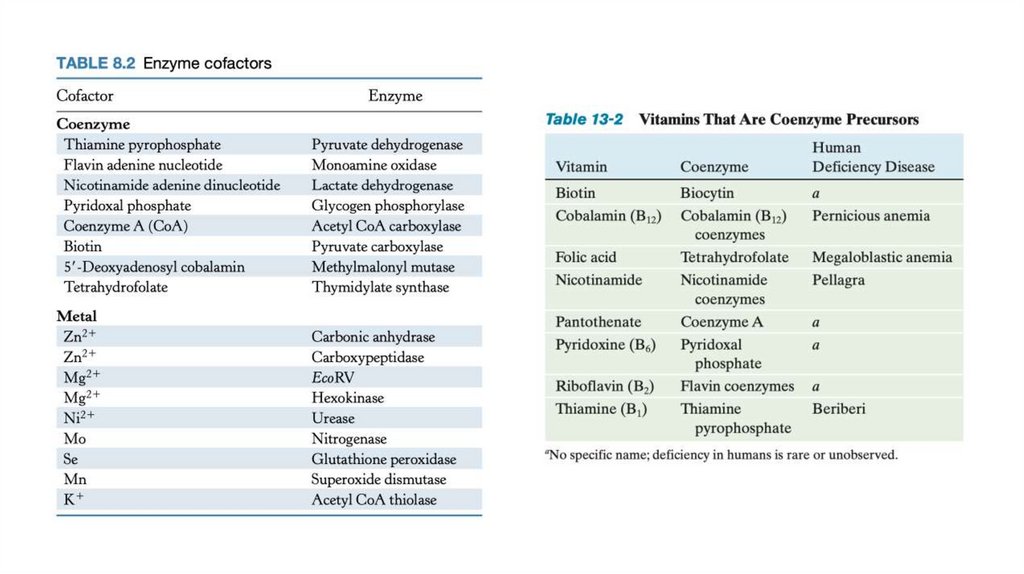
• Другие ферменты нуждаются в дополнительных химических компонентах — кофакторах.
Кофакторами могут быть неорганические ионы, такие как Fe2+, Mg2+, Mn2+ или Zn2+, или
сложные ме- таллоорганические соединения, которые носят название коферментов.
• Кофермент или ион металла, которые очень прочно (иногда посредством ковалентной связи)
связаны с ферментом, называют простетической группой.
• Каталитически активный фермент со связанным коферментом и (или) ионами металла
называется холоферментом.
• Белковая часть такого сложного фермента называется апоферментом, или апопротеином.
• Наконец, некоторые ферменты подвергаются ковалентной модификации при
фосфорилировании, гликозилировании и т. д. Многие из этих процессов связаны с
регуляцией ферментативной активности.
5.
6.
7.
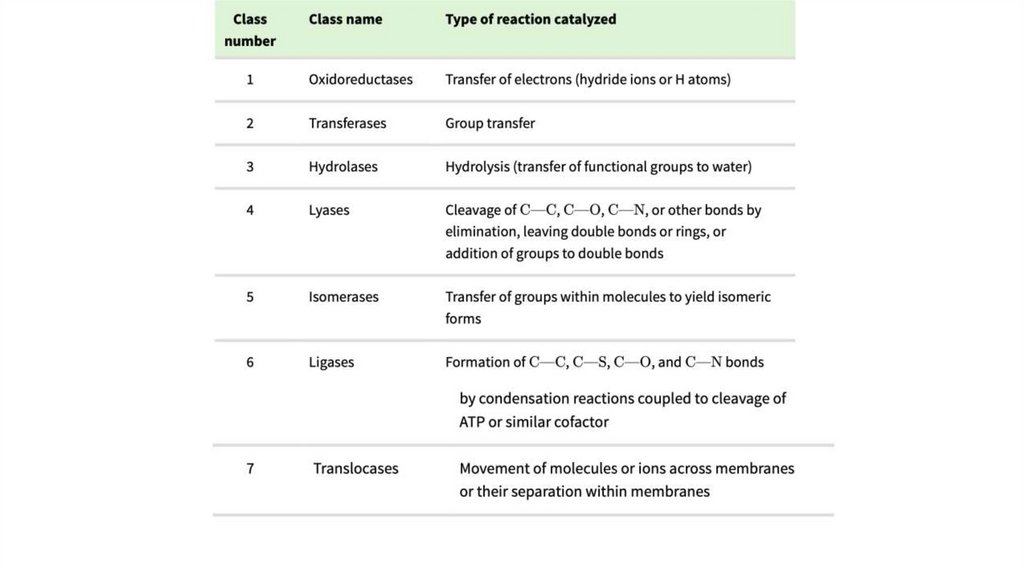
Ферменты классифицируют в соответствии скатализируемыми ими реакциями
• Названия многих ферментов образовались в результате добавления суффикса «-аза» к
названию их субстрата или к слову (фразе), описывающему суть их действия
• Так,уреаза(от англ. urea) катализирует гидролиз мочевины, а ДНК-полимераза катализирует
полимеризацию нуклеотидов с образованием нити ДНК.
• Некоторые другие ферменты были названы первооткрывателями в соответствии с какой-то
особенностью их действия, прежде чем были обнаружены их специфические реакции.
• Например, фермент, участвующий в расщеплении пищи, был назван пепсином — от греч.
pepsis, что означает «пищеварение»; лизоцим был назван так за свою способность
лизировать клеточные стенки бактерий.
• Кроме того, существуют ферменты, название которых происходит от источника, из которого
они были выделены: слово «трипсин» частично происходит от греч. tryein, что означает
«стирать», поскольку он был получен при натирании панкреатической ткани глицерином
• Классификация ферментов основана на типе реакции, которую они катализируют. Всем
ферментам присвоены EC-номера (ЕС от enzyme classification) и названия, а у многих
ферментов есть также тривиальные названия.
8.
9.
Как работают ферменты• При стандартных физиологических условиях некатализируемые реакции идут крайне
медленно, поскольку большинство биомолекул достаточно устойчивы при нейтральных
значениях рН и температуре, при которой обычно существуют живые клетки.
• Более того, во многих биохимических реакциях происходят события, термодинамически
довольно неблагоприятные или маловероятные для клетки, например временное
образование неустойчивых промежуточных продуктов или столкновение двух или большего
числа молекул в строго определенной ориентации.
• Отличительной особенностью ферментативной реакции является то, что она происходит
внутри кармана на поверхности фермента, называемого активным центром
• Молекула, связывающаяся в активном центре и подвергающаяся воздействию фермента,
называется субстратом.
10.
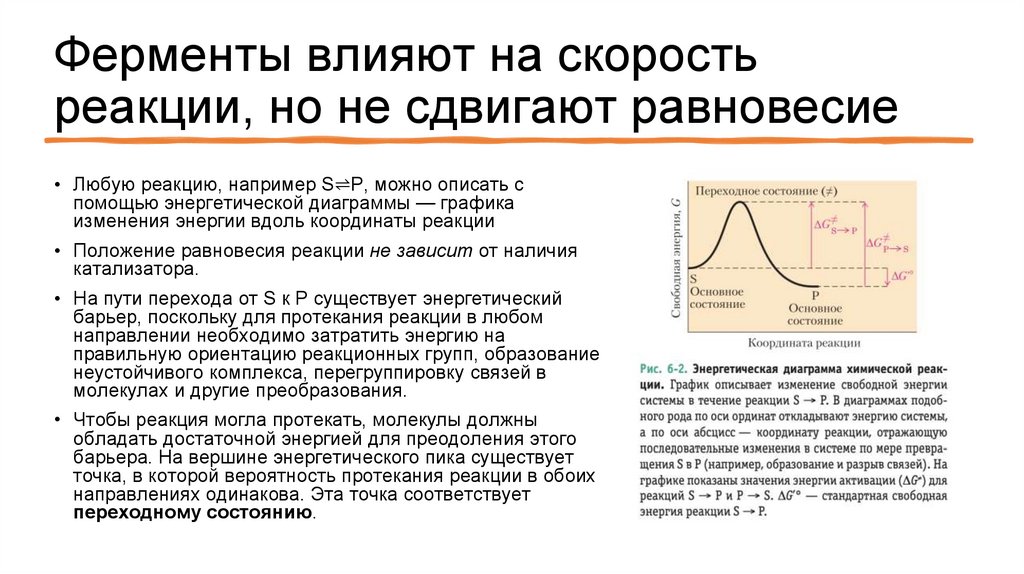
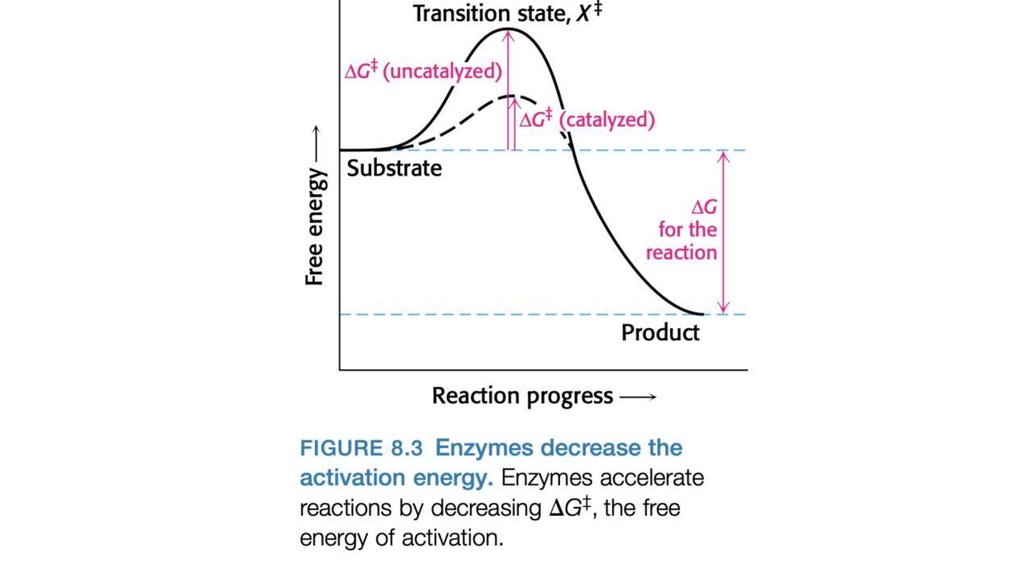
Ферменты влияют на скоростьреакции, но не сдвигают равновесие
• Любую реакцию, например S⇌P, можно описать с
помощью энергетической диаграммы — графика
изменения энергии вдоль координаты реакции
• Положение равновесия реакции не зависит от наличия
катализатора.
• На пути перехода от S к P существует энергетический
барьер, поскольку для протекания реакции в любом
направлении необходимо затратить энергию на
правильную ориентацию реакционных групп, образование
неустойчивого комплекса, перегруппировку связей в
молекулах и другие преобразования.
• Чтобы реакция могла протекать, молекулы должны
обладать достаточной энергией для преодоления этого
барьера. На вершине энергетического пика существует
точка, в которой вероятность протекания реакции в обоих
направлениях одинакова. Эта точка соответствует
переходному состоянию.
11.
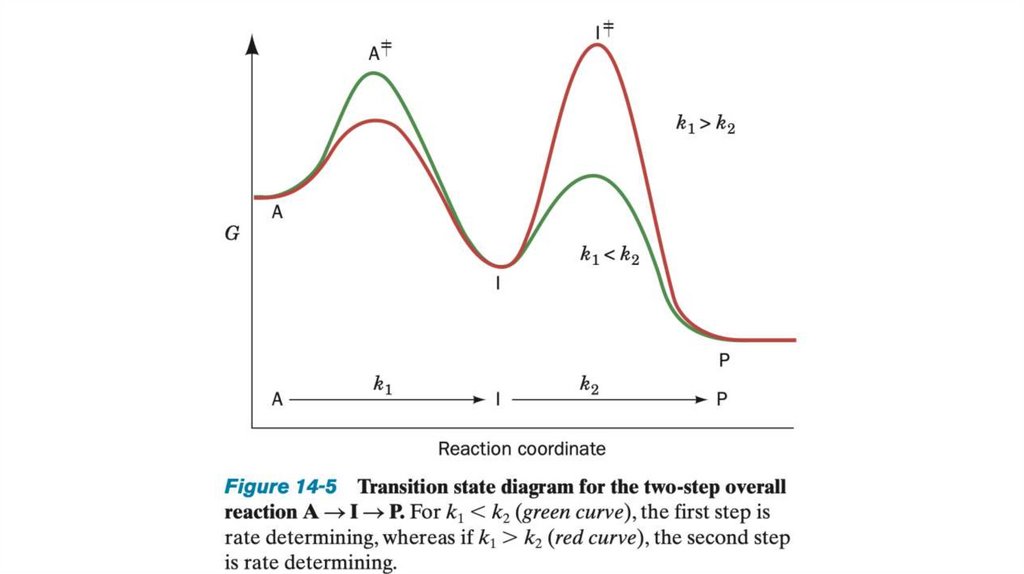
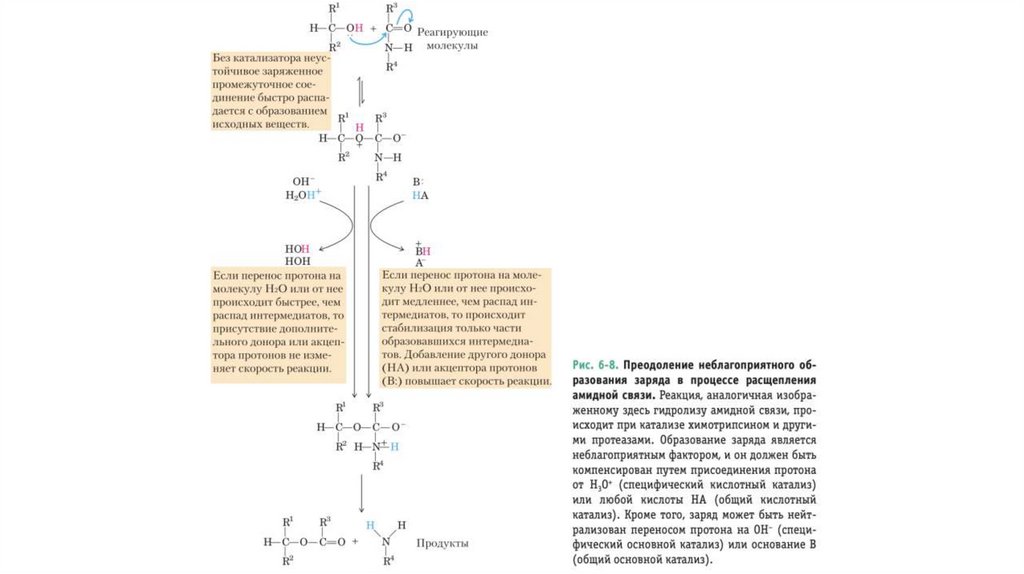
• Переходное состояние — это некоторая неопределенная стабильнаяхимическая структура; его не следует путать с промежуточными
продуктами реакции (ES и EP).
• Переходное состояние существует короткое время, на протяжении
которого происходит разрушение связей, образование связей и
локализация заряда, причем в этот момент одинаково вероятно
образование исходного вещества и продукта реакции.
• Разность между значениями энергии в основном и переходном состояниях
называется энергией активации (

































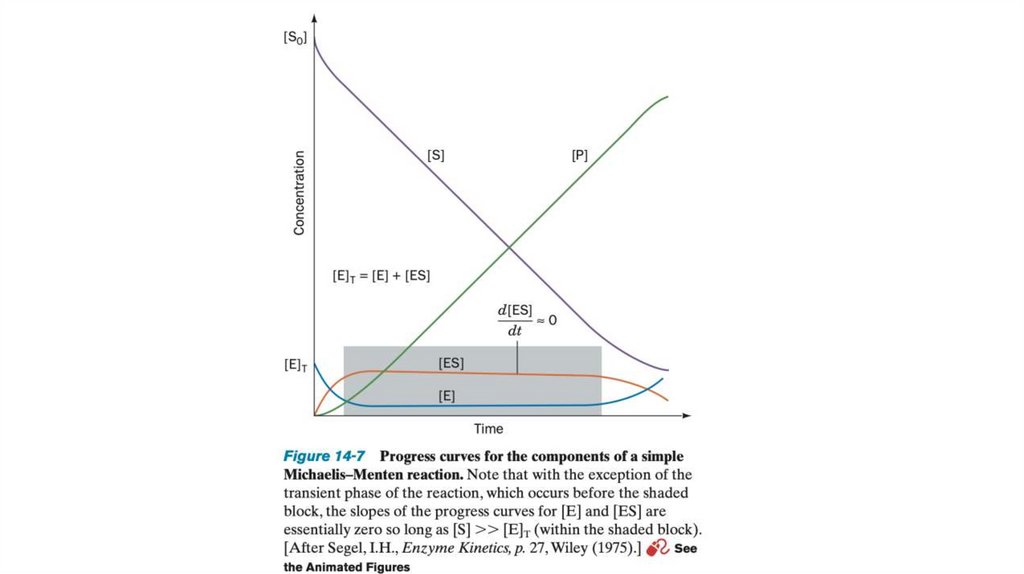






















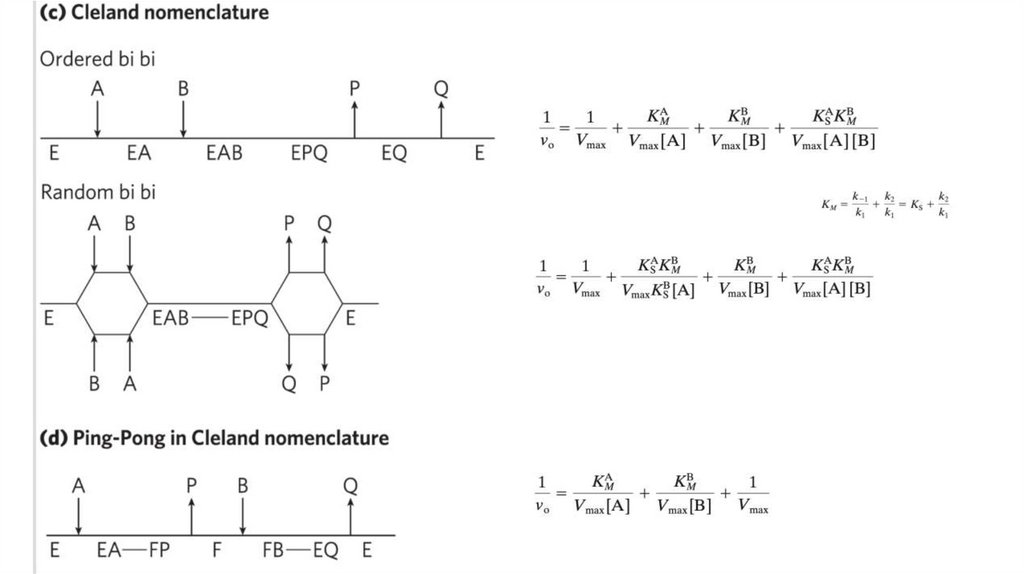




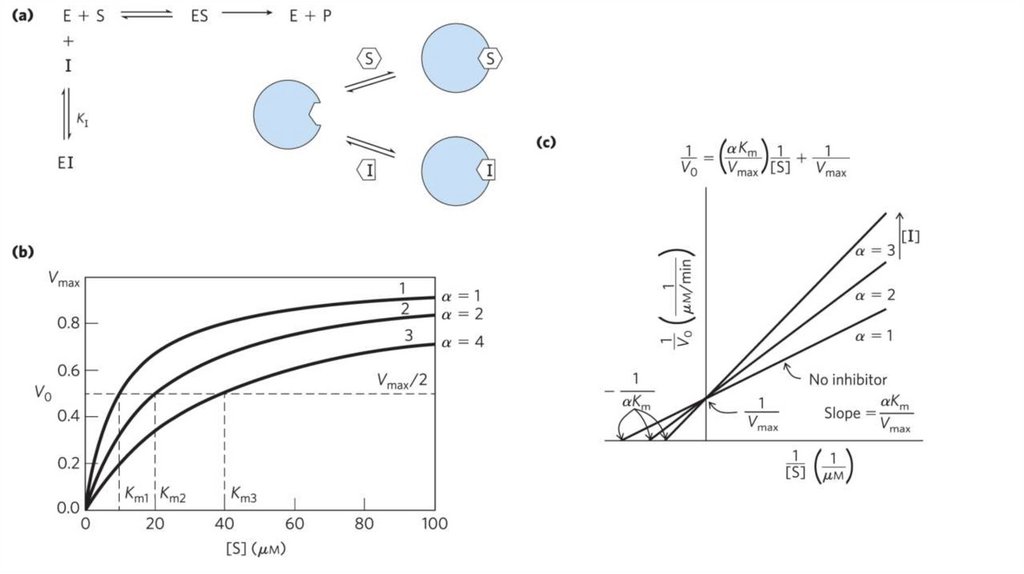


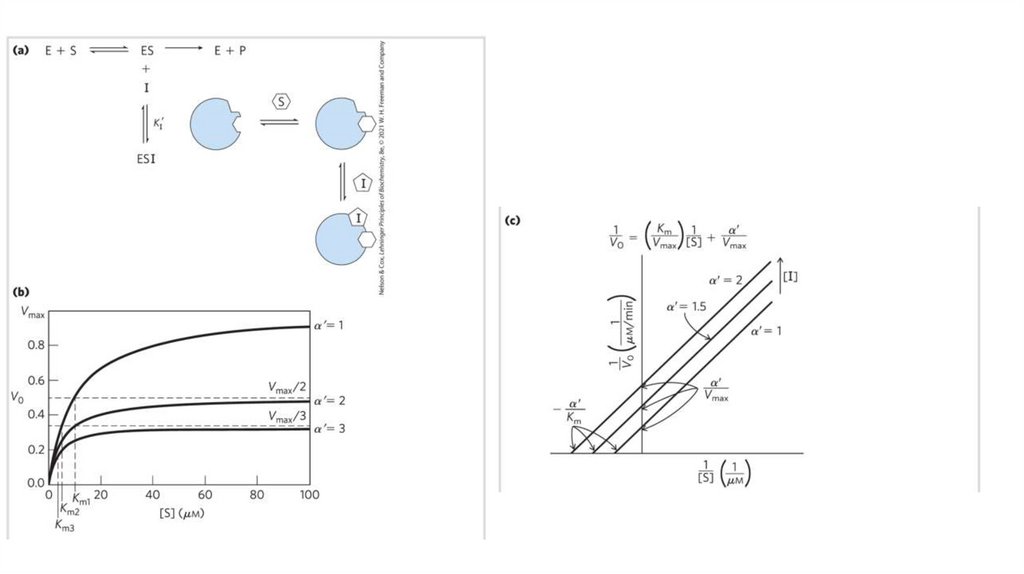


























 biology
biology








