Similar presentations:
Закон сохранения массы веществ. Химические уравнения. ( 8 класс )
1.
Ильина И.В., руководитель ЦДОШ, учитель химии МБОУ«Средняя общеобразовательная школа №27 имени А.А.
Дейнеки» г. Курска
E-mail мой: ilina.irina71@mail.ru
2.
Задание 1. Назовите признаки и условияпротекания
химических
реакций
А
Б
3.
Закон сохранения массывеществ.
Химические уравнения.
4.
Цель урока1. Научиться правильно составлять химические
уравнения,
указав
на
применение
закона
сохранения массы (количества) вещества.
2. Повторить понятия как простые и сложные
вещества, составление химической формулы
вещества, химические реакции.
5.
• Знаменитый английский химикРоберт Бойль, прокаливая в
открытой реторте различные
металлы и взвешивая их до и
после нагревания, обнаружил,
что массы металлов становятся
больше. Основываясь на этих
опытах, он предложил, что
существует некая» огненная
материя»,
которая
при
нагревании металла соединяется
с ним, увеличивая его массу.
6.
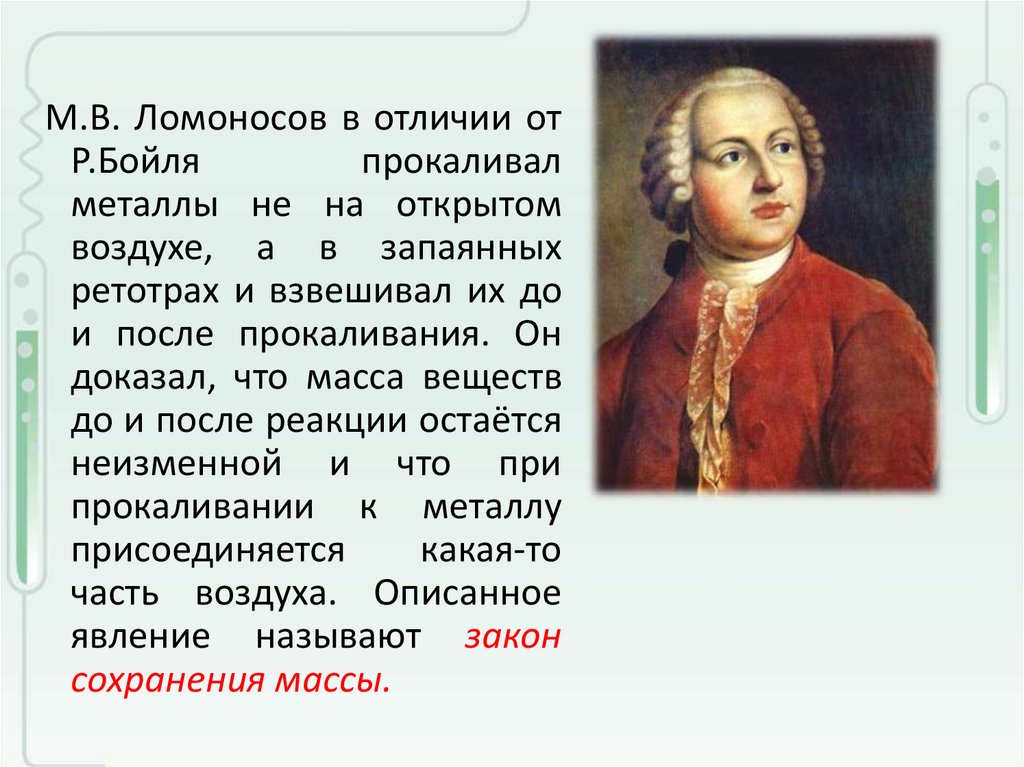
М.В. Ломоносов в отличии отР.Бойля
прокаливал
металлы не на открытом
воздухе, а в запаянных
ретотрах и взвешивал их до
и после прокаливания. Он
доказал, что масса веществ
до и после реакции остаётся
неизменной и что при
прокаливании к металлу
присоединяется
какая-то
часть воздуха. Описанное
явление называют закон
сохранения массы.
7.
• Французский химикАнтуан Лоран Лавуазье
(независимо
от
М.В.
Ломоносова)
сформулировал
этот
закон в 1789 году.
Закон сохранения массы веществ.
Масса веществ, вступивших в
химическую реакцию, равна массе
образовавшихся веществ.
8.
Видео экспериментов, демонстрирующих законсохранения массы веществ:
- с растворами
https://rutube.ru/video/cfd9e68b90e6c2ef7d2ac7ba
80be1f2b/?r=wd
https://rutube.ru/video/1d355514247ec3cf757d435
5c74f9bd9/?r=wd
- при горении
https://rutube.ru/video/aa31614ea9ab61536d8f4f5
019522ec5/?r=wd
9.
Определения• Химическое уравнение – это условная запись
химической реакции посредством химических
формул и коэффициентов.
• Реагенты - исходные вещества, принимающие
участие
в
химических
реакциях.
• Продукты – новые вещества, образующиеся в
результате химической реакции.
10.
Заданиефосфора
2.
Посмотрите опыт
в
кислороде.
горение
Ссылка:
https://rutube.ru/video/7a62f96cd5603bb6ccc02e9
1aa150493/?r=wd
Запишите,
какое
_______
явление
происходит.
Признак
химической
реакции______
11.
Алгоритм составление уравненияхимической реакции
1. В левой части уравнения записываем
химические формулы реагентов (веществ,
вступающих в реакцию). Между реагентами
ставим знак «+». Затем пишем знак равно.
2. В правой части уравнения записываем
химические формулы продуктов реакции.
3. Согласно закону сохранения массы веществ
число атомов до и после реакции должно быть
одинаковым. Это достигается путём расстановки
коэффициентов.
12.
Химические уравненияP
+
O2
=
P2O5
10
13.
Химические уравненияP
+ 5 O2
10 : 2 = 5
= 2 P2O5
10
10 : 5 = 2
14.
Химические уравнения4 :1= 4
4P
4
4 : 4 = 1
+ 5 O2
= 2 P2O5
10 : 2 = 5
10
10 : 5 = 2
15.
Домашнее задание1. Параграф 10
2. Упражнения 1 и 2 (из презентации)
3. Задачи №1 (из презентации)
Пишите в электронный журнал или на мою почту.
E-mail: ilina.irina71@mail.ru
16.
Упражнение 1Преобразуйте следующие схемы в уравнения
химических реакций расставив необходимые
коэффициенты и заменив стрелки на знак
равенства:
• Zn + O2 → ZnO
• Fe + Cl2→ FeCl3
• Mg + HCl → MgCl2 + H2
• Al(OH)3 → Al2O3 + H2O
• HNO3→ H2O+NO2+O2
• CaO+H2O→ Ca(OH)2
• H2+Cl2→ HCl
• KClO3→ KClO4+KCl
• Fe(OH)2+H2O+O2→ Fe(OH)3
• KBr+Cl2→ KCl+Br2
17.
Упражнение 2Закончите предложения:
а) Закон сохранения массы веществ экспериментально
подтвердили: _________________ и __________________ .
б) Современная формулировка закона сохранения массы
веществ: _____________________________________.
в) Закон сохранения массы веществ применяют для
составления _____________ и ___________________.
г) Число атомов до реакции всегда должно равняться
__________________________________________.
д) Коэффициент всегда ставится __________________.
Задача 1
Рассчитайте массу и количество вещества фосфора,
если известно, что число его молекул составляет
2,45*10 23.
















 chemistry
chemistry








