Similar presentations:
Строение и свойства молекулы азота и аммиака
1.
Строение и свойствамолекулы азота и аммиака
2.
ВведениеЗначимость азота (N₂):
1. Состав атмосферы: Азот составляет около 78%
атмосферы Земли. Это инертный газ, который не
участвует в большинстве химических реакций при
нормальных условиях, что делает его важным для
поддержания стабильности атмосферы.
2. Фиксация азота: В природе азот из атмосферы
фиксируется
бактериями
(например,
азотфиксирующими бактериями) и превращается в
доступные для растений формы (например, нитраты и
аммоний). Этот процесс критически важен для
плодородия почвы и производства пищи.
3. Синтез органических соединений: Азот является
ключевым элементом аминокислот и нуклеотидов,
которые составляют белки и нуклеиновые кислоты
(ДНК и РНК).
Значимость аммиака (NH₃):
1.Удобрения:
Аммиак
является
основным
компонентом
многих
удобрений,
которые
используются для улучшения роста растений, так как
он обеспечивает необходимые азотистые соединения.
2.Метаболизм: В организме аммиак образуется в
процессе метаболизма белков и используется в
синтезе аминокислот. Однако его высокая токсичность
требует быстрой конверсии в менее токсичные формы
(например, в мочевину) для выведения из организма.
3.Реакции в химии: Аммиак является важным
реагентом в различных химических процессах, таких
как синтез удобрений, производство пластмасс,
взрывчатых веществ и многих других химических
соединений.
3.
Молекула азота (N₂) – Общая информацияХимические и физические свойства
1.Инертность: Благодаря тройной связи N₂
является химически инертной молекулой при
нормальных условиях (комнатная температура и
нормальное давление). Она не вступает в реакции с
большинством веществ, поэтому её трудно
разложить или использовать непосредственно в
химических реакциях.
2.Газообразное состояние: Азот существует в
газообразной форме при комнатной температуре и
стандартном давлении. Этот газ бесцветный, не
имеет вкуса и запаха, и составляет примерно 78%
от объёма атмосферы Земли.
Применение
1.Промышленность: В химической промышленности
азот используют для создания аммиака (NH₃) через
процесс Габера-Боша. Этот процесс – основа для
производства азотных удобрений, которые играют
важнейшую роль в сельском хозяйстве.
2.Инертная атмосфера: Азот часто используется для
создания инертной атмосферы при различных
химических и производственных процессах, например,
при сварке металлов, производстве электроники и
хранении чувствительных к окислению веществ.
3.Медицинское и криогенное применение: Жидкий
азот (температура кипения около -196 °C) применяется
для криоконсервации биологических образцов,
заморозки тканей в медицине и в других криогенных
технологиях.
4.
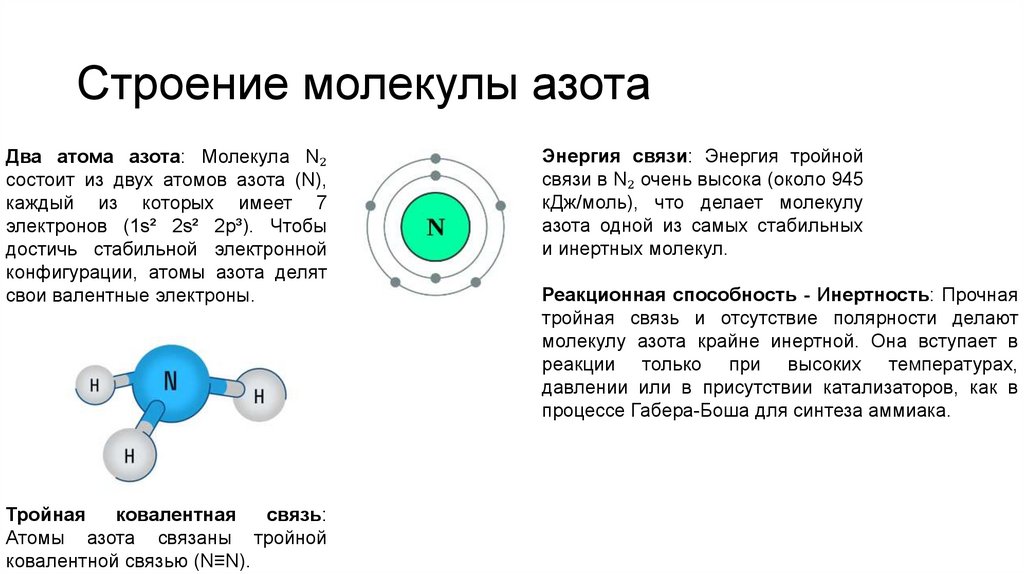
Строение молекулы азотаДва атома азота: Молекула N₂
состоит из двух атомов азота (N),
каждый из которых имеет 7
электронов (1s² 2s² 2p³). Чтобы
достичь стабильной электронной
конфигурации, атомы азота делят
свои валентные электроны.
Тройная
ковалентная
связь:
Атомы азота связаны тройной
ковалентной связью (N≡N).
Энергия связи: Энергия тройной
связи в N₂ очень высока (около 945
кДж/моль), что делает молекулу
азота одной из самых стабильных
и инертных молекул.
Реакционная способность - Инертность: Прочная
тройная связь и отсутствие полярности делают
молекулу азота крайне инертной. Она вступает в
реакции только при высоких температурах,
давлении или в присутствии катализаторов, как в
процессе Габера-Боша для синтеза аммиака.
5.
Свойства молекулы азотаФизические свойства
1. Состояние: При нормальных условиях
(температура 25 °C и давление 1 атм) азот является
газом. Его молекулы легко перемещаются и почти не
взаимодействуют друг с другом.
2. Температуры плавления и кипения: Азот имеет
низкую температуру плавления (-210 °C) и кипения (196 °C). Это объясняется слабым межмолекулярным
взаимодействием между молекулами азота, которые
держатся лишь за счёт слабых дисперсионных сил.
3. Цвет, вкус, запах: Азот — бесцветный, безвкусный
и без запаха газ. Это делает его незаметным в
атмосфере и безопасным для дыхания в составе
воздуха (в отличие от других газов, которые могут
быть токсичны).
4. Растворимость: Азот слабо растворим в воде и
других жидкостях, что означает, что он незначительно
участвует в водных биохимических процессах.
Химические свойства
Реакции при высоких температурах: При высоких
температурах азот может вступать в реакции с
другими элементами. Например:
С кислородом: При температуре выше 1200
°C азот реагирует с кислородом, образуя оксиды азота,
такие как NO и NO₂. Эти соединения важны для
атмосферы, но также являются загрязнителями.
С водородом: В процессе Габера-Боша азот
реагирует с водородом при высоком давлении и
температуре с образованием аммиака (NH₃). Эта
реакция имеет огромное значение для производства
удобрений.
Фиксация азота: В природе азот фиксируется
бактериями, которые превращают N₂ в доступные
формы азота (например, NH₄⁺ и NO₃⁻). Эти
соединения необходимы для роста растений и
поддержания экосистем.
6.
Молекула аммиака (NH₃) – Общая информацияМолекула аммиака (NH₃) – это простое соединение азота и водорода, имеющее важное значение как в
биологических, так и в промышленных процессах.
Биологическое значение:
Производство в организме: Аммиак образуется в
процессе метаболизма белков и аминокислот в
организме. Он токсичен в высоких концентрациях, и
поэтому в печени превращается в менее токсичную
мочевину, которая затем выводится из организма
через почки.
Надобность для растений: Аммиак и его
производные (например, нитраты и аммоний)
необходимы для роста растений, так как они
обеспечивают их азотом, который является важным
элементом для синтеза белков и других органических
соединений.
Промышленное применение:
Синтез удобрений: Аммиак является основным
компонентом для производства азотных удобрений,
таких как мочевина и аммонийные соли, что делает
его ключевым элементом в сельском хозяйстве.
Химическая промышленность: Аммиак используется
для производства различных химических соединений,
таких как пластмассы, красители, взрывчатые
вещества и хладагентные вещества.
Очистка и дезинфекция: Аммиак также используется
в быту и промышленности как чистящее и
дезинфицирующее средство.
7.
Строение молекулы аммиакаСостав молекулы:
Атомы: Молекула аммиака состоит из одного атома
азота (N) и трёх атомов водорода (H).
Электронная конфигурация: Атом азота имеет
электронную конфигурацию1s22s22p3, и его внешняя
оболочка содержит пять валентных электронов. Он
формирует три ковалентные связи с тремя атомами
водорода, образуя молекулу NH₃.
Гибридизация:
sp³-гибридизация: Атом азота в аммиаке находится в
состоянии sp³-гибридизации, так как его валентные
орбитали (одна 2s- и три 2p-орбитали) образуют
четыре гибридные sp³-орбитали.
Не поделённая электронная пара: Одна из sp³орбиталей атома азота содержит не поделённую
электронную пару, которая не участвует в связывании
с атомами водорода, а три оставшиеся орбитали
формируют связи N–H.
Электроотрицательность и полярность:
Электроотрицательность: Азот более электроотрицателен,
чем водород, поэтому связи N–H являются полярными.
Электроны в каждой из этих связей смещены в сторону
атома азота, что создаёт частичный отрицательный заряд
на азоте и частичный положительный заряд на атомах
водорода.
Дипольный момент: Молекула аммиака имеет дипольный
момент, направленный от центра основания пирамиды к
атому азота. Это делает аммиак полярной молекулой, что
объясняет его высокую растворимость в воде и способность
образовывать водородные связи.
8.
Свойства аммиакаФизические свойства:
1. Состояние при комнатной температуре: Аммиак – это газ при нормальных условиях (25 °C и 1 атм),
обладающий резким, характерным запахом.
2. Температура плавления и кипения: Аммиак имеет низкие температуры плавления (-77,73 °C) и кипения (33,34 °C). При охлаждении его можно легко конденсировать в жидкость.
3. Цвет и запах: Аммиак – бесцветный газ с резким, едким запахом, который легко обнаруживается даже в
малых концентрациях.
4. Растворимость в воде: Аммиак хорошо растворяется в воде, образуя слабощелочной раствор, называемый
аммиачной водой (или гидроксидом аммония, NH₄OH). В растворе аммиак частично диссоциирует, образуя
ионы аммония (NH₄⁺) и гидроксида (OH⁻), что придаёт раствору щелочные свойства.
5. Полярность: Аммиак – полярная молекула из-за разницы в электроотрицательности между азотом и
водородом, а также пирамидальной формы молекулы. Это полярное строение позволяет аммиаку
образовывать водородные связи с другими молекулами, что повышает его растворимость в воде.
9.
Свойства аммиакаХимические свойства:
1. Основание: Аммиак является слабым основанием. Он может реагировать с кислотами, образуя соли
аммония. Например:
NH3 + HCl → NH4Cl
В этом процессе аммиак принимает протон, превращаясь в ион аммония (NH₄⁺).
2. Реакции с металлами: Аммиак может реагировать с активными металлами (такими как литий, натрий и
кальций) с образованием амидов металлов. Например:
2NH3 + 2Na → 2NaNH2 + H2
3. Окисление: При высокой температуре аммиак может быть окислен кислородом. В присутствии катализатора
(например, платиновой сетки) аммиак окисляется с образованием оксидов азота (например, NO), которые
используются в промышленности для производства азотной кислоты:
4NH3 + 5O2 → 4NO + 6H2O
4. Разложение: При нагревании до 500–600 °C аммиак разлагается на азот и водород:
Это свойство используется для получения водорода в промышленности.
2NH3 → N2 + 3H2








 chemistry
chemistry








