Similar presentations:
Получение водорода и изучение его свойств (8 класс)
1.
«Получение водородаи изучение его свойств»
Выполнил:
ученик 8 «А» класса
Просолов Никита.
Руководитель:
учитель химии
Полежаева Элина Демидовна.
г. Нижний Новгород
2019г
2.
3.
4.
Объект исследования –простое вещество водород
Предмет исследования –
физические и химические свойства водорода
5.
Цель :Получить водород и изучить его
свойства
6.
Задачи исследования:Изучить теоретический материал, касающийся водорода
и его свойств.
Выяснить, кто открыл водород и откуда появилось
это название;
Расширить представления о физических
и
химических свойствах водорода;
Узнать, каковы области применения водорода;
Получить водород и изучить его
свойства
экспериментально .
7.
Открытие водородаПарацельс –
открыл водород в
XVI веке
Г. Кавендишь выделил водород в
чистом виде и
изучил его свойства
в 1776 году
Лавуазье первым получил
водород из
воды в 1783 году
8.
Характеристика химическогоэлемента водорода
Атом водорода — самый простой
по строению, самый лёгкий из
атомов всех известных элементов.
В его ядре находится один протон,
а в электронной оболочке — всего
один электрон.
Ar(H)=1
9.
Характеристика простоговещества
В виде простого вещества
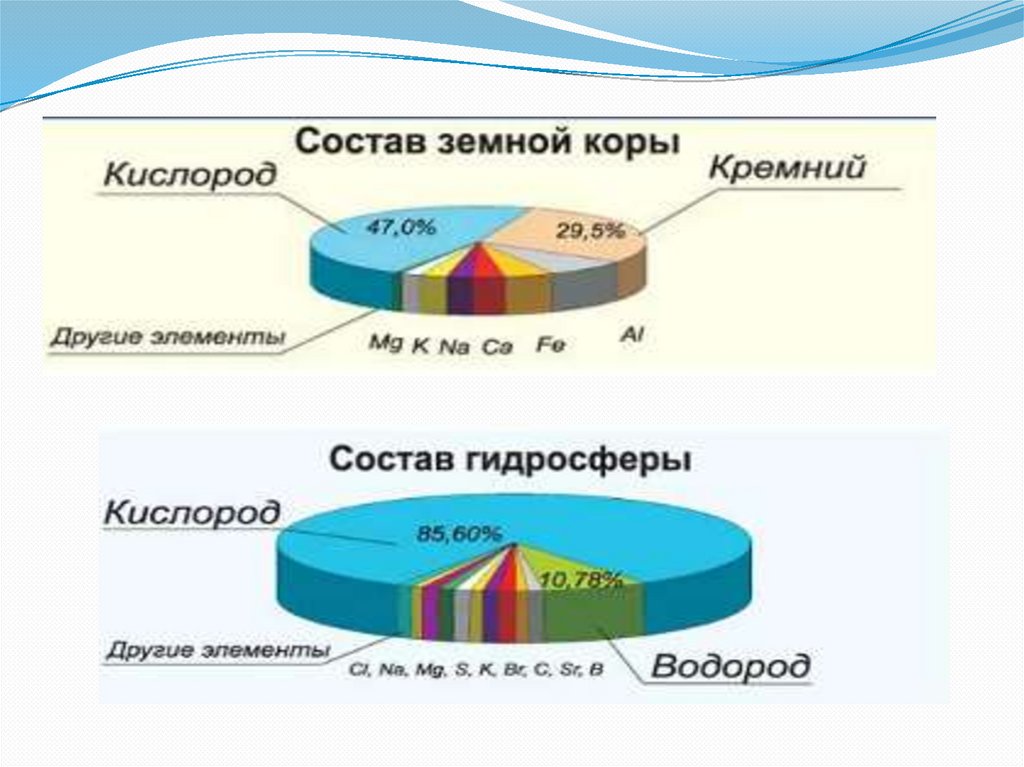
водород встречается на Земле
лишь в небольшом количестве в
вулканических и некоторых
других природных газах.
Молекулы водорода Н2
обнаружены в верхних слоях
земной атмосферы.
Mr (H2)=2Ar(H)=2.
M (H2)=2г/моль
Vm (H2)=22,4 л/моль.
10.
Физические свойстваводорода
При обычных условиях водород - это газ, не
имеющий запаха, цвета и вкуса.
Температура кипения - (-252,6 0С).
Температура плавления - (-259,1 0С).
11.
Химические свойстваводорода
В соединениях водород всегда одновалентен.
Молекула водорода состоит из двух атомов, соединенных
общей электронной парой Н:Н
Чтобы разорвать в 1 моль водорода молекулы на атомы,
необходимо затратить энергию 436 кДж.
Этим объясняется сравнительно небольшая активность
молекулярного водорода при обычной температуре.
Со многими неметаллами водород образует газообразные
соединения .
При нагревании водород вступает в реакции соединения с
простыми веществами — кислородом, хлором, азотом, серой и
углеродом
12.
1) С галогенами образует галогеноводороды:Н2 + Cl2 = 2НСl.
2) С кислородом - воду:
2Н2 + О2 = 2Н2О
3) При нагревании энергично реагирует с серой с образованием
сероводорода:
Н 2 + S = H 2S
4) С азотом с образованием аммиака лишь на катализаторе и при
повышенных температурах и давлениях:
ЗН2 + N2 =2NН3
5) С углеродом при высоких температурах образует метан:
2Н2 + С =СН4
6) С щелочными и щелочноземельными металлами образует
гидриды :
Н2 + 2Li = 2LiH
Со сложными веществами:
7) С оксидами металлов (используется для восстановления
металлов):
CuO + H2 = Cu + H2O
Fe3O4 + 4H2 = 3Fe + 4Н2О
13.
Получение водородаПромышленные способы получения водорода:
Паровая конверсия метана;
Газификация угля - процесс подразумевает нагревание
угля до 1000 0С, в результате чего образуется водород и
высокоуглеродный уголь;
Электролиз.
Лабораторные способы получения водорода :
Действие разбавленных кислот на металлы:
Взаимодействие щелочных и щелочноземельных
металлов с водой:
Гидролиз гидридов:
Действие щелочей на цинк или алюминий
Электролиз воды
Аппарат Киппа
14.
Способы собиранияводорода
Вытеснение воздуха
Вытеснение воды
15.
В 1852 году Генри Гиффардом . был создан первый дирижабль наоснове водорода Позднее водородные дирижабли стали называть
«цеппелинами».
В августе 1887 г. полет на воздушном шаре, наполненном водородом,
с научной целью совершил Д. И. Менделеев.
Воздухоплавание на водороде было прекращено после крушения
дирижабля «Гинденбург» в 1937 году. Авария произошла в результате
возгорания.
16.
Применение водорода17.
Практическая частьПолучение водорода и его собирание
Zn +2HCl → ZnCl2 +H2↑
18.
Горение водорода2Н2 + О2 → 2Н2О
Проверка водорода на чистоту
19.
Восстановление меди из оксида меди (II)CuO + H2 → Cu + H2O
Результат реакции
20.
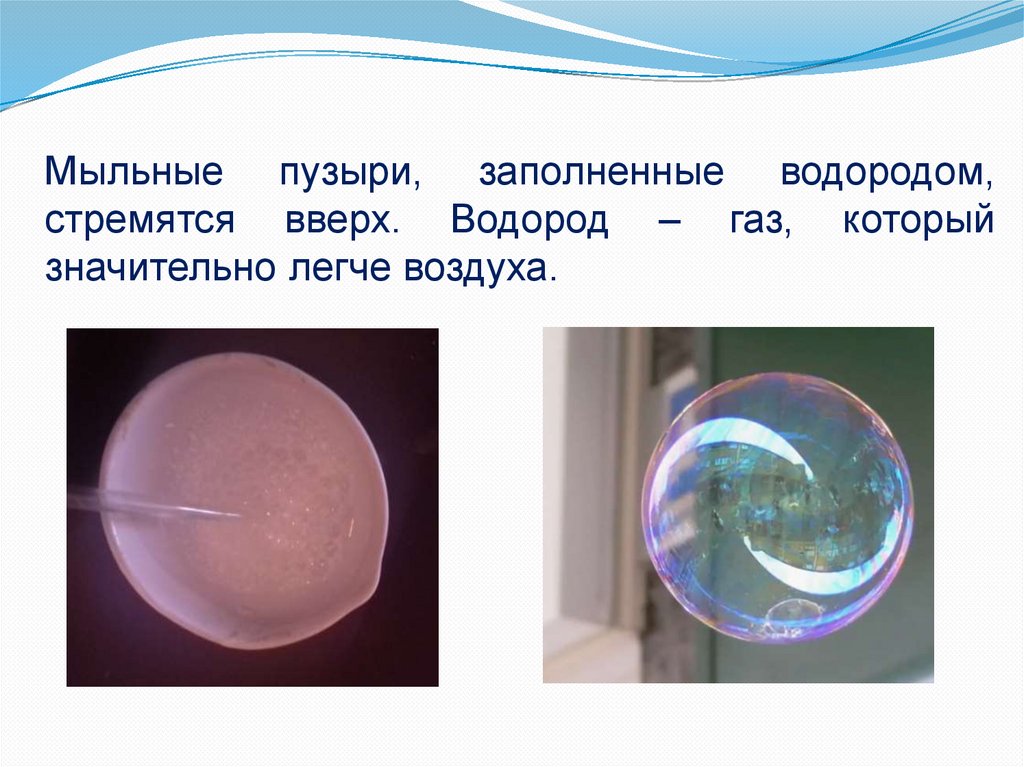
Мыльные пузыри, заполненные водородом,стремятся вверх. Водород – газ, который
значительно легче воздуха.
21.
ВыводыЗнаменитый английский физик и химик Г. Кавендиш в 1766
году исследовал газ и назвал его «горючим воздухом».
Французский химик А. Лавуазье в 1783 г. установил, что
«горючий воздух» входит в состав воды и может быть из
неё получен. Лавуазье назвал вещество - Hydrogenium —
«рождающий воду», т.е. водород.
Водород это газ, который можно получать в школьной
лаборатории, но необходимо соблюдать правила по
технике безопасности, так как этот газ взрывоопасен.
При горении он образует воду.
22.
Водород восстанавливает металлы из их оксидов, врезультате реакции нами были получены - медь ( это
металл красного цвета) и вода;
Водород очень лёгок и в воздухе всегда поднимается
вверх. Когда-то дирижабли и воздушные шары наполняли
водородом. Но в 30-х гг. XX в. произошло несколько
катастроф, в ходе которых дирижабли взрывались и
сгорали. Во время блокады Ленинграда город защищали
от бомбежек аэростатами заполненными водородом. В
наше время дирижабли наполняют гелием, несмотря на
его существенно более высокую стоимость.
23.
ЗаключениеВ заключение мне хотелось бы сказать, что водород очень
важное, незаменимое и интереснейшее вещество. Он –
самый распространенный элемент во Вселенной. Энергия,
излучаемая Солнцем и другими звёздами, выделяется в
результате ядерных реакций с участием его ядер.
В земной коре он встречается почти исключительно в виде
соединений: входит в состав нефти, природного газа,
каменного угля, некоторых минералов.
Самое известное соединение водорода – это его оксид,
вода.
В ходе работы я узнал, что у нас есть возможность
изменить экологическую обстановку на Земле, уменьшить
выброс вредных веществ в атмосферу. Водород не без
оснований называют чудесным топливом будущего. т.к, при
его использовании не образуются парниковые газы и не
нарушается круговорот воды в природе.






















 chemistry
chemistry








