Similar presentations:
Химия стратосферы
1. Лекция №2 ХИМИЯ СТРАТОСФЕРЫ
1.2.
3.
4.
5.
Озон в атмосфере
Образование и
разрушение озона в
атмосфере
Обрыв цепи в процессах,
вызывающих разрушение
озона
«Озоновая дыра» над
Антарктидой
Международные
соглашения для
сохранения озонового
слоя.
2. ОЗОН В АТМОСФЕРЕ
Озон — Оз — аллотропная модификация кислорода. Общая масса озона в атмосфере оцениваетсяпримерно в 3,3 млрд т. Это высокотоксичный газ, его токсичность примерно на порядок
превышает токсичность диоксида серы. Озон — сильнейший окислитель, реагирующий
практически с любыми веществами — от автомобильных покрышек до тканей легких человека.
Поэтому дышать озоном нельзя, и его присутствие в воздухе тропосферы даже в сравнительно
небольших количествах представляет опасность для всего живого.
3.
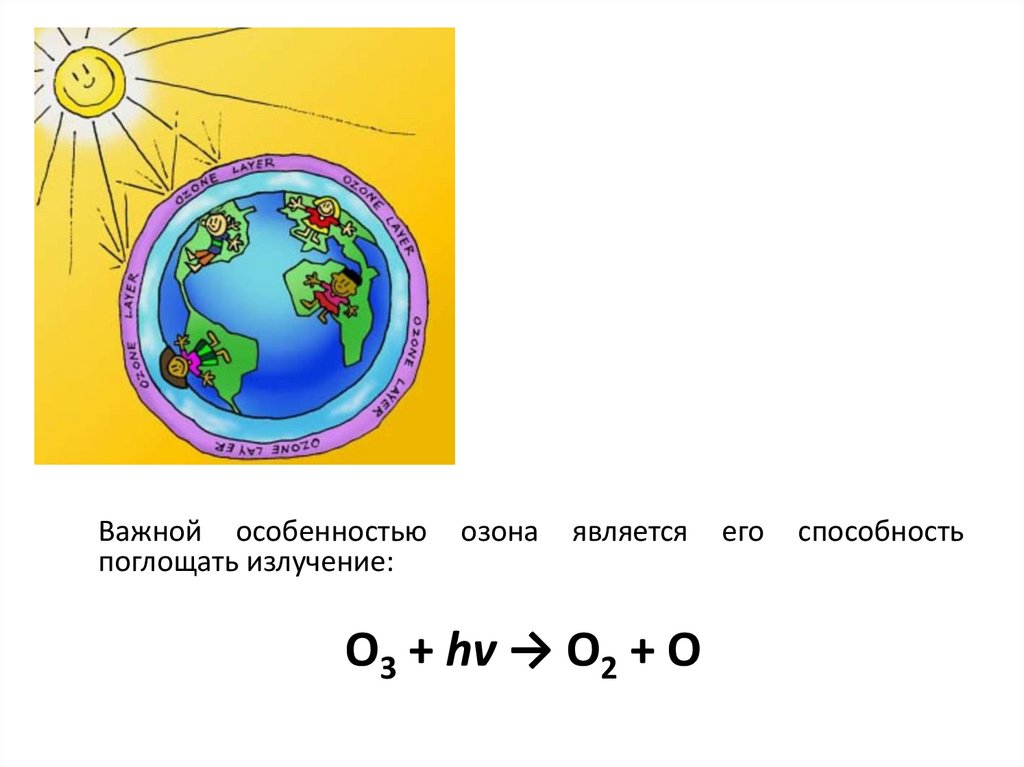
Важной особенностьюпоглощать излучение:
озона
является
О3 + hv → О2 + О
его
способность
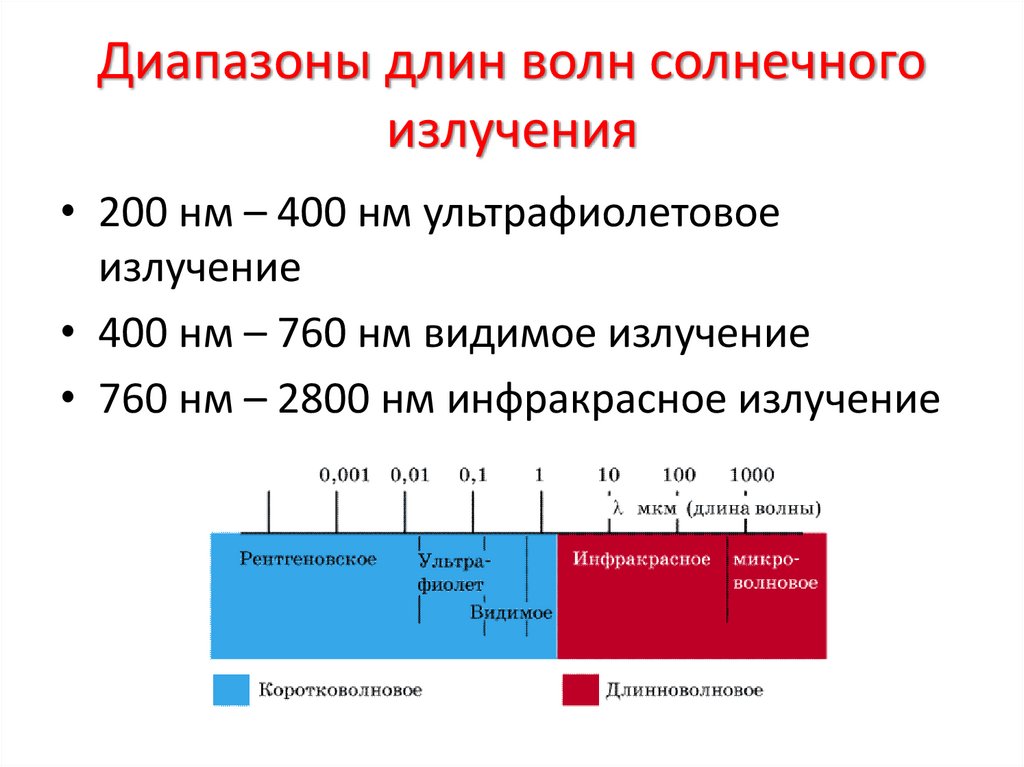
4. Диапазоны длин волн солнечного излучения
• 200 нм – 400 нм ультрафиолетовоеизлучение
• 400 нм – 760 нм видимое излучение
• 760 нм – 2800 нм инфракрасное излучение
5.
• Озон разрушается, поглощая излучение с длинойволны меньше 1130 нм, но максимум поглощения
наблюдается при длине волны короче 320 нм.
• Озон поглощает ультрафиолетовое излучение в
тысячи раз лучше, чем кислород, и количества
озона в стратосфере, где концентрация его
достигает максимальных значений, в десятки и
сотни раз превышающих среднее его содержание в
тропосфере, достаточно для практически полного
поглощения жесткого ультрафиолетового излучения
Солнца. Поэтому озон стратосферы выполняет
защитную функцию, и уменьшение его количества в
этой области атмосферы может представлять
опасность для биоты и прежде всего для человека.
6. Содержание озона в атмосфере
Зона с максимальными значениями концентрации озонанаходится на высотах от 15 до 35 км. На больших высотах концентрация
озона резко снижается, и на высоте более 85 км озон практически
отсутствует.
7. Определение содержания озона в атмосфере
8. Определение содержания озона в атмосфере
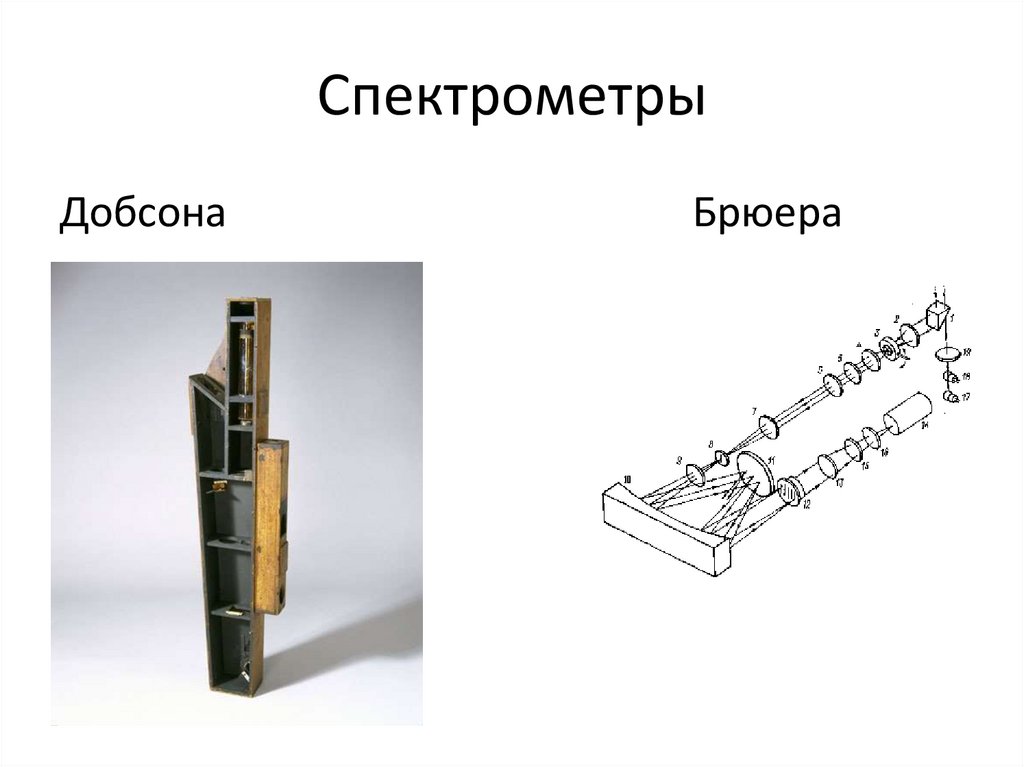
• В 20-х годах прошлого столетия основным прибором дляизмерения содержания озона в атмосфере был
спектрометр Добсона. Этот прибор позволял определять
общее количество озона, находящегося в столбе воздуха
над наблюдателем. Полученные значения суммарного
объема озона в столбе атмосферы единичной площади
сечения приводили к нормальным условиям и
определяли высоту, которая приходится в этом столбе
атмосферы на весь озон.
• Слой озона высотой 10-5 м принимается
равным одной единице Добсона (е.Д.).
9. Спектрометры
ДобсонаБрюера
10. Содержание озона в атмосфере
• Общее количества озона в атмосфеременяется от 120 до 760 е.Д. (наиболее
часто — 200-400 е.Д.) при среднем для
всего земного шара значении 290 е.Д.
Таким образом, весь озон, собранный из
атмосферы к поверхности Земли, мог бы
покрыть ее слоем, толщина которого в
среднем составила бы 2,9 мм.
11. Содержание озона в атмосфере
• Общее содержание озона в атмосфере над конкретной территориейизменяется в достаточно широких пределах. Помимо фотохимических
процессов значительный вклад в изменение содержания озона и его
концентрации на различных высотах вносят процессы движения
воздушных масс. Закономерности таких изменений, связаны со
временем года и географической широтой местности.
• В северном полушарии на широтах более 30° с.ш. общее содержание
озона в атмосфере максимально в конце зимы — начале весны, а
минимально осенью (сентябрь — октябрь).
• Наибольшие изменения характерны для высоких широт (70-80° с.ш.), где
среднее содержание озона может меняться от 450 е.Д. в марте до 280
е.Д. в сентябре.
• На широте 40-43° с.ш. изменения менее контрастны (от 370 е.Д. весной
до 280 е.Д. осенью).
• На низких широтах (менее 30°) с.ш. сезонные изменения практически
отсутствуют (не превышают 20 е.Д.). В южном полушарии общая картина
сезонных изменений такая же, хотя и менее выраженная.
12. Содержание озона в атмосфере
• 1) полярная зона — характеризуется наибольшимизначениями среднегодового общего содержания (около 400
е.Д.) и концентраций озона, наибольшими сезонными
колебаниями (около 50%); зона максимальной концентрации
озона расположена наиболее близко к поверхности — на
высотах 13-15 км.
• 2) тропическая зона — среднегодовые значения общего
содержания озона невелики и составляют примерно 265
е.Д., сезонные колебания не превышают 10-15%; зона
максимальной концентрации озона находится на высотах 2427 км.
• 3) средние широты —занимают промежуточное положение,
сезонные изменения составляют 30-40% от средних
значений, зона максимальной концентрации озона
находится на высотах 19-21 км.
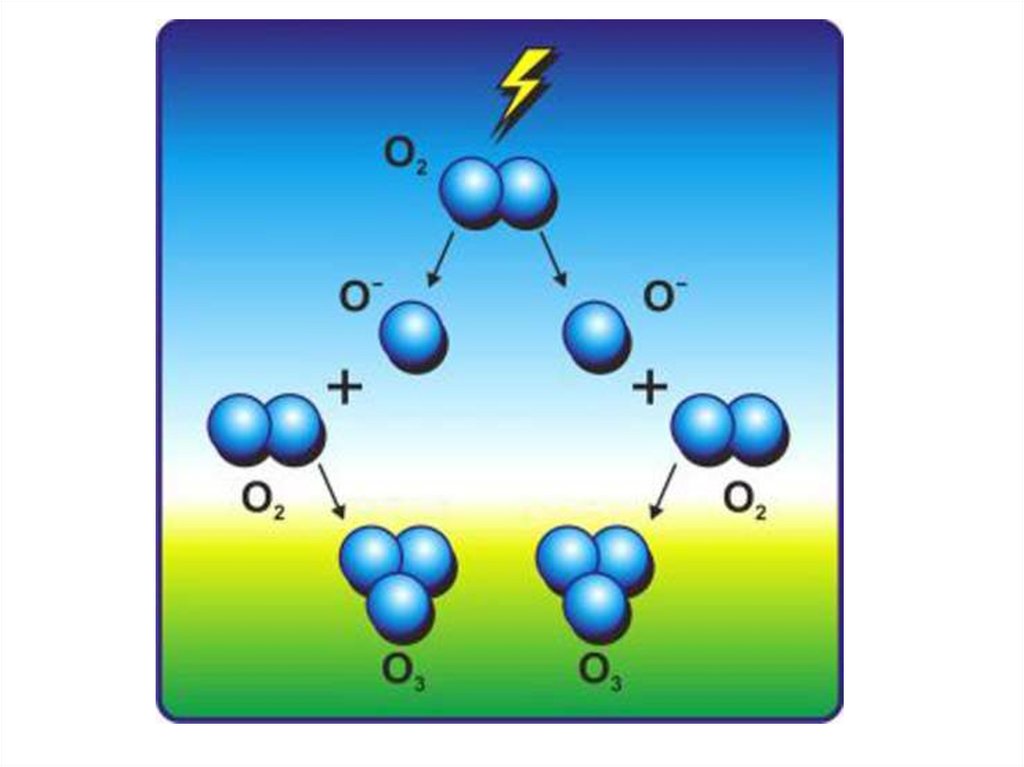
13. Образование и разрушение озона
При взаимодействии с излучением длиной волны менее 240 нм молекулакислорода, как уже отмечалось выше, диссоциирует с образованием двух
атомов кислорода. В зависимости от величины энергии поглощенного кванта
один или оба образующихся атома кислорода могут находиться в
возбужденном состоянии:
О2 + hv → О(1D) + О(3P),
где О(1D) — атом в возбужденном состоянии; О (3Р) — атом в основном
состоянии.
Только атом, находящийся в основном состоянии, способен вступить в
реакцию синтеза озона:
О2 + О(3Р)+М →О3+М*,
где М —так называемое «третье тело», присутствие которого необходимо
для отвода части энергии, выделяющейся в процессе. В результате реакции
третье тело, в качестве которого в атмосфере выступают молекулы азота или
кислорода, которых значительно больше, чем других газов, переходит в
возбужденное состояние (М*).
14.
Молекула озона может взаимодействовать сатомом кислорода с образованием двух молекул
кислорода:
О3 + О →2О2.
Эта реакция, часто называемая реакцией с
участием «нечетного кислорода», приводит к
стоку озона из стратосферы. Однако скорость
этой реакции значительно ниже скорости
реакции образования озона
15.
16.
В зависимости от энергии поглощенногокванта образующийся атом кислорода может
находиться в возбужденном или в основном
состоянии:
О3 + hv →О2 + О(1D)
О3+ hv →О2 + О(3Р)
17. Нулевой цикл озона
• Атом кислорода в основном состоянииможет вновь принять участие в синтезе
озона. Реакции образования и разложения
озона часто называют нулевым циклом
озона.
О3+ hv →О2 + О(3Р)
3
О2 + О( Р)+М →О3+М*
18. Циклические процессы разрушения озона
• Водородный цикл• Азотный цикл
• Хлорный цикл
• Бромный цикл
19. Водородный цикл
• При поглощении кванта света с длиной волныменее 240 нм молекулы воды могут распадаться с
образованием гидроксидного радикала и
атомарного водорода:
Н2О + hv → ОН + Н
• Гидроксидные радикалы образуются и при
взаимодействии молекул воды или метана с
возбужденным атомом кислорода:
О(1D)+H2О → 2ОH
О(1D) + CH4 → СНз + ОН
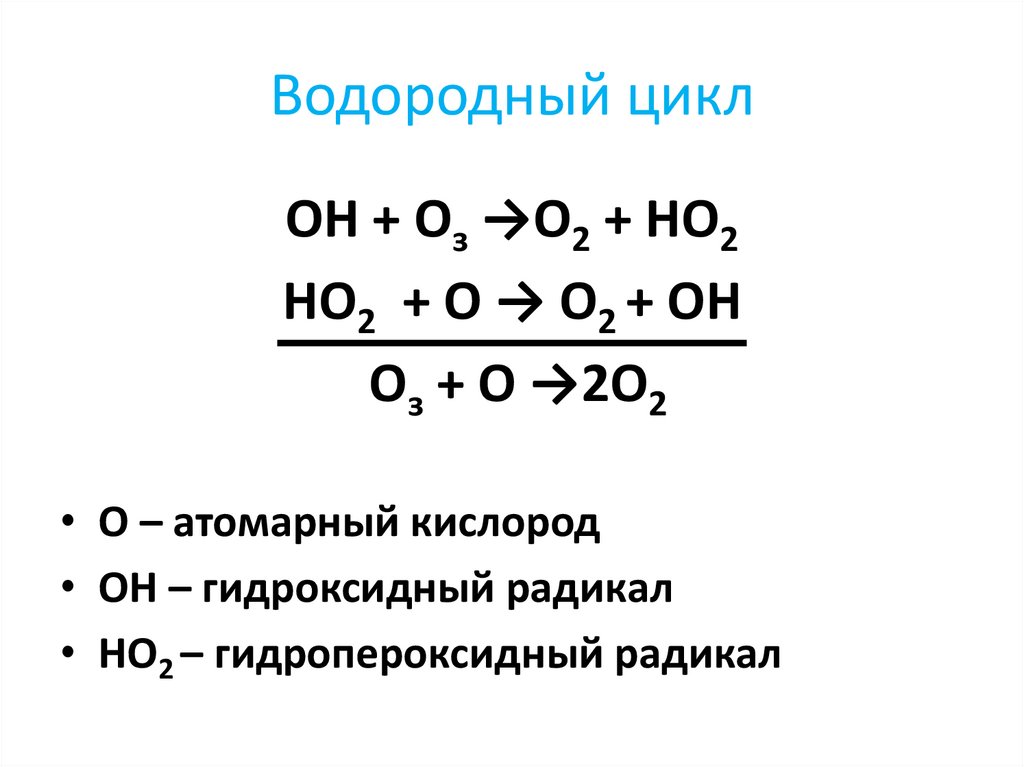
20. Водородный цикл
ОН + Оз →О2 + НО2НО2 + О → О2 + ОН
Оз + О →2О2
• О – атомарный кислород
• ОН – гидроксидный радикал
• НО2 – гидропероксидный радикал
21. Азотный цикл
Источником оксидов азота является:1. Взаимодействие гемиоксида азота с
возбужденным атомом кислорода
N2О + О(1D) →2NO
2. Самолеты, летающие в стратосфере и
космические корабли
22. Азотный цикл
NO + Оз →О2 + NО2NО2 + О → О2 + NO
Оз + О →2О2
23. Хлорный цикл
Источником атомов хлора являетсяфотохимическое разложение
хлорфторуглеводородов (ХФУ)
Попадая в стратосферу, эти соединения могут
взаимодействовать с излучением с длиной
волны менее 240 нм, при этом происходит
образование атомарного хлора, как,
например, в случае фреона Ф-11 (CFCl3)
CFCI3 + hv → CFC12 + CI
24.
25. Хлорный цикл
Cl + Оз →О2 + ClОClО + О → О2 + Cl
Оз + О →2О2
ClО – оксид хлора
26. Хлорный цикл
27. Бромный цикл
• Во всех рассмотренных до этого циклах нарушенияозонового слоя реакция с участием атомарного
кислорода является наиболее медленной, и ее скорость
лимитирует соответствующие циклы. В случае бромного
цикла процесс значительно ускоряется, и бром
потенциально наиболее опасен для озонового слоя.
Однако влияние этого цикла на озоновый слой в
настоящее время меньше, чем влияние других
рассмотренных циклов. Это связано с меньшими
концентрациями брома в стратосфере. Основными
источниками брома в стратосфере являются бром
содержащие органические соединения, используемые
для тушения пожаров (галоны).
28. Бромный цикл
Вг + Оз →ВгО + О2ВгО + ВгО → 2Вг + О2
ВгО + СlО → Вг + Сl + О2
29. Обрыв цепи в процессах, вызывающих разрушение озона
• В рассмотренных выше цепных процессах«активные» частицы не расходуются.
Каждая из «активных» частиц может
многократно (до 107 раз) инициировать
цикл разрушения озона, пока не будет
выведена из зоны с максимальным
содержанием озона
• Наличие процессов вывода (стока
«активных» частиц), приводящих к обрыву
реакционной цепи, имеет большое
значение с точки зрения сохранения
озонового слоя, поскольку при отсутствии
таких процессов весь озон в атмосфере
был бы разрушен.
30. Обрыв цепи в процессах, вызывающих разрушение озона
• Гидроксидный и гидропероксидныйрадикалы, являющиеся «активными»
частицами водородного цикла, могут
вступать во взаимодействие с различными
компонентами атмосферного воздуха, но
наиболее вероятными для стратосферы
являются следующие реакции:
СН4+ОН →СН3+Н2О
ОН + НО2 →Н20 + О2
31. Обрыв цепи в процессах, вызывающих разрушение озона
Возможным представляется и взаимодействиегидроксидного радикала с оксидом азота:
OH + NO →HNО2
Протекание этого процесса приводит к образованию
временного резервуара для «активных» частиц
водородного и азотного циклов, поскольку
азотистая кислота сравнительно легко разлагается с
образованием исходных «активных» частиц
32. Обрыв цепи в процессах, вызывающих разрушение озона
Образование временных резервуаров в видеазотной и азотистой кислот является одной из
особенностей азотного цикла. Окончательный
обрыв цепи превращений азотного цикла наступает
в результате вывода этих временных резервуаров из
зоны с максимальной концентрацией озона в
тропосферу
33. Обрыв цепи в процессах, вызывающих разрушение озона
Особое значение для обрыва цепи имеет реакциявзаимодействия оксида хлора и диоксида азота, которая
приводит к образованию сравнительно устойчивого и
инертного по отношению к озону хлористого нитрозила:
СlO + NO →ClONО2
СlO+ СlO → (СlO) 2
Следует обратить внимание на то, что этот процесс
интенсифицируется при увеличении концентраций СlO и NО2 в
атмосфере и делает практически невозможным одновременное
осуществление азотного и хлорного циклов. Однако при
определенных условиях этот временный резервуар для сбора
«разрушителей» озонового слоя может представлять серьезную
опасность для озона
34. «Озоновая дыра» над Антарктидой
Понятие «озоновой дыры» связывают с уменьшениемобщего содержания озона во всех областях атмосферы
над определенной территорией. Наиболее часто это
явление ассоциируется с уменьшением общего количества
озона над Антарктидой, где такой процесс, протекающий с
разной интенсивностью, в последние десятилетия
наблюдается практически ежегодно и где он был
зафиксирован впервые.
Над Антарктидой явление «озоновой дыры» носит
ярко выраженный сезонный характер и проявляется лишь
в весенний период. Например, весной 1987 г.
наблюдалось уменьшение содержания озона с 300 е.Д. до
150-200 е.Д., а в некоторых областях до 100 е.Д., причем
зона, в которой содержание озона составляло менее 200
е.Д., в этот период занимала примерно 40 млн км2.
35. «Озоновая дыра» над Антарктидой
36. «Озоновая дыра» над Антарктидой
• Теоретически процесс был описан в начале70-х годов 20-го века, экспериментальные
доказательства механизма образования
«озоновой дыры» над Антарктидой
получены в 80-х годах
37. «Озоновая дыра» над Антарктидой
В 1995 г. ученыеП. Крутцен (ФРГ),
Ш. Роуланд (США),
М. Молина (США),
занимавшиеся этой
проблемой, были
удостоены Нобелевской
премии по химии.
38. «Озоновая дыра» над Антарктидой
• В соответствии с современными представлениями, причинаобразования «озоновой дыры» над Антарктидой является
комплексной и связана как с совокупностью природных
явлений (полярный вихрь), так и с антропогенным
влиянием на состояние атмосферного воздуха.
• Систематическое увеличение поступления
хлорфторуглеводородов в атмосферу, наблюдавшееся во
второй половине прошлого века, и специфика движения
воздушных масс в стратосфере высоких широт привели к
тому, что в период возникновения «озоновой дыры»
концентрация озоноразрушающих веществ в воздухе над
Антарктидой резко возрастала. Например, содержание
оксида хлора превышало соответствующие значения,
регистрируемые в соседних областях стратосферы, в сотни
раз. При таких высоких концентрациях СlO протекает
процесс образования димеров (СlO)2.
39. «Озоновая дыра» над Антарктидой
• Устойчивый антициклон, такназываемый полярный вихрь,
возникающий каждой зимой над
Антарктидой, приводит к
временному прекращению обмена
воздухом с другими областями
стратосферы и стоку озона в
тропосферу. Поступление озона,
образующегося в тропической или
среднеширотной зонах
стратосферы, в этот период
прекращается. Однако
возникающий дефицит озона в
условиях полярной ночи не
представляет опасности для биоты.
40. «Озоновая дыра» над Антарктидой
Температура воздуха внутри вихря резко снижается до -70 или-80°С. В стратосфере появляются устойчивые аэрозольные
образования— «серебристые» облака, состоящие из кристаллов
льда и капель переохлажденной жидкости. В состав этих
аэрозолей входят димеры оксида хлора (СlO)2 , хлористый
нитрозил (CIONO2 ) и другие соединения азота (HNO2 , HNO3 ).
41. «Озоновая дыра» над Антарктидой
• В зимний период эти соединения, связанные саэрозолями, не взаимодействуют с озоном.
Весной циркумполярный вихрь распадается, и
при повышении температуры на поверхности
кристаллов льда начинают протекать
гетерогенные химические процессы:
ClONO2 + H2О→HOCl + HNO3
или
ClONО2 + HCl→Cl2+HNО3
42. «Озоновая дыра» над Антарктидой
Образующиеся молекулы Сl2 и НОСl неустойчивы и вотличие от НСl и CIONO2 при появлении первых солнечных
лучей распадаются даже под воздействием видимого
излучения:
Cl2 +hv→ 2Сl
НОСl + hv → ОН + Сl
Таким образом, с наступлением весны в стратосфере
над Антарктидой появляется ряд озоноразрушающих
веществ, и начинаются цепные процессы разрушения
озона на фоне природного дефицита озона, содержание
которого не успевает восстановиться после окончания
полярной ночи и разрушения вортекса.
43. «Озоновая дыра» над Антарктидой
Особую роль в разрушении озона надАнтарктидой играют димеры оксида хлора. Эти
соединения неустойчивы и при воздействии
излучения разлагаются:
(СlO)2 + hv → CI + ClOO
и далее
СlOО→Сl + O2
Суммируя все уравнения реакций «димерного
цикла» получим:
2O3 + hv → 3O2
44. «Озоновая дыра» над Антарктидой
Протекание гетерогенных реакций и «димерныйцикл» резко интенсифицируют процесс разрушения
озона над Антарктидой в весенний период и приводят
к образованию «озоновой дыры».
В дальнейшем кристалики льда растают,
гетерогенные процессы прекратятся, оксид хлора
частично израсходуется, а частично свяжется с
диоксидом азота в хлористый нитрозил.
В основном благодаря динамическим процессам
стратосферной циркуляции в полярную область
поступит озон из других областей атмосферы, часть
его будет синтезирована над Антарктидой, и «дыра»
постепенно, в течение одного-двух месяцев закроется.
45. Международные соглашения, направленные на сохранение озонового слоя
Первым международным актом, ограничивающим производство фреонов идругих разрушающих озоновый слой соединений, стал Монреальский протокол.
Он был подписан тридцатью странами в 1987г. и вступил в силу с 1 января 1989 г.
Основными положениями Монреальского протокола были определены
следующие действия, которые обязались предпринять подписавшие его страны:
1) производство фреонов 11, 12, 113, 114, 115
• заморозить на уровне 1986 г. начиная с 1992 г.;
• сократить до 80% от уровня 1986 г. начиная с 1993 г.;
• сократить до 50% от уровня 1986 г. начиная с 1998 г.;
2) производство галонов (бромированных галогеналканов для тушения пожаров)
ограничить на уровне 1986 г.
В 1989 г. Совет министров Европейского сообщества объявил, что производство
фреонов будет полностью прекращено к 2000 г. США сделали аналогичное
заявление. Годом позже страны, подписавшие Монреальский протокол (их стало
более 60), одобрили эту политику.
46.
В 1990 г. Монреальский протокол был вновьпересмотрен. Страны, его подписавшие, взяли на себя
следующие обязательства:
1)
производство фреонов
• сократить до 50 % начиная с 1995 г.;
• сократить до 15 % начиная с 1997 г.;
• прекратить полностью к 2000 г.;
2) производство тетрахлорметана (четыреххлористого
углерода, используемого в качестве растворителя)
• сократить до 15 % начиная с 1995 г.;
• прекратить полностью к 2000 г.;
3) производство галонов прекратить к 2000 г. (за
исключением соединений, для которых не известны
альтернативные заменители);
4) производство 1,1,1-трихлорэтана (используемого в
качестве растворителя)
• сократить до 70% начиная с 1995 г.;
• сократить до 30% начиная с 1997 г.;
• прекратить полностью к 2005 г.
47. Уменьшение озоноопасности фреонов
Вместо опасных фреонов в соответствующих отраслях промышленностииспользуются зачастую менее эффективные, но более безопасные
органические соединения.
Например, введение в молекулу хлорфторуглеводорода атомов водорода:
CFCI3 → CНFCI2
делает соединение более реакционноспособным, его время жизни в
тропосфере значительно уменьшается, и такие соединения уже не
способны достичь стратосферы и повлиять на содержание в ней озона.
Другой путь связан с полной или частичной заменой атомов хлора в
молекуле фреона:
CНFCI2 → CНF3
В этом случае молекула либо может стать более реакционноспособной (с
уменьшением времени жизни), либо она не будет представлять опасности
для озонового слоя, поскольку хлорный цикл в отсутствие хлора
невозможен.











































 geography
geography








