Similar presentations:
Атмосфера. Строение атмосферы. Озоновый слой
1.
Атмосфера.Строение атмосферы.
Озоновый слой
2. ПЛАНЕТАРНЫЕ ГРАНИЦЫ
КЛИМАТ350 ppm СО2
+1 W/m2
ОЗОНОВЫЙ СЛОЙ
276 DU
АТМОСФЕР
НЫЙ
АЭРОЗОЛЬ
TBD
БИОГЕОХИМИЧЕ
СКИЕ ЦИКЛЫ
35 MT N/yr
11 MT P/yr
ЗАКИСЛЕНИ
Е ОКЕАНА
ПОТЕРЯ
БИОРАЗНООБР
АЗИЯ
10 E/MSY
С/Х
ЗЕМЛИ
15%
Aragonite
saturation ratio >
2.75
ПРЕСНАЯ
ВОДА
ХИМИЧЕС
КОЕ
ЗАГРЯЗНЕ
НИЕ
4000 km3/yr
2
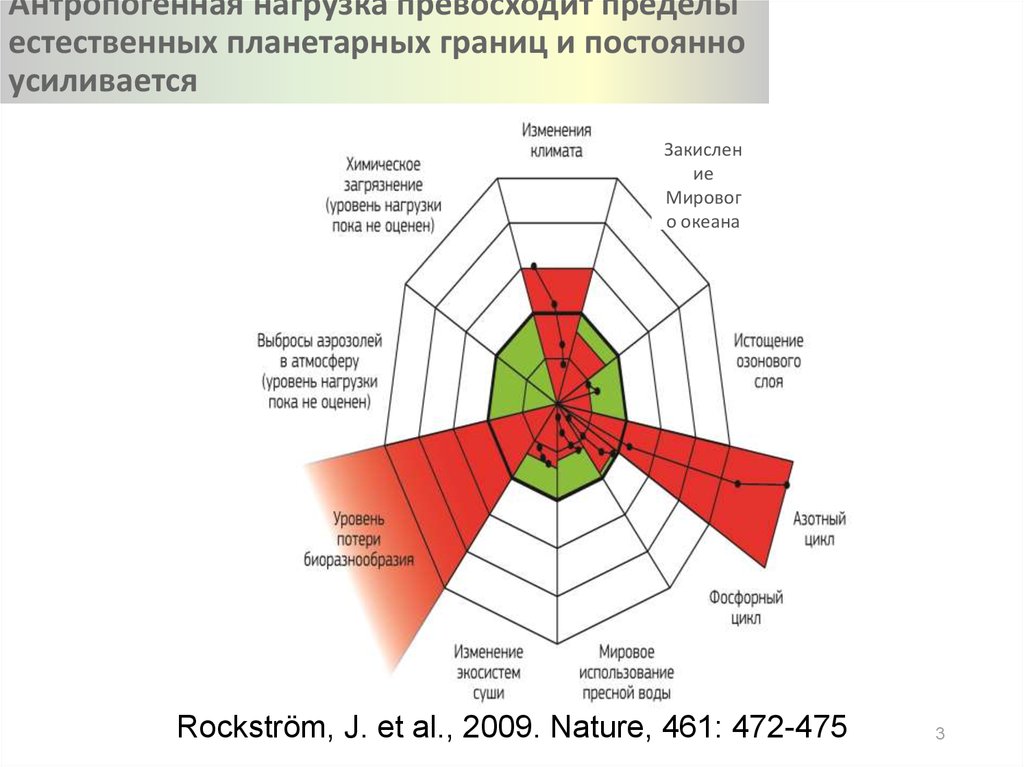
3. Антропогенная нагрузка превосходит пределы естественных планетарных границ и постоянно усиливается
Закисление
Мировог
о океана
Rockström, J. et al., 2009. Nature, 461: 472-475
3
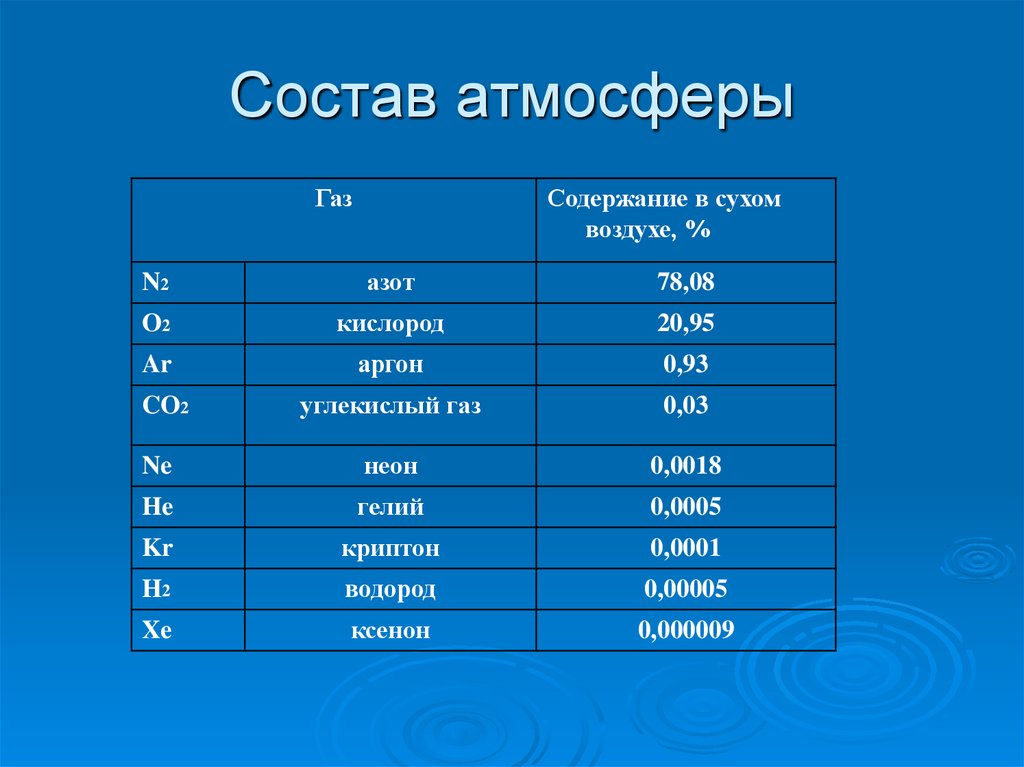
4. Состав атмосферы
ГазСодержание в сухом
воздухе, %
N2
азот
78,08
O2
кислород
20,95
Ar
аргон
0,93
углекислый газ
0,03
Ne
неон
0,0018
He
гелий
0,0005
Kr
криптон
0,0001
H2
водород
0,00005
Xe
ксенон
0,000009
CO2
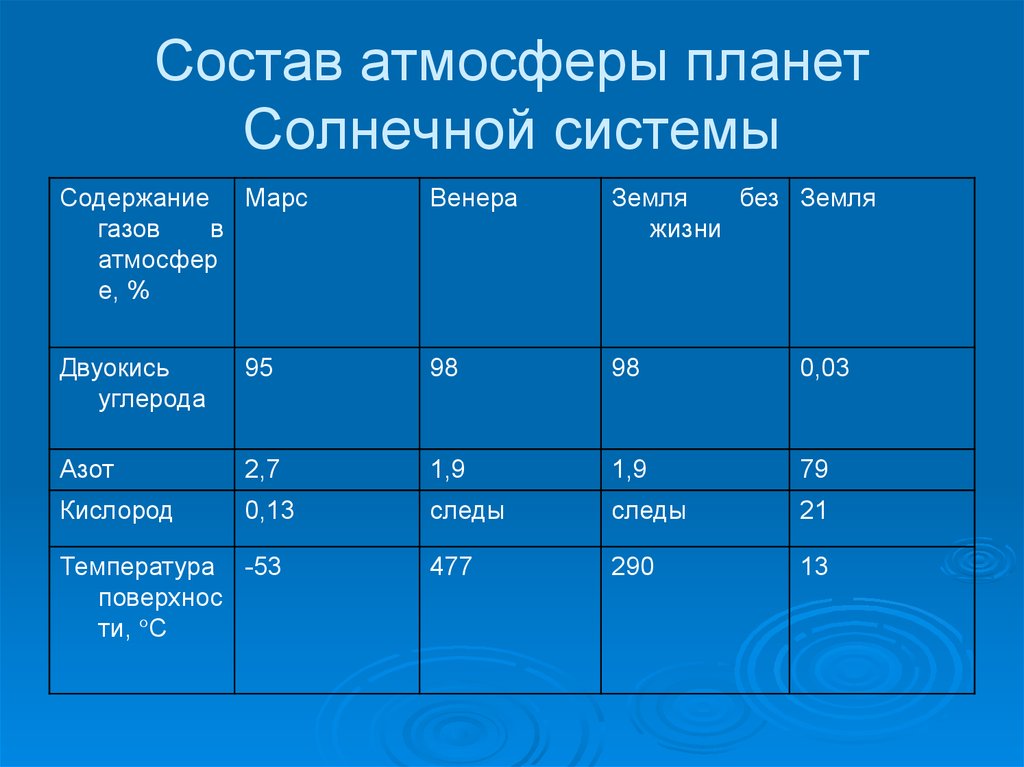
5. Состав атмосферы планет Солнечной системы
Содержание Марсгазов
в
атмосфер
е, %
Венера
Земля
без Земля
жизни
Двуокись
углерода
95
98
98
0,03
Азот
2,7
1,9
1,9
79
Кислород
0,13
следы
следы
21
477
290
13
Температура -53
поверхнос
ти, °С
6.
7.
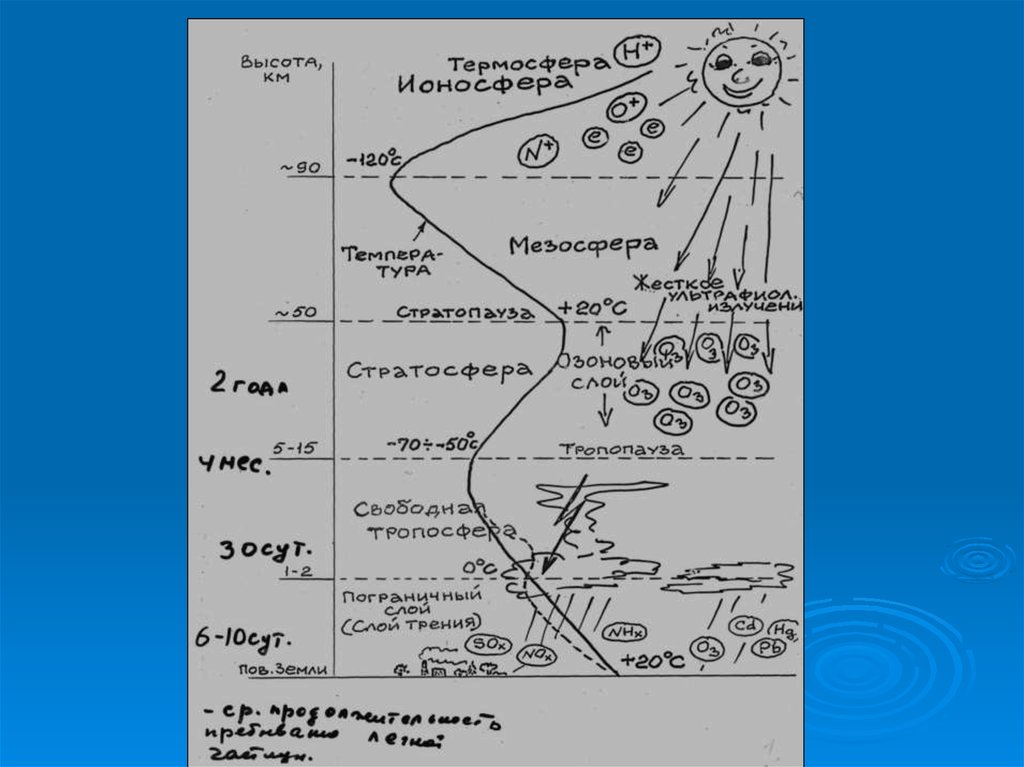
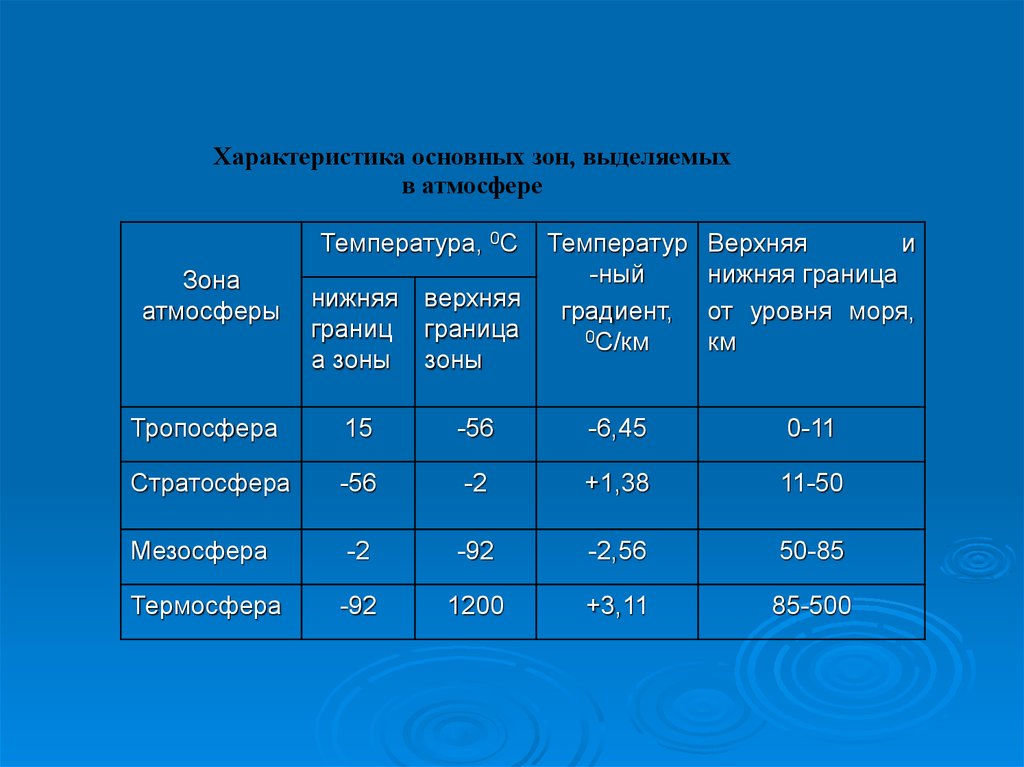
Характеристика основных зон, выделяемыхв атмосфере
Температура, 0С
Зона
атмосферы
нижняя верхняя
границ граница
а зоны зоны
Температур
-ный
градиент,
0С/км
Верхняя
и
нижняя граница
от уровня моря,
км
Тропосфера
15
-56
-6,45
0-11
Стратосфера
-56
-2
+1,38
11-50
Мезосфера
-2
-92
-2,56
50-85
Термосфера
-92
1200
+3,11
85-500
8.
Способы выражения концентрации примесей в воздухеОбъемная доля – a
a = v / V,
где v – объем примеси, V – объем газа, в котором она находится.
% об. = a * 100
ppm = млн -1 = a * 106
ppb = млрд-1 = a * 109
9. Тропосфера
Тропосфера– нижний, непосредственно
соприкасающийся с земной
поверхностью, слой атмосферы. Именно
воздухом тропосферы дышат живые
организмы, влага, конденсирующаяся в
тропосфере и выпадающая с
атмосферными осадками, обеспечивает
человека питьевой водой, а
проникающее через тропосферу
солнечное излучение используется
автотрофными организмами в процессе
фотосинтеза.
10.
11.
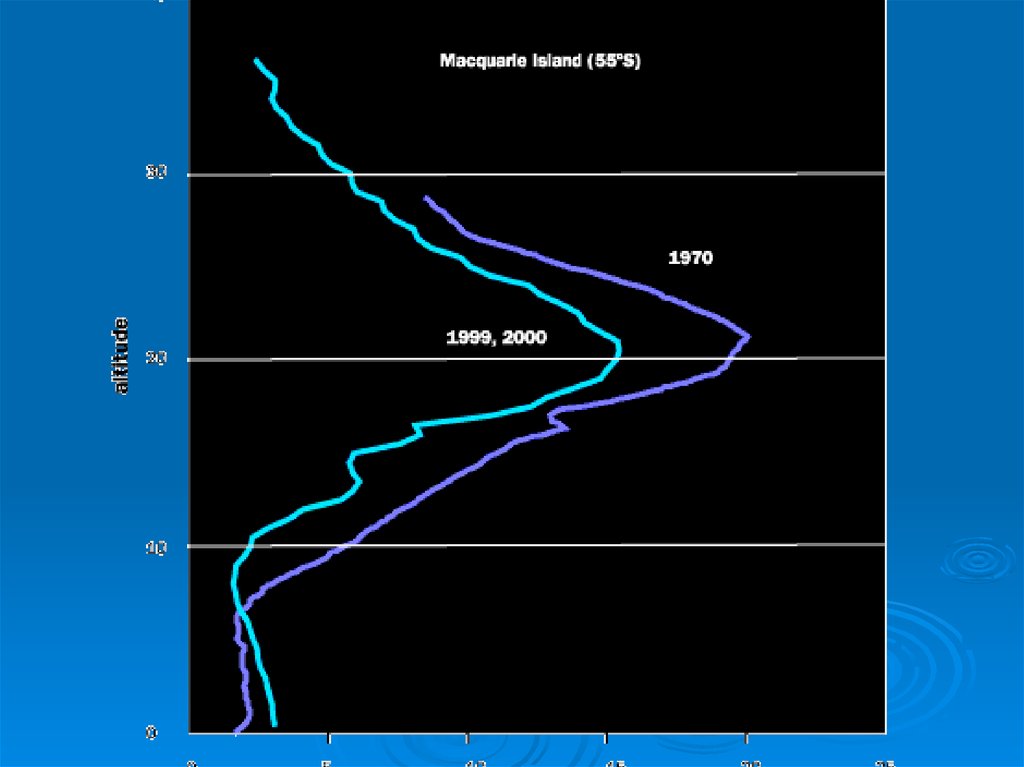
Основная масса озона сосредоточена в слое15 - 35 км
с максимумом концентрации в слое
20 - 25 км
Даже в самом озоновом слое только одна
молекула из 100 000 является молекулой
озона.
12.
13.
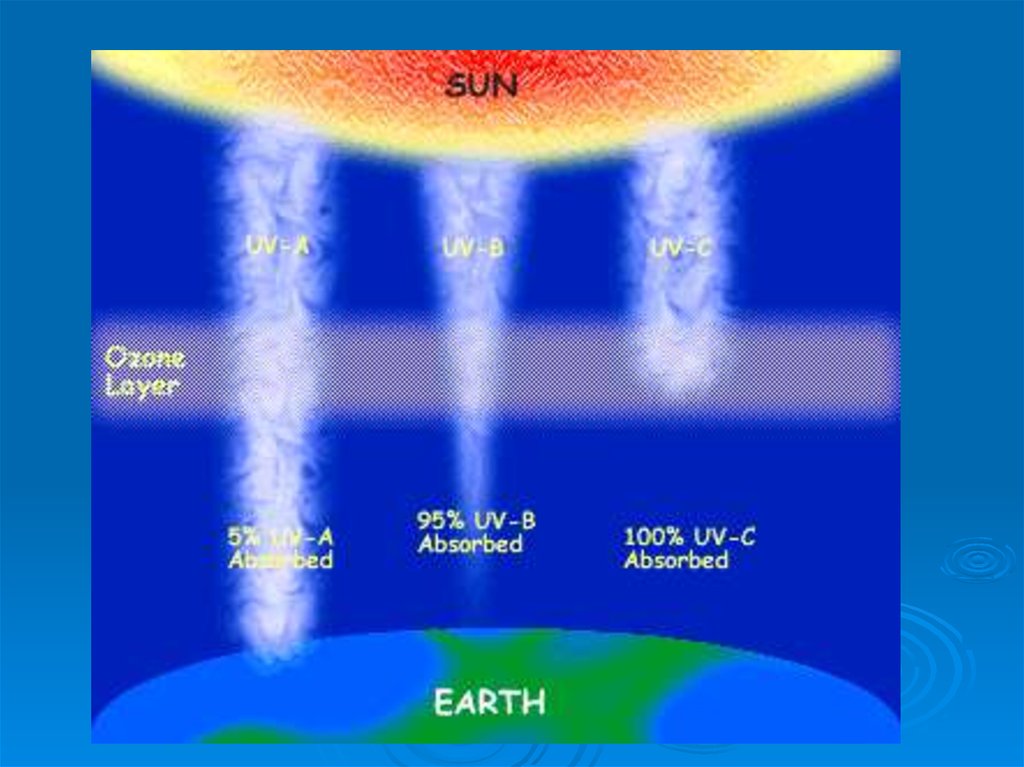
Ультрафиолет– излучение с длиной
волны 10 ≤ ≤ 400 нм,
Ультрафиолет с длиной волны 200 ≤ вакуумный, задерживается на высоте
ок. 50 км
ультрафиолет В - излучение с длиной
волны 200 ≤ ≤ 320 нм,
ультрафиолет А – излучение с длиной
волны 320 ≤ ≤ 400 нм,
14.
15. 1 нм = 10 Å 1А = 0,1 нм
1 нм = 10 Å1А = 0,1 нм
Стратосферный
озон поглощает
ультрафиолетовое излучение в
диапазоне волн 200–320 нм (UV-B )
В результате при истощении озонового
слоя возрастает именно UV-B
излучение.
16. Уменьшение плотности озонового слоя на 10%
(сегодняшняяситуация) приводит к
увеличению опасного UV-B излучения
на 13%, что в свою очередь
провоцирует рост числа заболеваний
раком кожи разного типа теоретически
на 20 – 30%.
17.
18. UV-B излучение
.составляет всего лишь 2% полного
солнечного излучения, причём далеко
не всё оно доходит до земной
поверхности,
однако именно это излучение
определяет загар, вызывает рак кожи,
ухудшение зрения.
19. UV-B
Апоскольку молекулы ДНК поглощают
излучение в том же диапазоне длин
волн, что и озон, рост UV-B излучения
повреждает эти молекулы, снижает
скорость деления и, в конце концов,
приводит к их гибели
20.
Длячеловечества важно и то, что
повышение UV-B излучения пагубно
для всего живого мира и прежде всего –
океанического фитопланктона, который
составляет начальное звено в
природной цепи питания.
21. Свойства молекулы озона
Энергиясвязи атомов в молекуле озона
составляет 23, 9 ккал на моль, что в
пять раз меньше, чем в молекуле
кислорода.
Это приводит к тому, что молекула
озона разваливается под действием
даже видимого солнечного излучения.
22.
Озонв стратосфере образуется в
результате фотохимической диссоциации
молекулярного кислорода под
воздействием солнечной радиации с
длиной волны h ≤240 nm
где
О2 + h O + O
2 [O + O2 + M O3 + M ]
M - любая молекула (обычно азота
или кислорода), уносящая из реакции
избыток энергии.
Реакция была открыта в 1930 г.
Сиднеем Чепманом
23.
Поскольку кислород в атмосферепредставлен почти
исключительно как О2 , ясно, что
должны существовать процессы,
реконвертирующие основную
часть O3 в О2 :
NO + O3 NO 2+ O2
O + NO2 NO + O2
О3 + h O + O2
Азотный цикл
24.
Опасностьпредставляют только
образующиеся непосредственно в
стратосфере оксид и диоксид азота.
Из тропосферы они не доходят из-за
малого срока жизни.
Исключение гемиоксид азота N2O
25.
Cl + O3 ClO + O2ClO + O Cl + O2
О3 + h O + O2
Один атом хлора может разрушить 105 молекул
озона.
Хлорный цикл
26.
На высоте около 25 км вследствиевысокой интенсивности солнечной
радиации происходит разрушение ХФУ
(фреонов) с выделением атомов хлора
(Cl) и молекул монооксида хлора (ClO),
которые являются более сильными
катализаторами процесса разрушения
молекул озона, чем оксиды азота
27. Нобелевская премия по химии вручается с 1901 года
Крутцен, Роуленд и Молина ,Нобелевская премия по
химии, 1995
28. Нобелевская премия по химии, 1995
«заработу по химии атмосферы,
особенно в связи с образованием и
разрушением озона».
Марио Молина
Шервуд Роуленд
Пауль Крутцен
29.
Встолбе Земной атмосферы
прослойка чистого озона имела бы
толщину около 3 мм (при нормальных
условиях).
Содержание озона в атмосфере
измеряется в специальных "единицах
Добсона" (ЕД, DU).
Слой озона в 3 мм составляет 300 ЕД.
30. Механизм образования «озоновых дыр»
Антарктидасо всех сторон окружена
океаном и ветры могут
беспрепятственно циркулировать
вокруг континента. Во время зимы
вокруг Антарктиды возникает
околополюсной вихрь - своеобразная
воронка из ветров, которая собирает
воздух над Антарктидой и не дает ему
смешиваться с остальной атмосферой.
31. Механизм образования «озоновых дыр»
В стратосфере при температуре ниже-100°С происходит конденсация
азотной кислоты, появляющейся в
результате взаимодействия окислов
азота и воды. Образуются, так
называемые, полярные стратосферные
облака. Поверхность мельчайших
кристаллов этих облаков катализирует
реакции высвобождения хлора из
фреонов, соляной кислоты и других
галогенсодержащих веществ.
32. Механизм образования «озоновых дыр»
Втемноте антарктической зимы атомы
хлора не сразу вступают в цепную
реакцию по разрушению озона, а
образуют димер оксида хлора.
Cl + O3 >> ClO + O2;
ClO + ClO >> ClO-ClO.
33. Механизм образования «озоновых дыр»
Когда наступает весна, солнечнаярадиация разрушает накопившийся
димер, хлор высвобождается и
начинается цепная реакция разрушения
озона. Постепенно околополярный
вихрь рассеивается и обедненный
озоном воздух перемешивается с
нормальным - концентрация озона
опять повышается.
34.
Использование ХФУ( хлорфторуглеродов)• охладители в холодильных установках и
кондиционерах.
• для производства поролонов и пенопластов материалов, широко используемых во многих
потребительских товарах, начиная от
одноразовой пенопластовой посуды и
заканчивая изоляционными материалами.
• в баллонах для распыления аэрозолей
• для промывания электрооборудования.
35.
В 1987 года представители 24 стран вМонреале подписали соглашение, по которому
обязались сократить вдвое использование
озоноразрушающих ХФУ к 1999-му году.
Однако в связи с ухудшающейся ситуацией в
1990-м году в Лондоне были приняты поправки
к Монреальскому протоколу.
Согласно Лондонским поправкам в список
регулируемых ХФУ вошли еще 10 веществ и
было принято решение прекратить
использование ХФУ, галогенов и
четыреххлористого углерода к 2000-х
тысячному, а метилхлороформа - к 2005-му
году
36.
В Монреале была принята система, покоторой озоноразрушающие вещества
подразделялись по следующим
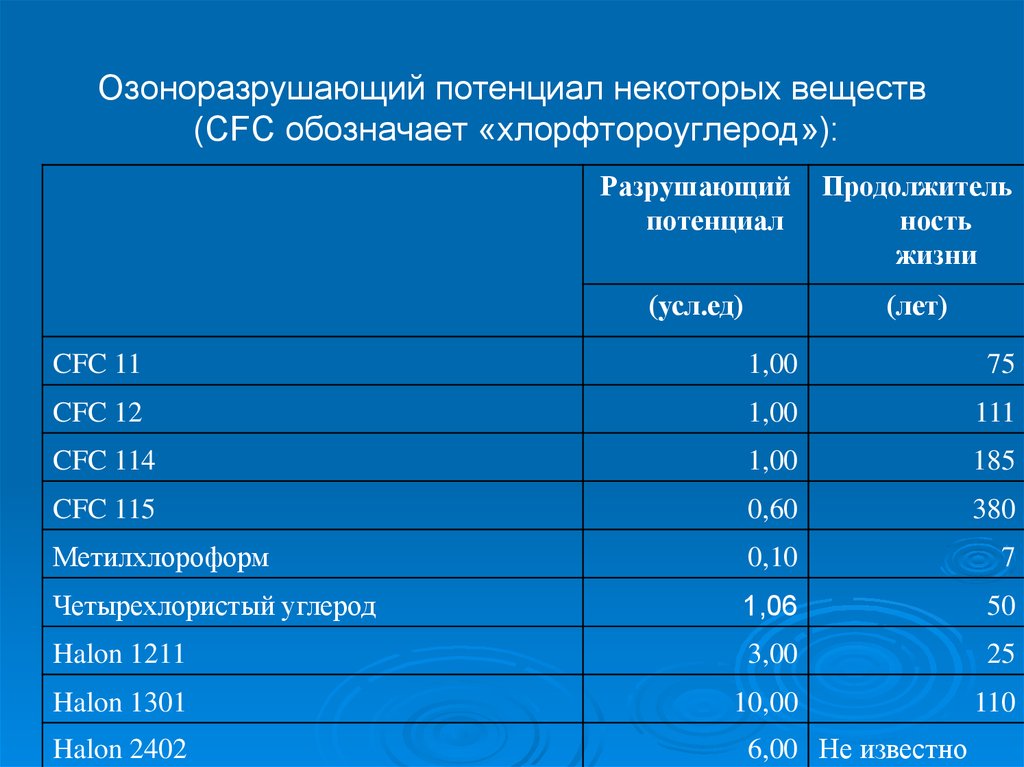
критериям:
• способность разрушать озон
• продолжительность их жизни
37. Озоноразрушающий потенциал некоторых веществ (CFC обозначает «хлорфтороуглерод»):
Разрушающийпотенциал
Продолжитель
ность
жизни
(усл.ед)
(лет)
CFC 11
1,00
75
CFC 12
1,00
111
CFC 114
1,00
185
CFC 115
0,60
380
Метилхлороформ
0,10
7
Четырехлористый углерод
1,06
50
Halon 1211
3,00
25
Halon 1301
10,00
110
Halon 2402
6,00 Не известно
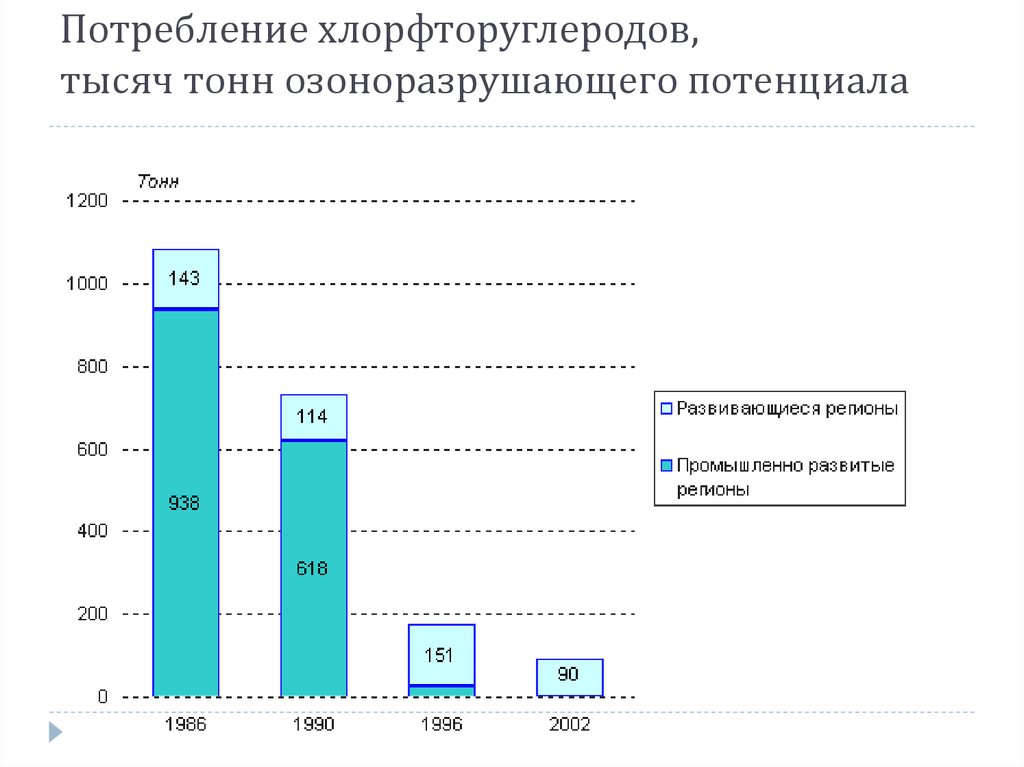
38. Потребление хлорфторуглеродов, тысяч тонн озоноразрушающего потенциала
Потребление хлорфторуглеродов,тысяч тонн озоноразрушающего потенциала





























 geography
geography