Similar presentations:
Эпигеномная регуляция процессов эбрионального развития млекопитающих
1.
Эпигеномная регуляцияпроцессов эбрионального развития
млекопитающих
2.
Случайная инактивация Х-хромосомы – “черепаховая” окраска у кошекСлучайная инактивация Х-хромосомы:
Различная окраска клонированной и исходной кошки
3.
Компенсация дозы:как происходит инактивация
второй Х-хромосомы
в эмбриогенезе мыши?
4.
Механизм инактивации второй Х-хромосомыТельце Барра:
инактивация одной
из Х-хромосом
в клетках
ХХ эмбриона
5.
Центр инактивации Х-хромосомы (Xic)В центре инактивации Xic расположен ген
Xist (X-inactive specific transcript), продуктом
которого является функциональная РНК,
которая на ранних этапах инактивации
необходима и достаточна для «выключения»
генов Х-хромосомы.
Активность гена Xist негативно регулируется
геном Tsix. Эти гены частично
перекрываются между собой (каждая цепь
участка двуцепочечной ДНК несет свою
информацию) что отражено в названии
последнего - Tsix, это Xist наоборот. Помимо
этих двух генов в центре инактивации
обнаружено еще 9 генов, для которых роль в
процессе Х-инактивации пока не до конца
ясна
В 1963 году С. Растан с соавторами предсказали
существование на Х-хромосоме района,
отвечающего за инактивацию прилегающих
участков хромосомы – центра инактивации Хic.
Это предположение было сделано на
основании того, что при встраивании
некоторых фрагментов Х-хромосомы в состав
неполовых хромосом (аутосом) происходит
выключение примыкающих к месту
интеграции аутосомных генов. По-видимому,
такая «гибридная» хромосома, несущая центр
инактивации Xic, воспринимается клеткой как еще
одна Х-хромосома и учитывается при «расчете»
дозы генов.
Таким образом, центр инактивации Xic является
«визитной карточкой» Х-хромосомы для систем
клетки. Центр инактивации Xic содержит
элементы, отвечающие за подсчитывание всех Ххромосом (центров Xic), а так же за выбор
будущей единственной активной Х-хромосомы.
Делеция элементов, ответственных за выбор,
приводит к преимущественной инактивации Ххромосом с интактным центром Xic, а
повреждение счетных элементов центра Xic
вызывает инактивацию единственной Ххромосомы в клетках с кариотипом Х0 и ХY.
http://www.bionet.nsc.ru/labs/epigenetics/?page_id=304
6.
Возможные механизмы инактивации второй Х-хромосомы“Импринтированная”
В ХХ эмбрионах в ТЭ и ПЭ всегда
выключаются отцовская, но не материнская
Х-хромосома
Но почему в ХУ эмбрионах не
выключается единственная Х-хромосома?
В Х-хромосоме, полученной от матери, есть
импринт, блокирующий экспрессию Xist, (но
не за счет метилирования). Этот импринт,
вероятно, связан с модификациями гистонов
и устанавливается во время созревания
ооцитов.
В Х-хромосоме, полученной от отца, в
области промотора Xist есть
низкометилированные СрG-участки,
деметилирование в них происходит во время
сперматогенеза.
• У сумчатых – Х-инактивация
только по принципу импритига
(всегда выключена отцовская Xхромосома)
• У мыши – в ТЭ и ПЭ –
импритинг, остальные ткани –
случайный механизм
• У человека?
“Случайная?”
В ХХ эмбрионах инактивируются все Ххромосомы, кроме одной (у тетраплоидных
мышиных эмбрионов выключаются 3 из 4-х Ххромосом). Почему?
В ХУ эмбрионах не выключается
единственная Х-хромосома
Теория “блокирующего фактора”
Есть некий фактор (неизвестной природы),
который связывается с Х-хромосомой в зоне Хic и
блокирует экспрессию гена Xist. Разные аллели Xic
имеют разное сродство к этому фактору. Если
аллель одна, то фактор связывается с ней (нет
конкуренции) и Хist инактивируется.
“Или неслучайная?”
Влияние Tsix: делеции в промоторе Tsix
приводят к предпочтительной инактивации этой
хромосомы. Вероятно, образование Xist-Tsix (по
принципу сенс-антисенс) двуцепочечных РНК
• В реконструированный ХХ эмбрионах (2
отцовских или 2 материнских пронуклеуса – так
называемые андрогенетические и
гиногенетические эмбрионы) нарушаются
паттерны инактивации Х-хромосом
• У мышей на Х-хромосоме есть локус Xce (Хcontrolling element). Его аллели влияют на
вероятность того, инактивируется эта хромосома
или нет.
7.
Модель регуляции активности Xist/Tsix участка в раннем эмбриогенезе мыши(A) In the preimplantation embryo, the segregation
of PIC together with H3-K4 dimethylation over the
paternal and maternal Xist and Tsix promoters
ensures paternal Xist and maternalTsix expression,
respectively. Bold arrows represent high levels of
expression, dotted arrows represent low levels of
expression.
(B) At the implantation stage, an unknown ICMspecific repressive mechanism of PIC recruitment at
P1 Xist promoter avoids biallelic X-inactivation
(represented by a question mark and a transparent
PIC at the Xist promoter). In the meantime,
biallelic Tsix activation erases the histone
methylation pattern by inducing high levels of H3K4 dimethylation across the region (pink arrows),
rendering both Xist alleles epigenetically equivalent.
(C) At the onset of random X-inactivation,
monoallelic down-regulation of Tsix results in an
increase of H3-K4 dimethylation over the
corresponding Xist promoter region. The absence of
ICM-specific Xist repression allows stable binding
of the transcriptional apparatus, inducing high
levels of monoallelic Xist expression and Xinactivation.
(D) In the female epiblast, other epigenetic marks
lock in the expression profile of Xist and the
silencing of Tsix transcription.
8.
9.
10.
“Регуляторы громкости”для генов:
1) Информация о работе генов
заключена не т олько в
последовательности ДНК.
2) Роль регуляторов
громкости, усиливающих или
ослабляющих действие генов,
выполняют эпигенетические
факторы.
3)Носителями
эпигенетической информации
служат химические группы,
связанные с ДНК или
гистонами, регулирующими
упаковку ДНК в составе
хромосом
4)Модификация белков
обеспечивает более краткую
эпигенетическую регуляцию,
модификация ДНК – более
длительную
11.
Наследование уровня метилирования в ряду поколений клетокМетилирование ДНК осуществляется ДНК-метилтрансферазами
1. Это обычный фрагмент молекулы ДНК, за тем исключением,
что цитозин здесь прометилирован:
5'-ACGTAT5-MeCGT-3'
3'-TGCATAG5-MeCA-5'
2. Репликация ДНК: метилированность сама по себе не реплицируется,
временная пассивная деметилизация ДНК
5'-ACGTAT5-MeCGT-3'
3'-TGCATAGCA-5'
5'-ACGTATCGT-3'
3'-TGCATAG5-MeCA-5‘
3. Метилирование цитозина поддерживающей метилазой в паре 3'-GC-5'
(метилирование цитозина производится только в том случае, если напротив 3'GC-5' в комплементарной цепи ДНК есть 5'-CG-3' с прометилированным C).
5'-ACGTAT5-MeCGT-3'
3'-TGCATAG5-MeCA-5'
5'-ACGTAT5-MeCGT-3'
3'-TGCATAG5-MeCA-5'
Таким образом, модифицированный цитозин может наследоваться
подобно обычному, передавая свою метилированность в дочернюю
цепь ДНК.
12.
Во время оплодотворения:в отцовском геноме происходит деметилирование и замена протаминов на
гипометилированные гистоны;
материнский пронуклеус – сильнее метилирован и содержит ацетилированные
гистоны
13.
Эпигенетическое наследование – геномный импритингГеномный импринтинг - это
эпигенетический процесс,
дифференциально
маркирующий материнские и
отцовские гомологичные
хромосомы и приводящий к
разному фенотипическому
проявлению мутаций у
потомства, унаследованных от
матери или отца.
(от “imprint” — отпечаток)
Когда в соматических клетках
проявляется изменение
транскрипционной активности
импринтированного гена в
зависимости от его
происхождения (материнский
или отцовский), то говорят об
“эпиаллеле”
14.
Пример эпигенетического наследования доминантного признака:1)
2)
3)
4)
5)
20 лет назад родился баран с массивной задней частью, ему дали кличку “чистое золото”
50% его потомков в поколении F1 наследовало признак (т.е. это доминантная мутация)
При скрещивании F1, несущих мутацию, ценный признак передали потомкам только отцы
При скрещивании самки F1 признак проявляется только у ее внуков.
Животные, получившие мутантный ген от матери, имеют нормальный фенотип, вне
зависимости, какой ген они получили от отца
1
2
3
4
15.
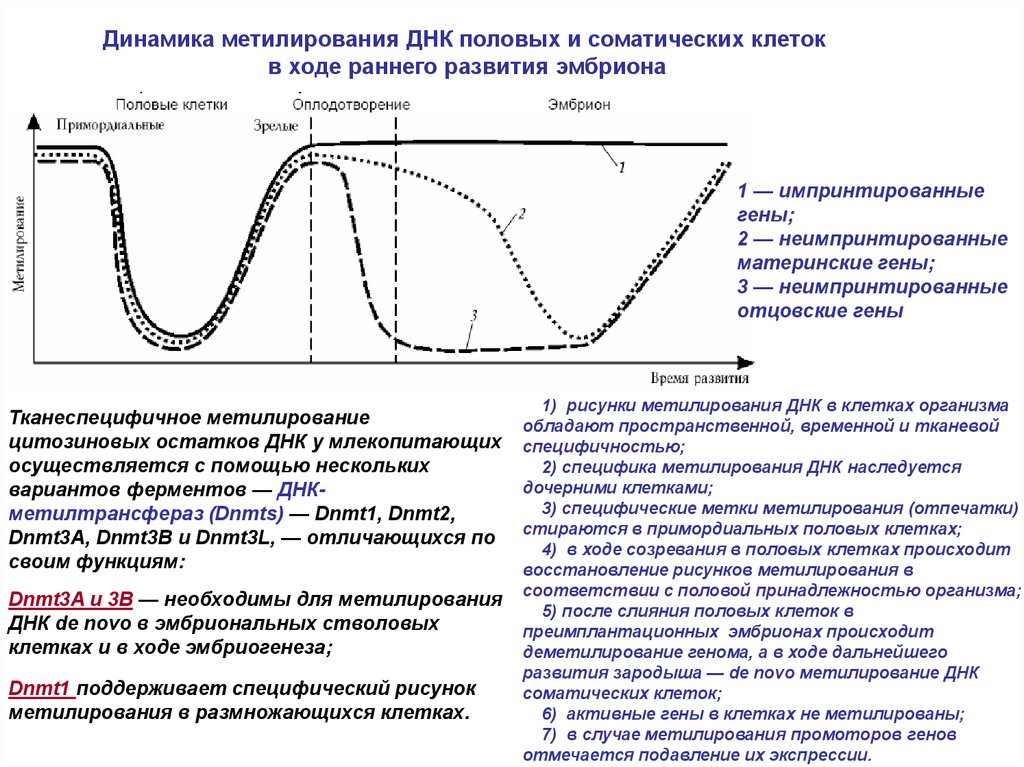
Динамика метилирования ДНК половых и соматических клетокв ходе раннего развития эмбриона
1 — импринтированные
гены;
2 — неимпринтированные
материнские гены;
3 — неимпринтированные
отцовские гены
Тканеспецифичное метилирование
цитозиновых остатков ДНК у млекопитающих
осуществляется с помощью нескольких
вариантов ферментов — ДНКметилтрансфераз (Dnmts) — Dnmt1, Dnmt2,
Dnmt3A, Dnmt3В и Dnmt3L, — отличающихся по
своим функциям:
Dnmt3A и 3B — необходимы для метилирования
ДНК de novo в эмбриональных стволовых
клетках и в ходе эмбриогенеза;
Dnmt1 поддерживает специфический рисунок
метилирования в размножающихся клетках.
1) рисунки метилирования ДНК в клетках организма
обладают пространственной, временной и тканевой
специфичностью;
2) специфика метилирования ДНК наследуется
дочерними клетками;
3) специфические метки метилирования (отпечатки)
стираются в примордиальных половых клетках;
4) в ходе созревания в половых клетках происходит
восстановление рисунков метилирования в
соответствии с половой принадлежностью организма;
5) после слияния половых клеток в
преимплантационных эмбрионах происходит
деметилирование генома, а в ходе дальнейшего
развития зародыша — de novo метилирование ДНК
соматических клеток;
6) активные гены в клетках не метилированы;
7) в случае метилирования промоторов генов
отмечается подавление их экспрессии.
16.
Механизмы развития синдромов Прадера - Вилли и Ангельмана.•склонность к
перееданию (ожирение);
•пониженный мышечный
тонус (гипотонус);
пониженная
координация движений;
•маленькие кисти и
стопы, низкий рост;
•повышенная
сонливость;
•косоглазие; сколиоз;
пониженная плотность
костей; гипогонадизм
(бесплодие);
•речевая задержка,
задержка психического
развития;
•более позднее половое
созревание.
•проблемы с питанием,
плохо набирают вес;
•задержка в развитии
навыков общей моторики
(умение сидеть, ходить);
•задержка речевого
развития, неразвитая речь
•гиперактивность;
•эпилепсия;
•ходьба на негнущихся
ногах — из-за этой
особенности детей с этим
синдромом иногда
сравнивали с
марионетками
•нарушения сна;
•косоглазие в 40 % случаев;
•сколиоз в 10 % случаев;
•повышенная
чувствительность к высокой
температуре;
17.
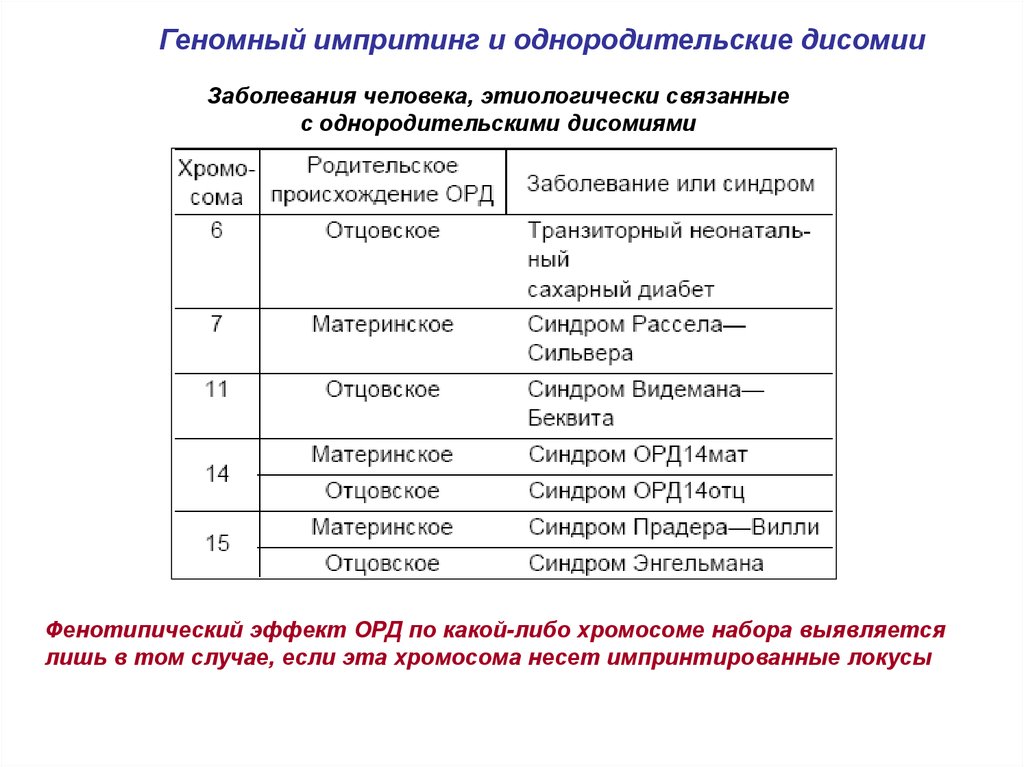
Геномный импритинг и однородительские дисомииЗаболевания человека, этиологически связанные
с однородительскими дисомиями
Фенотипический эффект ОРД по какой-либо хромосоме набора выявляется
лишь в том случае, если эта хромосома несет импринтированные локусы
18.
Ошибки расхождения хромосом в мейозе:численные хромосомные нарушения
http://atlasgeneticsoncology.org/Educ/PolyMecaEng.html
19.
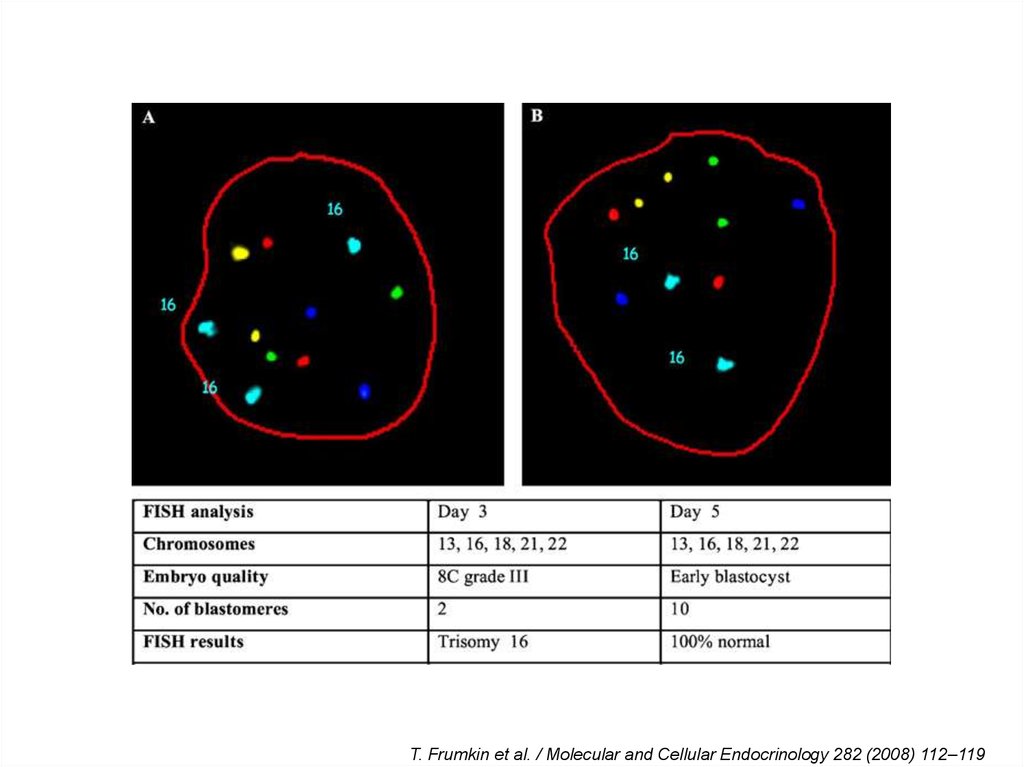
T. Frumkin et al. / Molecular and Cellular Endocrinology 282 (2008) 112–11920.
Противоположно импринтированные геныH19 и IGF2 регулируются координированно
благодаря конкуренции их промоторов за
доступ к общему энхансеру
Синдром Беквита-Видемана:
http://www.beckwith-wiedemann.info/protocol_russ.html
• ОРД по сегменту 11р15.5 отцовского
происхождения приводит к двойной дозе гена IGF2,
• мутация в материнском аллеле, при котором
активируется IGF2 - тот же эффект
материнский
аллель
не метилирован
На хромосоме матери энхансер активирует
транскрипцию гена H19, с которого
считывается нетранслируемая РНК, а ген IGF2
находится в неактивном состоянии.
На хромосоме отца в результате
метилирования локуса H19 ген IGF2
становится доступным для энхансера и
активируется.
21.
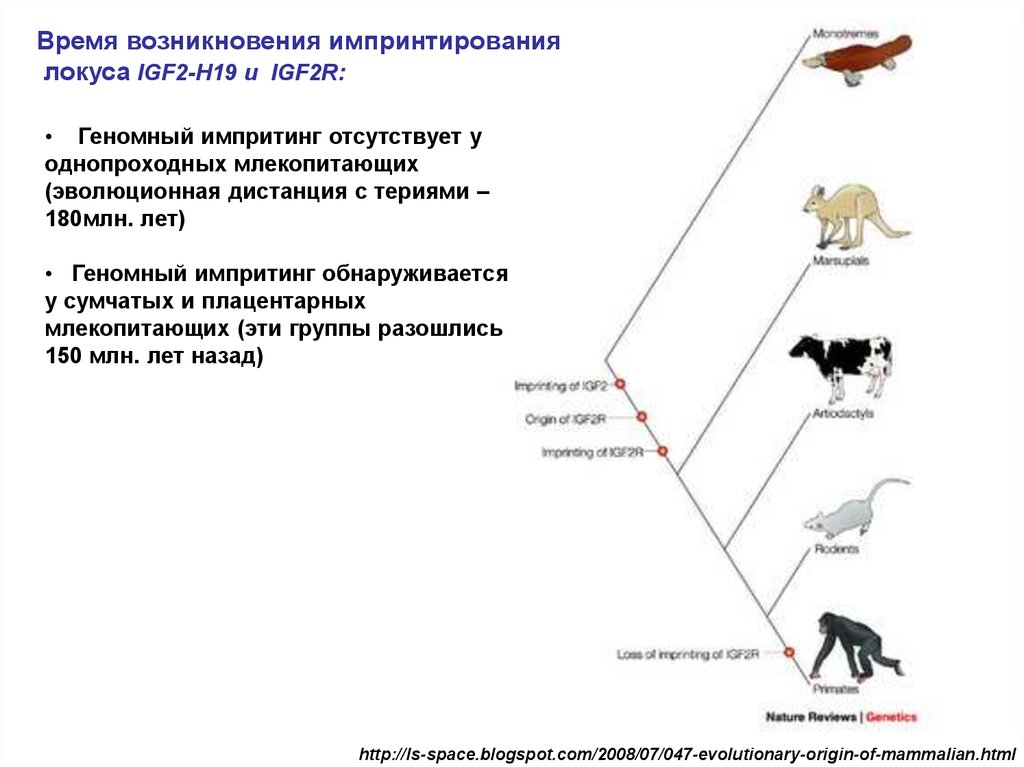
Время возникновения импринтированиялокуса IGF2-H19 и IGF2R:
• Геномный импритинг отсутствует у
однопроходных млекопитающих
(эволюционная дистанция с териями –
180млн. лет)
• Геномный импритинг обнаруживается
у сумчатых и плацентарных
млекопитающих (эти группы разошлись
150 млн. лет назад)
http://ls-space.blogspot.com/2008/07/047-evolutionary-origin-of-mammalian.html
22.
23.
Соотношение экспрессии разных аллелей генов H19, IGF2 and IGF2Rв плаценте человека (ворсинки хориона)
Для анализа экспрессии
Н19 и IGF2 использовали
ворсинки хориона плодов
гетерозиготных по SNP
(т.е. несущих разные
аллели)
Buckberry S, Bianco-Miotto T, Hiendleder S, Roberts CT (2012) Quantitative Allele-Specific Expression and DNA Methylation
Analysis of H19, IGF2 and IGF2R in the Human Placenta across Gestation Reveals H19 Imprinting Plasticity. PLoS ONE 7(12):
e51210. doi:10.1371/journal.pone.0051210
http://www.plosone.org/article/info:doi/10.1371/journal.pone.0051210
24.
Placental methylation levels in regions upstream and covering the H19 transcription start site (TSS).Buckberry S, Bianco-Miotto T, Hiendleder S, Roberts CT (2012) Quantitative Allele-Specific Expression and DNA Methylation
Analysis of H19, IGF2 and IGF2R in the Human Placenta across Gestation Reveals H19 Imprinting Plasticity. PLoS ONE 7(12):
e51210. doi:10.1371/journal.pone.0051210
http://www.plosone.org/article/info:doi/10.1371/journal.pone.0051210
25.
Upstream effectors of the H19 gene. H19 gene expression is modulated whentissues undergo repair and differentiation, and are subjected to carcinogens,
cytokines, growth factors and stress conditions. H19 gene expression is also
modulated by p53 transcription factor and HGF/SF stromal factor
26.
Modulation of gene expression linked to invasion and angiogenesis by H19 RNA.A reduced expression of adhesion molecules responsible for cell-cell and cell-matrix
interactions together with the up regulation of genes required for extracellular-matrix
metabolism, motility, and angiogenesis put H19 gene function in the core of at least the
initial steps of metastatic cascade.
27.
РНК-интерференция (RNAi)Фермент Dicer разрезает двуцепочечную РНК. При этом образуются siRNA (защита от РНКвирусов) или microRNA (получается из собственной РНК-предшественника). Эти
процессированные РНК попадают в RISC (RNA-induced silencing complex), который
разрушает мРНК и предотвращает трансляцию.
Собственные интерферирующие РНК:
1) миРНК (MicroRNA) - пост транскрипционный сайленсинг (глушение) гена
2) пиРНК (Piwi-interacting RNA) – управляют уровнем метилирования ДНК (у
млекопитающих)
28.
Манипуляции с гаметами и эмбрионамиСтресс
Апоптоз и
фрагментация
Модификация
экспрессии генов
Нарушение
компактизации
Изменение
кинетики
развития
Нарушение
соотношения
ВКМ и
трофэктодармы
Нарушение
соотношения
фетальных и
плацентарных
тканей
Изменение
метаболизма
Асинхрония
эмбриона и
материнских
тканей
Изменение
метаболизма
плода и/или
плаценты
Аборт
Нарушение
роста и
развития
эмбриона
29.
Овца Долли1996-07-05 - 2003-02-14
Долли с ягненком
http://en.wikipedia.org/wiki/Dolly_the_Sheep
30.
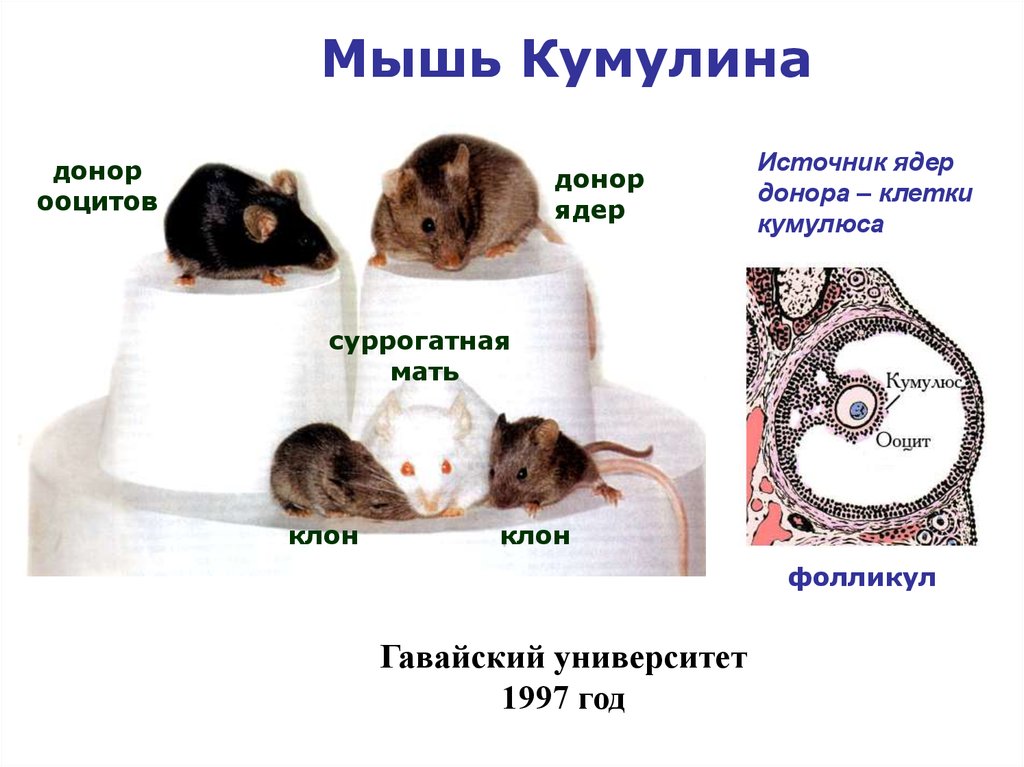
Мышь Кумулинадонор
ооцитов
донор
ядер
Источник ядер
донора – клетки
кумулюса
суррогатная
мать
клон
клон
фолликул
Гавайский университет
1997 год
31.
Цена клонированияБыло создано
1095
реконструированных эмбрионов
Они были пересажены
Щенок Снуппи – первый клон
собаки и Афган - афганская борзая,
из клеток которого он был
клонирован (Южная Корея, 2005 г.)
123
суррогатным матерям
Развились 3 эмбриона:
погиб во время
беременности
родился
мертвым
Снуппи
32.
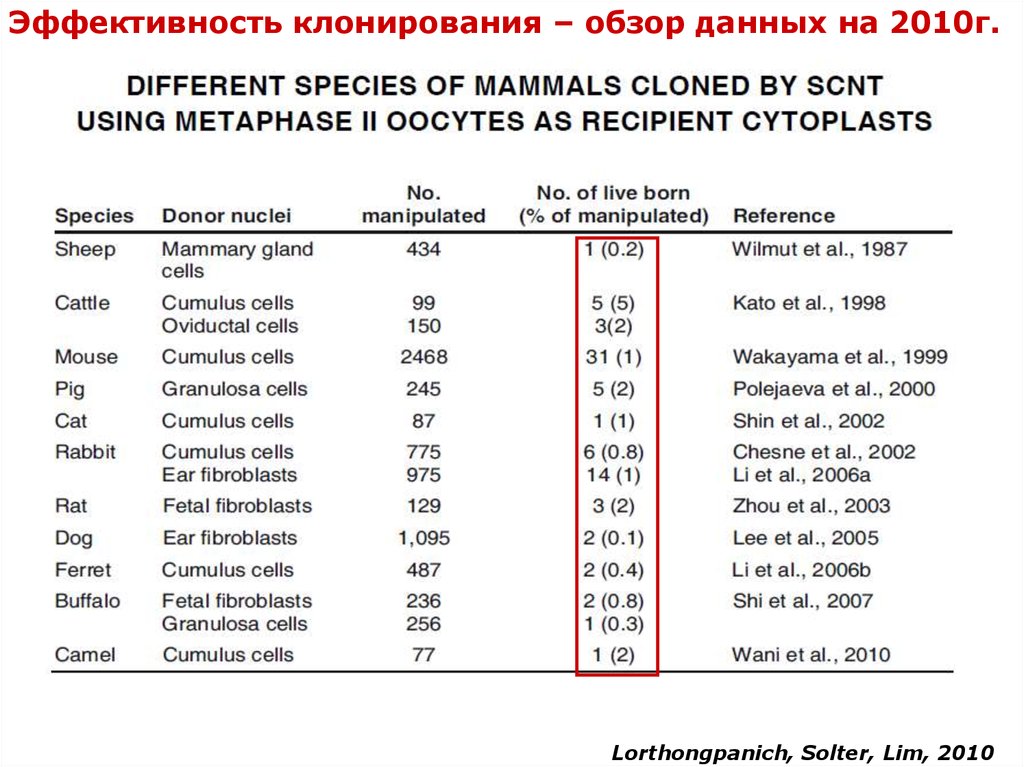
Эффективность клонирования – обзор данных на 2010г.Lorthongpanich, Solter, Lim, 2010
33.
Синдром генерализованного чрезмерного роста клонированных мышейDr. Ryuzo Yanagimachi, University of Hawaii
Genetically identical mice: the obese one on
the right is the clone.
Профиль экспрессии у новорожденных клонированных мышей: нарушения в 4-5% генома, но в 30-50%
импринтированных генов
Эпигенетические нарушения у клонированных эмбрионов:
• Аномальное метилирование ДНК: в норме во время дробления проходит
глобальное деметилирование и происходит активация “генов плюрипотентности”, в
том числе Осt-4
• Аномальный импритинг, дисрегуляция генов, нарушение структуры хроматина
• Синдром крупного потомства
• Преждевременная гибель
34.
Клонирование клонов• Клонированные животные живут меньше, чем обычные.
• По некоторым данным, в клетках клонов укороченные
теломерные участки.
Чтобы проверить, сократиться ли срок жизни клонов при
повторном клонировании в яйцеклетки пересадили ядра из
клеток клонов. При таком последовательном клонировании
происходила коррекция длины теломер
Телята полученные из клеток клонированных коров
в Японии (2000г.) и Бразилии (2004г.)
35.
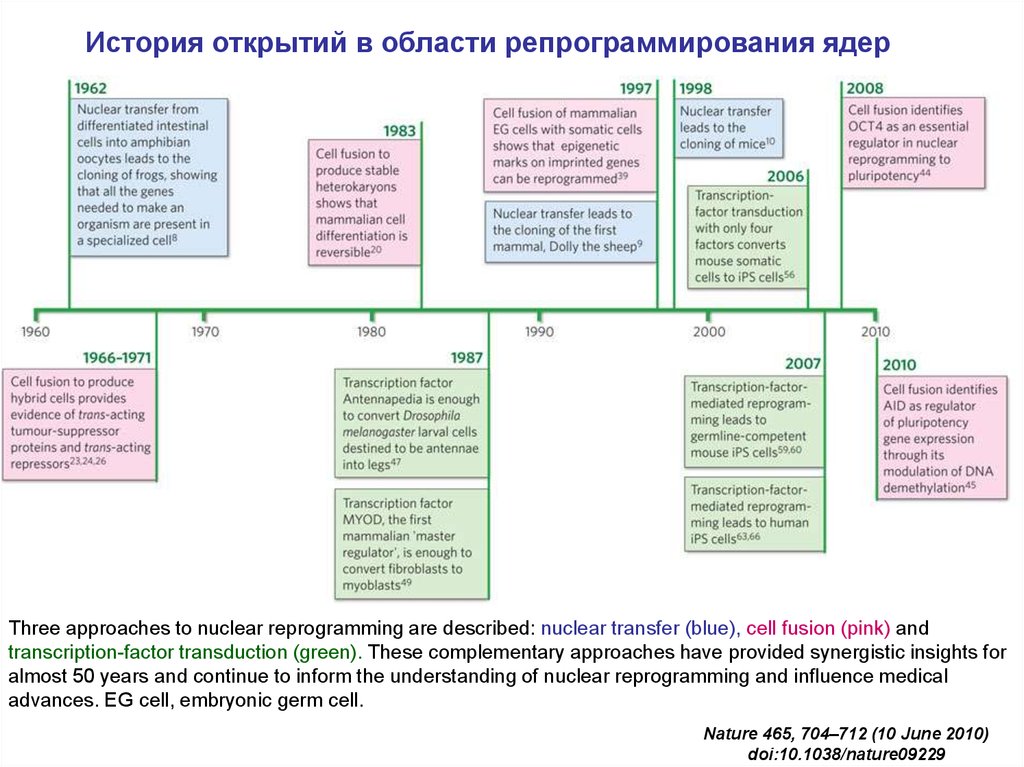
История открытий в области репрограммирования ядерThree approaches to nuclear reprogramming are described: nuclear transfer (blue), cell fusion (pink) and
transcription-factor transduction (green). These complementary approaches have provided synergistic insights for
almost 50 years and continue to inform the understanding of nuclear reprogramming and influence medical
advances. EG cell, embryonic germ cell.
Nature 465, 704–712 (10 June 2010)
doi:10.1038/nature09229
36.
Клонирование: репрограммирование ядер терминальнодифференцированных клеток путем создания линии ЭСК37.
Как повысить эффективность клонирования?Два разных подхода к получения клонированных эмбрионов:
Прямое клонирование
пересадка клонированной
бластоцисты
Успех 50%
Успех 50%
Успех 1-2%
Успех 1-2%
Непрямое клонирование:
из клонированной
бластоцисты
выращивают культуру
ЭСК и их ядра
используют для
клонирования новых
эмбрионов
Эффективность обеих методик низкая, но во втором случае
можно сделать сотни попыток….
38.
Как повысить эффективность клонирования?Наибольшая эффективность – при совмещении технологии
пересадки соматического ядра и технологии создания
аллофенных химер.
39.
Клонирование с использованием “неподходящих” источников ядер40.
Трансгенные клонированные свиньи, продуцирующиеинтегрины (белки клеточной адгезии) человека.
“Гуманизированные”
животные
Staunstrup NH et al., Development of transgenic cloned pig models of skin inflammation by DNA
transposon-directed ectopic expression of human β1 and α2 integrin. PLoS One. 2012;7(5).
41.
Три подхода к возвращению дифференцированным клеткам плюри/тотипотентностиNature 465, 704–712 (10 June 2010)
doi:10.1038/nature09229
42.
Молекулярные основы неудач при клонировании приматов:после переноса ядра соматической клетки в яйцеклетку приматов нарушения
в формировании веретена деления приводят к развитию анеуплоидных эмбрионов
Масштабный отрезок – 10 мкм
C. Simerly et al., Science 300, 297 (2003)
(A) Дефектное веретено деления с
неправильно расположенными
хромосомами после пересадки
соматического ядра.
Центросомальный белок
митотического аппарата NuMA в
норме в процессе мейоза (B) и
митоза (C), отсутствует в веретене
деления после переноса ядра (D).
После переноса ядра соматической
клетки отсутствует
центросомальный белок HSET (E),
но присутствует белок Eg5 в
центромерах. (F). Биполярные
веретена деления с правильно
расположенными хромосомами и
центросомальным белком NuMA
после переноса соматического
ядра в оплодотворенные
яйцеклетки (G).
Голубой - ДНК;
красный -тубулин;
зеленый - NuMA на рис. (B), (C),
(D) и (G), HSET – на рис. (E), и Eg5
– на рис. (F).
43.
Южнокорейский ученый Ву Сук Хванг в 2004 годусообщил о получении человеческих стволовых
клеток из клонированных эмбрионов человека,
но его работа оказалась подделкой.
Hwang WS, Ryu YJ, Park JH, Park
ES, Lee EG, Koo JM, Jeon HY, Lee
BC, Kang SK, Kim SJ, Ahn C, Hwang
JH, Park KY, Cibelli JB, Moon SY.
Evidence of a pluripotent human
embryonic stem cell line derived
from a cloned blastocyst.
Science. 2004 Mar;303:1669-74
Hwang WS, Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim
SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek
SH, Chang SS, Koo JJ, Yoon HS, Hwang JH, Hwang YY, Park
YS, Oh SK, Kim HS, Park JH, Moon SY, Schatten G. Patientspecific embryonic stem cells derived from human SCNT
blastocysts. Science. 2005 Jun 17;308:1777-83.
44.
Imprinted genes and their role in human fetal growthAbu-Amero S. · Monk D. · Apostolidou S. · Stanier P. · Moore G.
Cytogenet Genome Res 113:262–270 (2006) (DOI: 10.1159/000090841)
Abstract
Growth is defined as the progressive increase in size and is listed as one of the eight main
characteristics of life. In human gestation the most rapid growth phase is from 16 to 32
weeks when first there is both cell number and size increase and then from 32 weeks
onwards there is continued size increase (Pollack and Divon, 1992). The mechanism of
growth in utero is of fundamental interest to clinicians and scientists because of its
implications for neonatal health. Growth is multifactorial in origin with both genetics and
environment contributing equally large parts. Despite this complexity analysis of the
candidate genes involved is possible using simple tissue biopsies at the relevant stages of
development. Of particular interest in understanding fetal growth is the analysis of a group
of genes that show a parent-of-origin effect known as genomic imprinting. Imprinted genes
are not only found in eutherian (placental) and metatherian (marsupial) mammals but
surprisingly also in plants. Nevertheless, their evolution in mammals appears to be linked
primarily to placentation. It is thought to result from a potential conflict between the parents
in terms of the drive to successfully propagate their own separate genes and the mother’s
added drive for her survival through the pregnancy to reproduce again. This means that the
mother wants to restrict fetal growth and the father to enhance it.
45.
Установление различий в паттерне метилирования в мужских и женских половых клетках:Самцы
1)
2)
3)
Самки
1)
2)
3)
Roughly equal numbers of imprinted genes are subject to repression from alleles of maternal and of paternal origin. This masks
the strong sexual dimorphism that underlies major aspects of imprinted gene regulation. First, imprints are established very
early in the male germ line and persist for the reproductive life of the organism, while maternal genomic imprints are established
shortly prior to ovulation and are erased soon thereafter in the primordial germ cells of the next generation. Second, many CpG
island-associated promoters are subject to maternal methylation but no known promoters are subject to paternal-specific
germline methylation. The few known paternal methylation marks are kilobases distant from the affected genes and have a low
CpG density. Third, Dnmt3L is required for imprint establishment but not transposon methylation in female germ cells, while
Dnmt3L is required for transposon methylation and has only a minor role in de novo methylation at imprinted loci in male germ
cells. Fourth, maternally expressed genes are commonly repressed on the paternal allele by paternally expressed imprinted
genes produced in cis and encoding nontranslated RNAs. It is here suggested that rapid loss of highly mutable methylated CpG
sites has led to the depletion of methylation target sites in paternally repressed imprinted genes, and that an imprinting
mechanism based on RNAs or local inhibitory influences of ongoing transcription of regulatory loci has evolved to counter the
erosion of paternally methylated regulatory regions. This mutability model is based on the fact that paternally methylated
sequences are maintained in the methylated state for a much longer time than are maternally methylated sequences, and are
therefore lost at a correspondingly faster rate. The difference in timing of imprint establishment is likely to underlie the increasing
sexual dimorphism of other aspects of imprinted gene expression.
Cytogenet Genome Res. 2006;113(1-4):36-40.
Origins of extreme sexual dimorphism in genomic imprinting.
Bourc'his D, Bestor TH.





































 biology
biology