Similar presentations:
Типы химических реакций
1.
2.
Химические реакции – это явления, в результатекоторых из исходных веществ образуются новые
вещества (продукты реакции) с новыми свойствами.
3.
4.
5.
Если среда однородная (исходные вещества и продуктыреакции находятся в одном агрегатном состоянии), то
реакция гомогенная.
Н2(газ) + Br2(газ) → 2HBr(газ)
Если среда неоднородная (исходные вещества и
продукты реакции находятся в разных агрегатных
состояниях), то реакция гетерогенная.
Zn(тв.) + 2HCl(ж.) → ZnCl2(ж.) + H2(газ)
6.
С выделением теплоты – экзотермическая реакция(«экзо-» - наружу).
N2 + 3H2 → 2NH3 + Q
С поглощением теплоты – эндотермическая реакция
(«эндо-» - внутрь).
N2 + O2 → 2NO − Q
7.
Необратимая реакция – реакция, в которой исходныевещества полностью превращаются в конечные
продукты (реакции горения).
S + O2 → SO2↑ + Q
8.
Гетерогенные реакции, идущие с образованием газа,осадка или воды являются необратимыми.
Zn + 2HCl → ZnCl2 + H2↑ + Q
9.
Обратимые реакции – это реакции, которые протекаютодновременно в двух направлениях.
H2CO3 ↔ H2O + CO2↑
10.
Окислительно-восстановительная реакция (ОВР) –реакция с изменением степеней окисления двух и более
химических элементов.
11.
Не окислительно-восстановительнаяреакция
(не ОВР) – реакция, идущая без с изменением степеней
окисления химических элементов.
12.
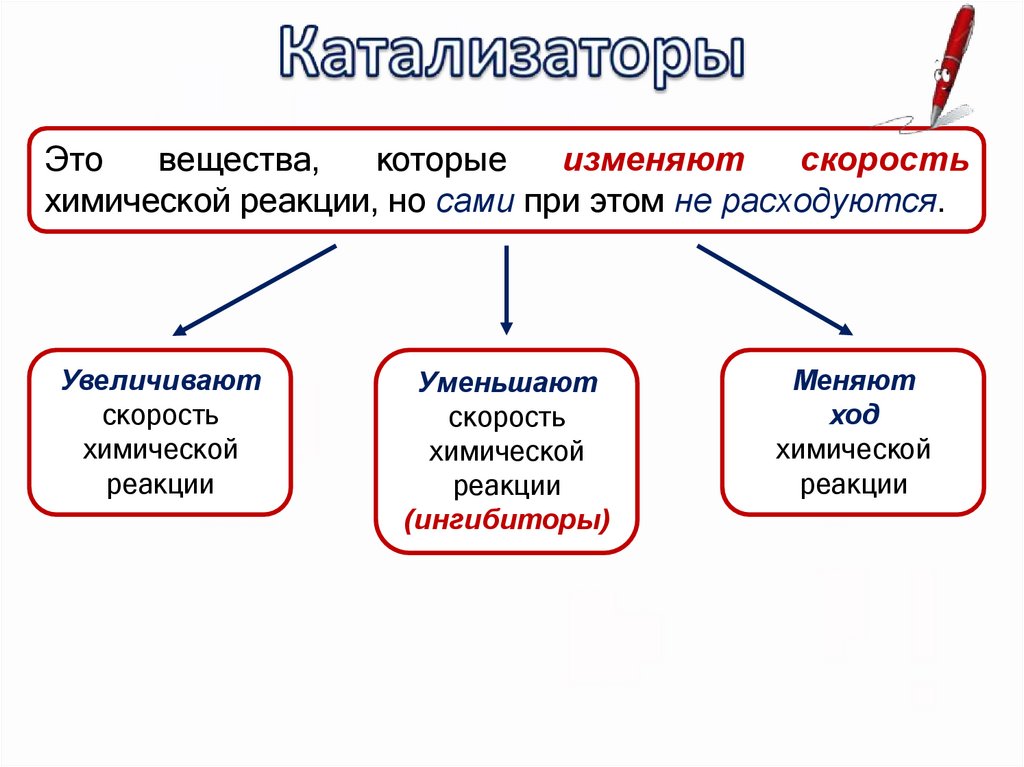
Этовещества,
которые
изменяют
скорость
химической реакции, но сами при этом не расходуются.
Увеличивают
скорость
химической
реакции
Уменьшают
скорость
химической
реакции
(ингибиторы)
Меняют
ход
химической
реакции
13.
Это органические катализаторы белковой природы,которые
ускоряют
реакции,
необходимые
для
функционирования живых организмов.
14.
Каталитическая (kt) реакция – реакция, идущая сучастием катализатора.
kt
2H2O2 → 2H2O + O2↑ ; MnO2 – kt
Некаталитическая реакция – реакция, идущая без
участия катализатора.
4NH3 + 3O2 → 2N2↑ + 6H2O
15.
Этофизическая
величина,
которая
показывает
изменение концентрации одного из реагирующих
веществ или одного из продуктов реакции в единицу
времени.
16.
17.
Zn + HCl → …Fe + HCl → …
18.
Чем выше концентрация реагирующих веществ, темвыше скорость протекания реакции между ними.
19.
Это физическая величина, которая показывает, сколькомолей вещества содержится в единице объема.






















 chemistry
chemistry








