Similar presentations:
Ионные равновесия в растворах электролитов
1. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
12.
В зависимости поведения веществ в растворе или в расплаверазличают: электролиты и неэлектролиты.
Электролиты – вещества, растворы и расплавы которых содержат
подвижные ионы и проводят электрический ток.
Наличие ионов в растворе объясняется процессом электролитической
диссоциации.
Электролитическая диссоциация – процесс распада вещества на
ионы под действием молекул растворителя.
Причинами электролитической диссоциации являются:
1. Процессы сольватации и молекул, и ионов, в результате чего
выделяется энергия, необходимая для разрыва связи между ионами;
2. Высокая диэлектрическая постоянная растворителя, ослабляющая
взаимодействие ионов (для воды – 78.5);
3. Повышение энтропии системы (∆S>0) за счет увеличения числа
частиц в процессе диссоциации соединения. Электролитическая
диссоциация в растворе протекает самопроизвольно (∆G<0).
2
3.
По величине степени диссоциации (α) электролиты делят на сильные (α ≥0.3) и слабые (α ≤0.03).
На степень
факторы:
электролитической
диссоциации
влияют
следующие
1. Природа химической связи: а)полярность; б) поляризу-емость
химической связи в соединении.
2. Свойства среды – диэлектрическая проницаемость. Чем выше
значение диэлектрической проницаемости (ε), тем больше степень
диссоциации .
3. Концентрация раствора.
С уменьшение концентрации
увеличивается.
раствора
степень
диссоциации
4. Температура. Процесс электролитической диссоциации обычно
эндотермический, поэтому с повышением температуры степень
диссоциации увеличивается.
3
4.
Электролитическая диссоциация слабых электролитов –процессобратимый. Следовательно, в растворах слабых электролитов всегда имеет
место химическое равновесие:
CH 3COOH CH 3 COO H
NH 4 OH NH 4 OH
Используя закон действующих масс, для процесса диссоциации слабого
электролита можно рассчитать константу равновесия (константу
диссоциации) – Ka или Kb
[CH 3COO ] [ H ]
Ka
[CH 3COOH ]
[ NH 4 ] [OH ]
Kb
[ NH 4 OH ]
4
5.
Значение константы ионизации как константы равновесияне зависит от концентрации слабого электролита в растворе,
но зависит от следующих факторов:
- природы вещества;
- природы растворителя (с увеличением ε константа
диссоциации увеличивается);
- температуры (при повышении температуры константа
диссоциации увеличивается).
Взаимосвязь константы диссоциации и степени диссоциации.
Ka
C
Закон разбавления Оствальда (1888).
5
6.
Особенности растворов сильных электролитовКонцепция межионного взаимодействия относится главным образом к
сильным электролитам. В количественном виде эту концепцию
представили П.Дебай и Э.Хюккель в 1923.
Определяемая по электрической проводимости растворов степень
диссоциации сильных электролитов не соответствует действительной
степени распада электролита на ионы и является кажущейся степенью
диссоциации.
Во всех процессах в растворах электролитов принимают участие
«активные ионы» - не принимающие участия в межионных
взаимодействиях.
Состояние ионов в растворе сильного электролита характеризуется их
активностью а(Хi) и коэффициентом активности f.
Активность иона – та эффективная, условная его концентрация,
соответственно которой он участвует во взаимодействиях, протекающих в
растворах сильных электролитов.
6
7.
Активность иона связана с его молярной концентрациейуравнением:
a(Хi) = f ∙C(Хi)
Коэффициент активности показывает, во сколько раз активность
иона отличается от его истинной концентрации в растворе электролита.
Значение коэффициента активности зависит от концентрации данного
иона
Для концентрированных растворов f<1 из-за межионного
взаимодействия.
Для очень разбавленных растворов f ≈ 1. Действие межионных сил
почти не проявляется.
На величину
коэффициента активности иона влияет общая
концентрация всех ионов в растворе. Поэтому Г. Льюис (1907) ввел
понятие ионной силы раствора электролита.
Ионная сила раствора (I) — мера интенсивности электрического поля,
создаваемого всеми ионами в растворе.
Ионная сила
равна полусумме произведений
молярной
концентрации (Ci) каждого иона в растворе на квадрат его заряда (Zi).
7
8.
I 1CZ
2
i
2
i
Ионная сила плазмы крови равна 0.15 М, поэтому физиологический
раствор должен иметь концентрацию 0.15 М или 0.9%.
8
9.
ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ.ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ.
1. Теория Аррениуса.
Кислоты – электролиты, которые в расплаве или водном растворе
диссоциируют с образованием в качестве катионов только катионов
водорода.
HCl H Cl
H 2 SO4 2 H SO4
2
Основания – электролиты, которые в расплаве или водном растворе
диссоциируют с образованием в качестве анионов только
гидроксид-анионов.
NaOH Na HO
Ca(OH ) 2 Ca 2 2 HO
9
10.
2. Протолитическая теория кислот и оснований(Бренстед и Лоури, 1923)
Кислоты – молекулы или ионы, способные в данной реакции
отдавать катион водорода (протон).
Кислота – донор протонов.
Основания – молекулы или ионы, способные в данной реакции
присоединять протоны .
Основания – акцепторы протонов.
HCl ( ГАЗ ) H 2O( Ж ) H 3O ( Р) Cl ( Р)
нейтр.
кислота
основание
сопряженная
кислота
сопряженное
основание
H 2 SO4 ( б|в ) H 2 O( Ж ) H 3 O( в ) HSO 4 ( в )
нейтр.
кислота
основание
сопряженная
кислота
сопряженное
основание
10
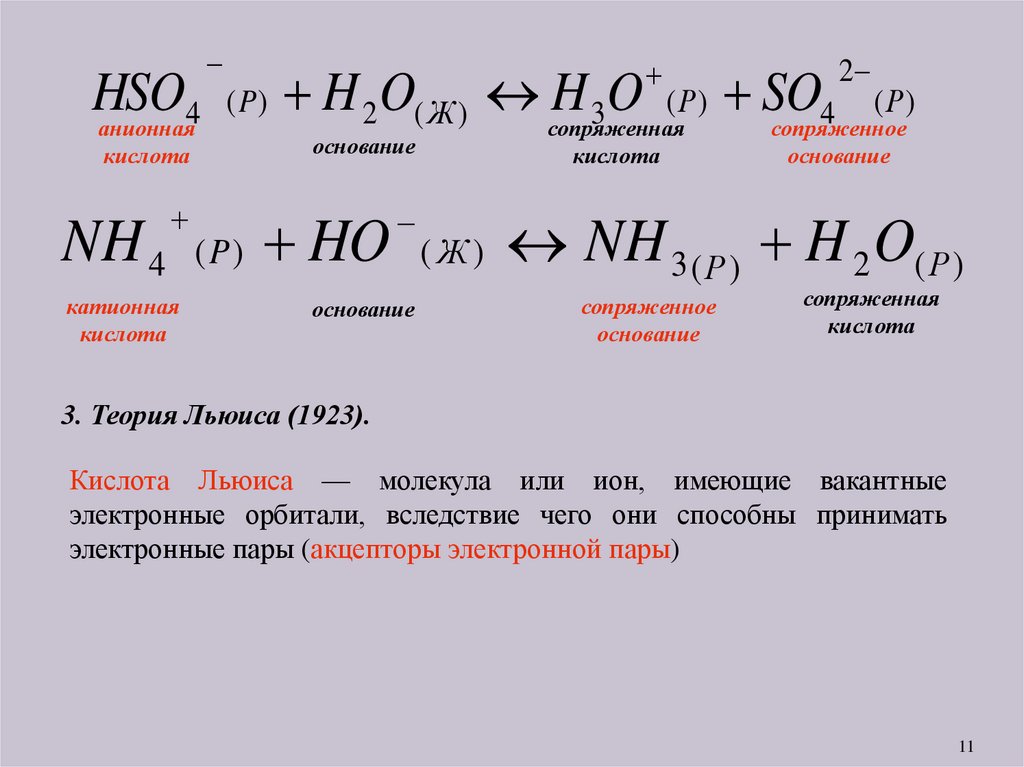
11.
2HSO
( P ) H 2 O( Ж ) H 3O ( Р ) SO4 ( Р )
4
анионная
сопряженная
сопряженное
кислота
основание
катионная
кислота
основание
кислота
основание
NH 4 ( P ) HO ( Ж ) NH 3 ( Р ) H 2 O( Р )
сопряженное
основание
сопряженная
кислота
3. Теория Льюиса (1923).
Кислота Льюиса — молекула или ион, имеющие вакантные
электронные орбитали, вследствие чего они способны принимать
электронные пары (акцепторы электронной пары)
11
12.
Основания Льюиса — молекула или ион, имеющие свободныеэлектронные пары, вследствие чего они способны отдавать электронные
пары (доноры электронной пары)
основание
Льюиса
кислота
Льюиса
AlCl3 Cl Cl [ AlCl4 ] Cl
Принцип жёстких и мягких кислот и оснований Пирсона (принцип
ЖМКО).
Принцип ЖМКО касается взаимодействий, рассматриваемых в теории
кислот и оснований Льюиса.
12
13.
Мягкие кислоты — это кислоты Льюиса,содержащие акцепторныеатомы с малым положительным зарядом, большим размером, низкой
электроотрицательностью и высокой поляризуемостью.
Мягкие основания — это основания Льюиса, содержащие донорные
частицы с низкой электроотрицательностью и высокой поляризуемостью.
Они слабо удерживают свои валентные электроны.
Суть принципа ЖМКО состоит в том, что жесткие кислоты
преимущественно реагируют с жесткими основаниями, а мягкие
кислоты – с мягкими основаниями.
13












 chemistry
chemistry








