Similar presentations:
Химическое равновесие. Принцип Ле Шателье. Необратимые реакции
1. Тема урока: «Химическое равновесие. Принцип Ле Шателье»
2. Необратимые реакции
BaCl2 + H2SO4 → BaSO4 + 2HClисходные вещества
продукты реакции
Необратимые реакции
- это химические реакции, протекающие
до конца в одном направлении
3. Обратимые реакции
N2 + 3H2исходные вещества
2NH3
продукты реакции
Обратимые реакции
- это химические реакции, протекающие
при данных условиях во
взаимнопротивоположных направлениях
4. Обратимые реакции
ν1SO2 + H2O
H2SO3
ν2
где: ν1 – прямая реакция (идет в сторону
образования продуктов реакции);
ν2 – обратная реакция (идет в
сторону образования исходных
веществ)
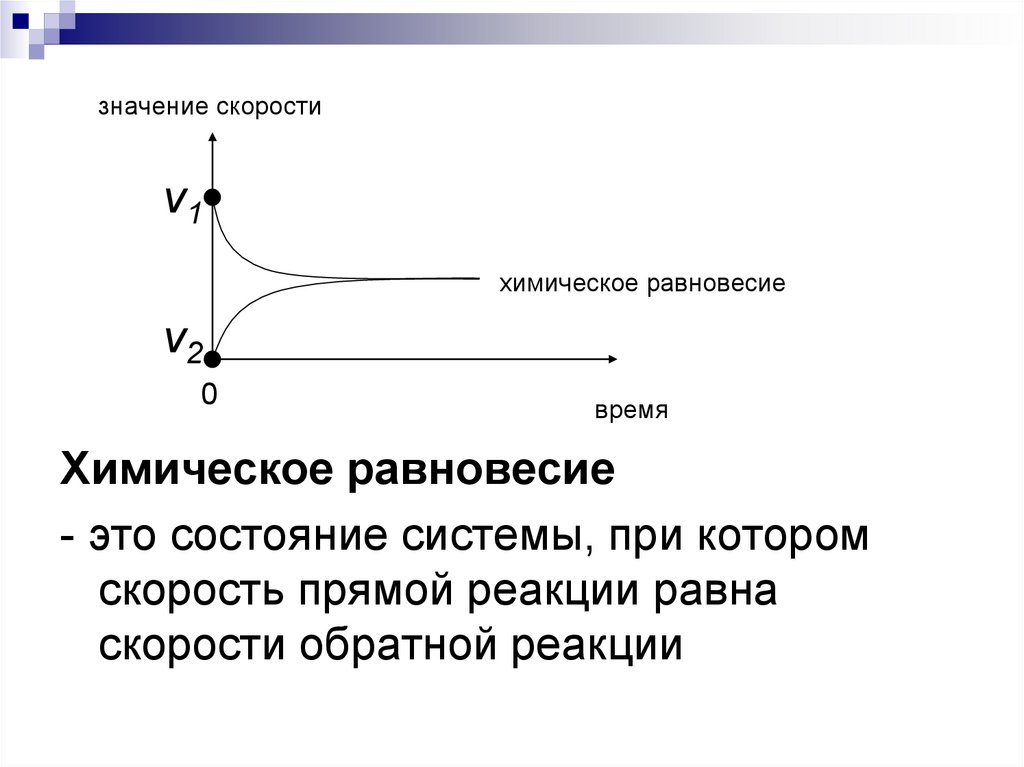
5.
значение скоростиν1
химическое равновесие
ν2
0
время
Химическое равновесие
- это состояние системы, при котором
скорость прямой реакции равна
скорости обратной реакции
6. Какие проблемы возникают при использовании обратимых реакций в промышленности?
Снижение выхода продукта посравнению с ожидаемым.
Продукт реакции содержит примеси
исходных веществ.
Как можно решить эту проблему?
Равновесие можно смещать, меняя
давление, температуру и концентрацию
веществ.
7. Принцип Ле Шателье
при изменениивнешних условий
химическое равновесие
смещается в строну
той реакции,
которая ослабляет
это внешнее воздействие
Анри Луи Ле Шателье
(8.10.1850 – 17.09.1936)
8. Принцип Ле Шателье:
Еслина систему, находящуюся в
состоянии химического равновесия,
оказать
какое-либо
воздействие
(изменить
температуру,
давление,
концентрацию веществ), то в системе
возникнут процессы, направленные на
ослабление данного воздействия.
9. Влияние температуры
ИзменениеСмещение химического
параметра
равновесия
Нагревание В сторону эндотермической
реакции
Охлаждение В сторону экзотермической
реакции
2SO2 + O2
2SO3 + Q
(2SO3
2SO2 + O2 – Q)
10. Влияние давления
Изменениепараметра
Смещение химического
равновесия
Увеличение В сторону реакции, ведущей
давления
к уменьшению объема
Уменьшение В сторону реакции, ведущей
давления
к увеличению объема
2SO2 + O2
2SO3 + Q
2V + 1V
2V
11. Влияние концентрации
ИзменениеСмещение химического
параметра
равновесия
Концентрация исходных веществ
Увеличение В сторону продуктов реакции
Уменьшение В сторону исходных веществ
Концентрация продуктов реакции
Увеличение В сторону исходных веществ
Уменьшение В сторону продуктов реакции
12. Выводы:
Обратимыереакции протекают в двух
взаимно
противоположных
направлениях, что создаёт проблемы
на производстве;
В
соответствии с принципом Ле
Шателье равновесие можно смещать,
изменяя температуру, давление и
концентрацию веществ.











 chemistry
chemistry








