Similar presentations:
Електроліти в сучасних акумуляторах
1.
«Електроліти всучасних
акумуляторах»
2.
Мета:- поглибити знання про сучасні акумулятори,
їх використання в побуті, науці та техніці, а
також утилізацію використаних
акумуляторів;
- ознайомитися з науковими джерелами з
даної теми, дати визначення основним
поняттям: "електроліти", "сучасні
акумулятори".
3.
Завдання:ознайомитись з різними видами
акумуляторів;
розкрити суть поняття "акумулятори";
дослідити будову та принцип роботи
акумуляторів (на прикладі пальчикової
батарейки);
розглянути проблему утилізації
акумуляторів.
4.
План•Історія відкриття.
•Поняття «акумулятор» та «електроліт».
•Види акумуляторів.
•Будова та принцип роботи акумуляторів.
•Заходи безпеки при поводженні з
акумулятором.
•Проблема утилізації акумуляторів.
5.
Історія відкриття• В кінці 18 століття були винайдені гальванічні
елементи — перші хімічні джерела струму.
Невдовзі
після
цього
було
відкрите
явище електролізу— розкладання складних
речовин на прості за допомогою електричного
струму. Одним з перших зацікавився цим
Єнс Якоб Берцеліус
явищем Гамфрі Деві. В результаті своїх досліджень
у 1807 році Деві створив електрохімічну теорію
будови речовини. У 1811 році ця теорія була
розвинута Берцеліусом. Згідно його гіпотезі, в
атомах електричні заряди одного типу домінують
над зарядами іншого, тому атоми взаємодіють так,
ніби мають ненульовий заряд, при чому атоми
різних елементів заряджені по різному.
Гамфрі Деві
6.
Берцеліус вважав, що в електролітах молекули повністюзберігають свою будову, аж допоки до розчину не буде
прикладений струм, який збалансує заряди молекулярних
компонентів і дозволить їм роз'єднатись.
У 1818 році Теодор фон Гроттгусс висловив
альтернативне і правильне припущення, що
Єнс Якоб Берцеліус молекули розпадаються на іони при розчиненні,
а не через дію струму, проте авторитет
Берцеліуса підтримував його теорію впродовж
десятиліть.
Теодор фон Гроттгусс
У
1834
році
учень
Деві,
Майкл
Фарадей визначив кількісні закони електролізу.
Він же ввів термін «електроліт», для речовин,
розчини яких мають провідні властивості, від
приставки електро- і грецького λυτός, розчинний
Майкл Фарадей
7.
• Акумулятор ( з латинського acculturation збирач), пристрій длянакопичення енергії з метою її подальшого використання.
Електричний акумулятор перетворює електричну енергію в
хімічну і при необхідності забезпечує зворотне перетворення.
Використовується як джерело електричної енергії.
Акумулятори — це хімічні джерела струму
з оборотним процесом: вони можуть
віддавати енергію, перетворювати хімічну
енергію в електричну або накопичувати
енергію, перетворюючи електричну енергію
в хімічну.
8.
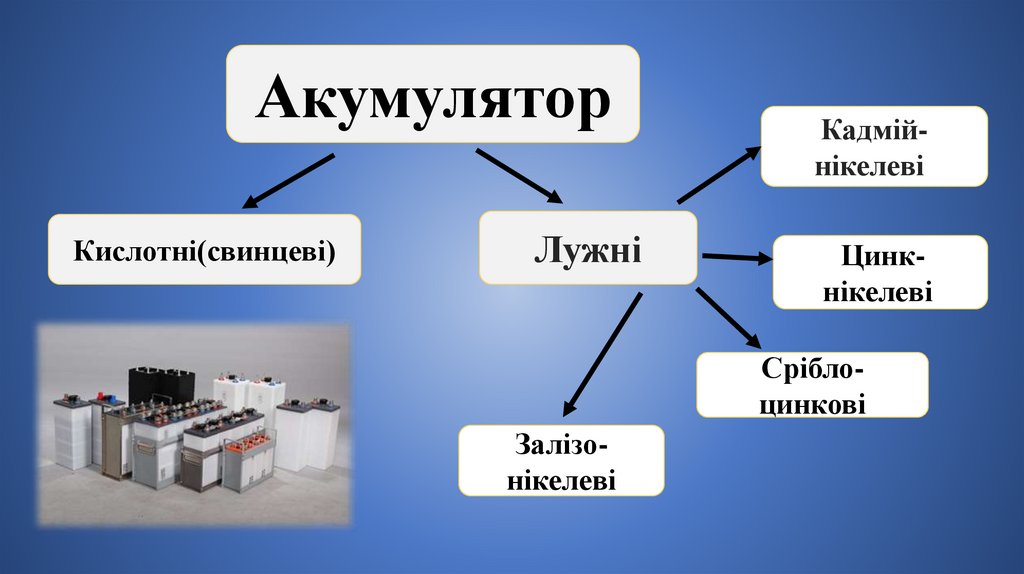
АкумуляторКислотні(свинцеві)
Лужні
Кадмійнікелеві;
Цинкнікелеві;
Сріблоцинкові
Залізонікелеві
9.
Для сучасних кислотних акумуляторів основним середовищем, в якійвідбуваються реакції, є електроліт. Від його кількості, температури,
електрохімічних характеристик в повній мірі залежить робота всієї батареї.
Для кожного сезону склад електроліту для акумуляторів повинен мати
певну щільність. Це забезпечить тривалість і правильність його
Електороліт - речовина, яка проводить
експлуатації.
електричний струм внаслідок дисоціації на
йони, що відбувається в розчинах і розплавах,
або руху йонів кристалічних решітках твердих
електролітів
Електроліт має широке розповсюдження.
Найбільш часто він використовується для
отримання струму, згодом використовуваного
як джерело енергії. В сучасних акумуляторах
кислотний електроліт, в який вміщуються
свинцові батареї - один з найважливіших
елементів.
10.
Кислотні акумулятори мають високу номінальну напругу, малийвнутрішній електричний опір та відносно високий коефіцієнт
корисної дії. Проте невеликий термін служби, недостатня міцність та
незадовільна робота при низьких і високих температурах обмежують
їх застосування.
Найпоширеніші
акумулятори
на
сьогоднішній
день
це
свинцевокислотні (СК). Вони характеризуються
відносною простотою і доступністю. При
виготовленні
СК
використовуються
відносно недорогі матеріали: свинець в
якості електродів і розчин сірчаної
кислоти. Стандартний елемент має напругу
2 В.
11.
Лужні акумулятори мають ряд переваг передкислотними: вони міцніші, не бояться перевантажень, добре
працюють в широкому інтервалі температур, невимогливі
до виробничих умов. Основні їх недоліки: низький ККД (до
60 %) і напруга (1,2; 1,25; 1,33 В).
Нікель-кадмієві(НК)
акумулятори відносяться до групи
лужних. Тут одна пластина містить
гідроокис кадмію, інша - гідроокис
нікелю. Активний матеріал у
вигляді порошку запресований в
пластини, що представляють собою
решітчату
або
перфоровану
структуру Перфорація забезпечує
обмін зарядами через електроліт.
12.
Ще один різновид акумуляторних батарей - це літієві батареї, відомі своїмзастосуванням в мобільних телефонах або в ноутбуках.
Перший літій-іонний акумулятор вивела на ринок корпорація Sony в 1991
році. Сучасні літій-іонні акумулятори мають високі показники: 100–180 Вт*год/кг
і 250–400 Вт*год/дм3, робоча напруга — 3,5-3,7 В.
Як з'ясувалося, літій-іонні (точніше, літійзалізо-фосфатні) акумулятори перевершують
всі інші за всіма статтями. Який параметр не
візьми, будь-то температурний діапазон,
ресурс служби, стійкість до глибоких розрядів
- всюди вони кращі. Додамо сюди ще кращий
показник питомої енергії, що запасається,
тобто
максимальний
запас
енергії
в
мінімальному обсязі - і стане зрозуміло, що за
цими АКБ майбутнє. Сьогодні вони в
основному
використовуються
в
електромобілях,
але
вже
поступово
завойовують місце і в інших сферах.
13.
Електроліт кислотний застосовується для заливання в свинцевіакумулятори легкового та вантажного автотранспорту. Для приготування
електроліту у ванну, футерованну свинцем, наливають плавикову
кислоту HF і в неї додають борну кислоту Н3ВО3 Отриману
борфтористоводневу кислоту HBF 4 фільтрують і, розчиняють у ній
вуглекислий кадмій.
Електроліт лужний (натрієво-літієвий) широко застосовується в
автомобільній і гірничо-видобувній промисловості. Головне призначення
цього електроліту - заповнення різних лужних акумуляторів. Його
використовують
для
наповнення
акумуляторів
електричних
навантажувачів та спеціальних шахтних електровозів.
14.
Принцип роботи акумуляторівТаким чином, аккумуляторпоперемінно то розряджається, віддаючи
електричну енергію, то заряджається від будь-якого джерела постійного
струму.
Для нормальної роботи будь-якої електрохімічної
батареї необхідно як мінімум три компоненти: два
електроди й електроліт, що забезпечує перенос іонів. У
малогабаритних батареях електроліт може бути
твердим, рідким і желеподібним. Рідкі електроліти
застосовуються, як правило, у клеєних циліндричних
батареях, але через високу небезпеку займання вони не
знайшли застосування в інших системах.
Для розробки твердих електролітів для літієвих
акумуляторів, що мають можливість перезаряджання,
пішло два десятиліття напружених досліджень. На їх
основі стало можливим створення тонких і пласких
батарей, але з невеликим діапазоном робочих
температур та малою потужністю.
15.
Заходи безпеки при поводженні з акумуляторомДля запобігання витоку електроліту, нагрівання й вибуху потрібно
дотримуватись таких правил безпеки:
• не занурювати акумулятор у воду, зберігати його в сухому прохолодному місці,
якщо він не використовуться;
• не використовувати і не залишати акумулятор поблизу джерел
відкритого вогню або тепла;
• для зарядження використовувати тільки призначені для цього акумулятора зарядні
пристрої;
• не підключати акумулятор до пристроїв, не призначених для живлення від нього;
• не кидати акумулятор у вогонь і не нагрівати його;
• не замикати між собою позитивний і негативний виводи акумулятора металевими
предметами
або дротами;
• не зберігати акумулятор разом з металевими предметами, такими як скріпки
або шпильки;
• не зчавлювати, не кидати й не піддавати акумулятор механічним впливам;
• не паяти акумулятор та не проколювати його гострими предметами.
16.
Частка ХДС у побутовому смітті – 0,25 % масиЧастка токсичних речовин від ХДС у побутовому смітті - > 50 %
За рік:
40 кілограмів ртуті,
160 кілограмів кадмію,
260 тонн марганцевих
сполук,
250 тонн хлоридів…
17.
Після того, як акумулятор відпрацює свій ресурс – вінперетворюється в екологічно небезпечний предмет. Відпрацьований
електроліт на переробку не приймають і він потрапляє в категорію
«проблемних» хімічних речовин.
Категорично забороняється виливати відпрацьований електроліт у
водойми, адже це призведе до підвищення кислотності води з усіма
негативними, інколи трагічними, наслідками для організмів.
Категорично заборонено висипати на поверхню
ґрунту порошок із ґраток електродів. Порошок
активних мас електродів високодисперсний і буде
переноситися вітром, водою, взуттям людей та
ногами тварин.
Отруєння свинцем та його сполуками призводить до
ураження центральної та периферійної нервових
систем, кісткового мозку і крові, судин, порушення
синтезу білків і генетичного апарату клітин,
супроводжується ембріотоксичною дією.
18.
ВисновокОзнайомився з основними електролітами, які використовуються у
науці, техніці та побуті, дізнався про їх позитивні та негативні сторони, а
також розглянув проблеми утилізації акумуляторів та їх вплив на
довкілля.
Широке застосування електроліт має і в побуті, наприклад для
ремонту готуючи до фарбування поверхню її обробляють електролітом,
внаслідок чого вона повністю знежирюється.
Кількість і якість електроліту впливає на роботу акумулятора.
Показання щільності в обслуговуваних батареях контролюються мінімум
двічі на рік. Якщо рівень рідини в банках падає, то необхідно доливати
дистильовану воду.
При покупці АКБ із сухою зарядкою бажано також купувати
підготовлений розчин від відомих виробників, що використовують
кислоту високої якості. Під час самостійного приготування розчину
потрібно дотримуватися всіх заходів індивідуальної безпеки.
19.
Джерела інформаціїhttp://nizagurskachemistry.blogspot.com/2019/11/blog-post_50.html
https://uk.med-auto.com/remont-avto/sklad-elektrolitu-dlia-akumuliatoriv.html
https://ru.essays.club/Точные-науки/Химия/Електроліти-в-сучаснихакумуляторах-148679.html
https://uk.wikipedia.org/wiki/Літій-іонний_акумулятор
Бродский А.И. Современная теория электролитов. — Ленинград :
«ОНТИ—Госхимтехиздат», 1934. — 256 с.


















 chemistry
chemistry








