Similar presentations:
Общая биохимия (лекция 1)
1.
Общая биохимияК.б.н., доцент, заведующий кафедры
биохимии и биотехнологии
Брилкина Анна Александровна
2 семестра
15+15 лекций
8+8 лабораторных занятий (по две пары через неделю)
14 + 14 семинаров (по 1 паре каждую неделю)
1 семестр - зачет
2 семестр - экзамен
2.
Балльно-рейтинговая система1. Пропущенные и неотработанные занятия, а также несданные отчеты за лабораторные работы (их
полный набор) - основание для выставления неудовлетворительной итоговой оценки за предмет
независимо от текущего и экзаменационного рейтинга студента. Отрабатывать занятия
разрешается студентам, допустившим пропуск по уважительной причине и представившим
соответствующий документ преподавателю и в ОУВР.
2. Отчеты за пропущенные работы к проверке не принимаются.
3. Баллы за сданные отчеты начисляются по факту сдачи ВСЕХ отчетов (по принципу «все или
ничего»).
4. Баллы за семестр фиксируются на момент последнего практического занятия по данной
дисциплине.
3.
Балльно-рейтинговая системаСеместр I
№ п/п
Оцениваемая позиция
Возможное количество баллов
1
Контр. раб. «Аминокислоты 1»
3-5
2
Контр. раб. «Аминокислоты 2»
3-5
3
Контр. раб. «Витамины»
3-5
4
Контр/раб. «Нуклеотиды»
3-5
5
Коллоквиум «Строение и классификация белков. Ферменты»
6 - 10
6
Коллоквиум «Нуклеиновые кислоты и синтез белка»
6 - 10
Баллы за текущие опросы на лабораторных занятиях и семинарах
+ 2 балл за отличный,
+ 1 балл за хороший,
+ 0,5 балла за удовлетворительный ответ
Сдача отчетов по практическим работам
+ 3 (за семестр) - сдача отчетов в срок
(на следующем занятии)
7
8
9
Поощрительные баллы
за успешно построенный калибровочный график
ИТОГО за семестр
+ 1 балл за каждую
минимум 27 баллов для получения зачета
(при условии всех отработанных занятий и написанных
отчетов)
4.
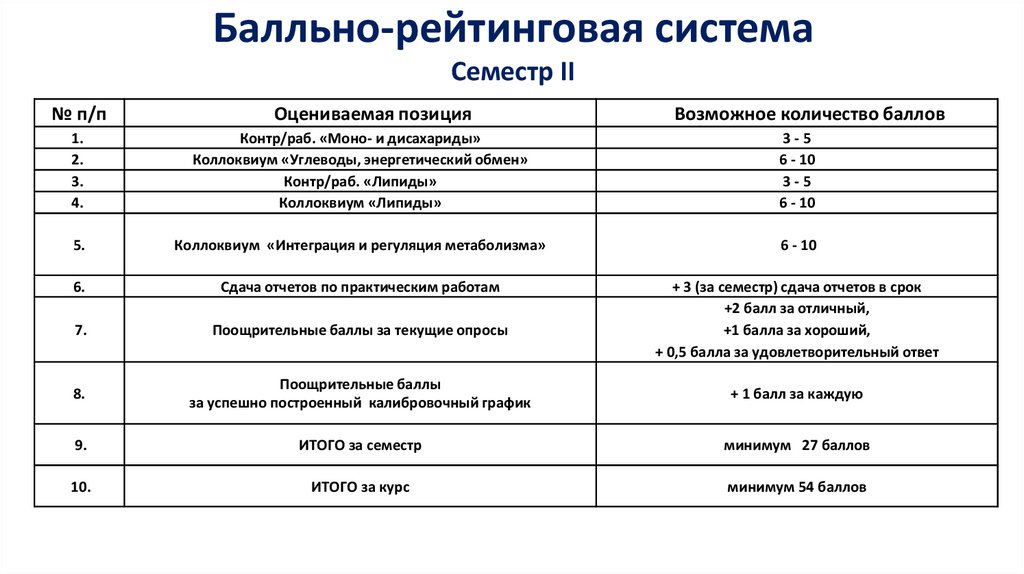
Балльно-рейтинговая системаСеместр II
№ п/п
Оцениваемая позиция
Возможное количество баллов
1.
2.
3.
4.
Контр/раб. «Моно- и дисахариды»
Коллоквиум «Углеводы, энергетический обмен»
Контр/раб. «Липиды»
Коллоквиум «Липиды»
3-5
6 - 10
3-5
6 - 10
5.
Коллоквиум «Интеграция и регуляция метаболизма»
6 - 10
6.
Сдача отчетов по практическим работам
7.
Поощрительные баллы за текущие опросы
+ 3 (за семестр) сдача отчетов в срок
+2 балл за отличный,
+1 балла за хороший,
+ 0,5 балла за удовлетворительный ответ
8.
Поощрительные баллы
за успешно построенный калибровочный график
+ 1 балл за каждую
9.
ИТОГО за семестр
минимум 27 баллов
10.
ИТОГО за курс
минимум 54 баллов
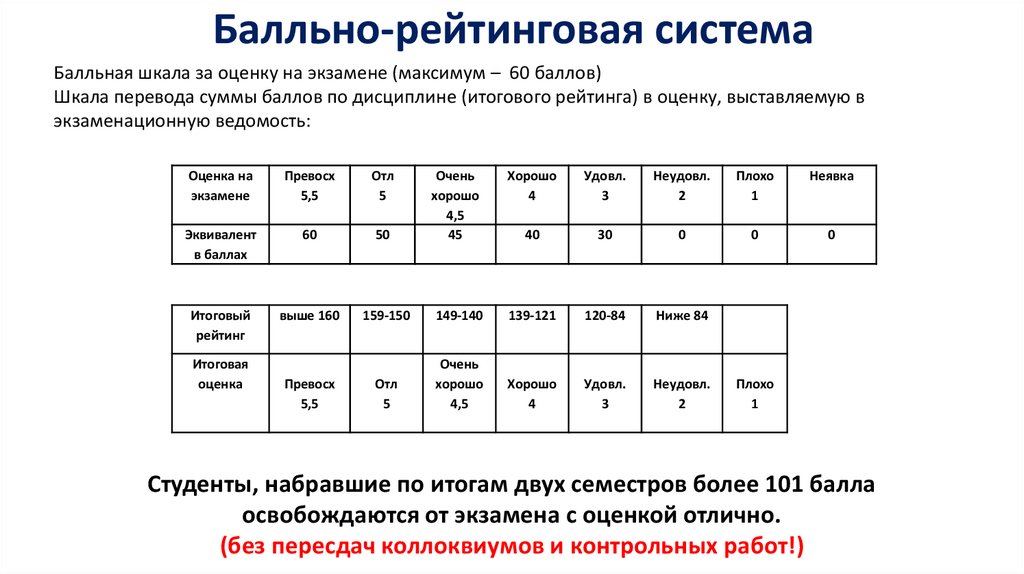
5.
Балльно-рейтинговая системаБалльная шкала за оценку на экзамене (максимум – 60 баллов)
Шкала перевода суммы баллов по дисциплине (итогового рейтинга) в оценку, выставляемую в
экзаменационную ведомость:
Оценка на
экзамене
Превосх
5,5
Отл
5
Эквивалент
в баллах
60
Итоговый
рейтинг
выше 160
Итоговая
оценка
Превосх
5,5
Хорошо
4
Удовл.
3
Неудовл.
2
Плохо
1
Неявка
50
Очень
хорошо
4,5
45
40
30
0
0
0
159-150
149-140
139-121
120-84
Ниже 84
Отл
5
Очень
хорошо
4,5
Хорошо
4
Удовл.
3
Неудовл.
2
Плохо
1
Студенты, набравшие по итогам двух семестров более 101 балла
освобождаются от экзамена с оценкой отлично.
(без пересдач коллоквиумов и контрольных работ!)
6.
ЛитератураУчебники
Основы биохимии под редакцией А.А. Анисимова, 1986 г.
Д.Нельсон, М.Кокс Основы биохимии Ленинжера, 2011 г.
Т.Т. Березов, Б.Ф. Коровкин Биологическая химия, 2008
Комов В.П., Шведова В.Н. Биохимия в 2 ч. 2017. Доступна на ЭБС «Юрайт».
Покровский В.С. Биохимия человека. Обмен углеводов. М.: Е-ното, 2022
Покровский В.С. Биохимия человека. Обмен липидов. М.: Е-ното, 2023
Методические пособия в Фонде образовательных электронных ресурсов
Стручкова И.В., Брилкина А.А., Аникина Н.А. Аминокислоты. https://e-lib.unn.ru/MegaPro/Web/SearchResult/ToPage/1
Стручкова И.В. Брилкина А.А., Веселов А.П. Регуляция биосинтеза белка. https://e.lanbook.com/book/15334
7.
БИОХИМИЯ это наука о химическом составе живых организмов ипревращениях веществ и энергии, лежащих в основе жизненных
процессов
Для веществ исследуется:
- строение
- путь синтеза и распада,
- механизм действия
- роль в биосистемах разного уровня
(клетка, организм, биоценоз и биосфера в целом)
8.
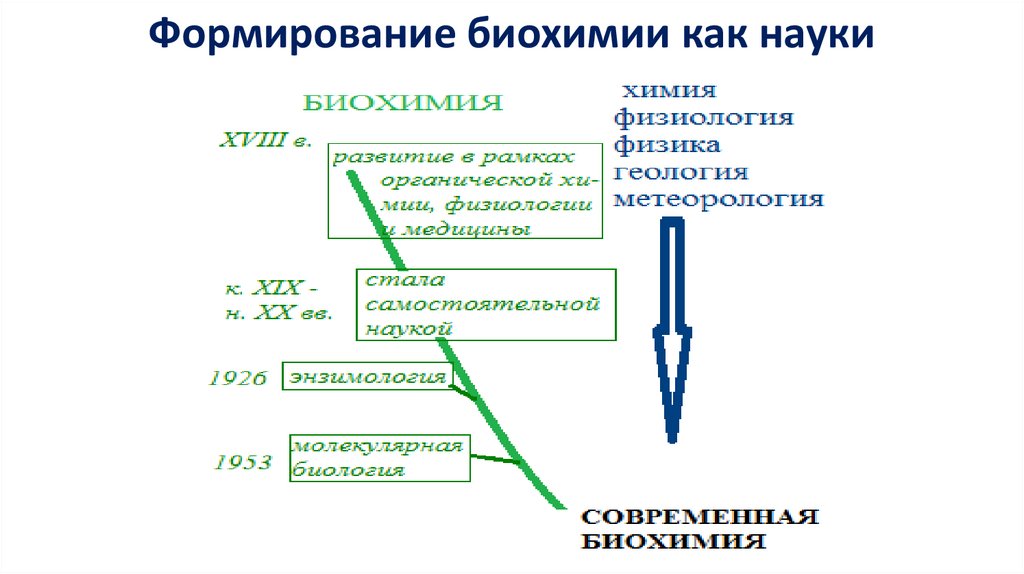
Формирование биохимии как науки9.
Разделы биохимииСтатическая
Динамическая
Общая
Человека и животных
Растений
Микроорганизмов
Медицинская (клиническая), техническая, экологическая, энзимология
Молекулярная биология, геномика, протеомика
10.
Курсы по биохимии для направленияФундаментальная медицина
Общая биохимия
Биологически активные вещества растений в медицине (биохимики)
Медицинская биохимия (биохимики)
Лабораторная диагностика (биохимики и биофизики)
Клиническая лабораторная диагностика
Канцерогенез (биохимики и биофизики)
Энзимология: медицинские аспекты (биохимики)
Регуляция метаболизма (биохимики)
Биохимия органов и тканей (биохимики)
11.
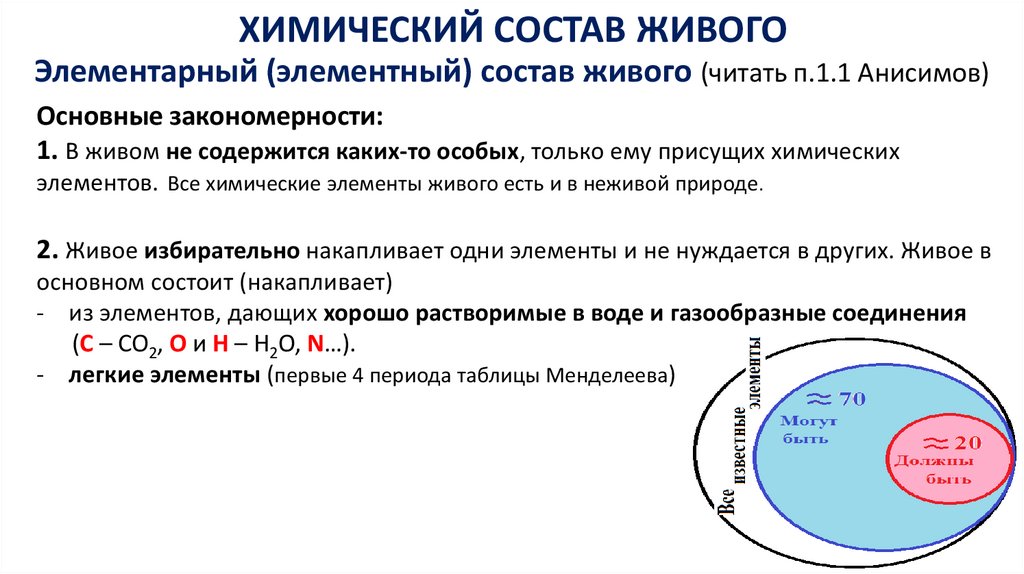
ХИМИЧЕСКИЙ СОСТАВ ЖИВОГОЭлементарный (элементный) состав живого (читать п.1.1 Анисимов)
Основные закономерности:
1. В живом не содержится каких-то особых, только ему присущих химических
элементов. Все химические элементы живого есть и в неживой природе.
2. Живое избирательно накапливает одни элементы и не нуждается в других. Живое в
основном состоит (накапливает)
- из элементов, дающих хорошо растворимые в воде и газообразные соединения
(C – CO2, O и H – Н2О, N…).
- легкие элементы (первые 4 периода таблицы Менделеева)
12.
ХИМИЧЕСКИЙ СОСТАВ ЖИВОГОЭлементарный (элементный) состав живого
13.
ХИМИЧЕСКИЙ СОСТАВ ЖИВОГОЭлементарный (элементный) состав живого
3. Потребность в химических элементах и их содержание в организме различны для организмов
разного систематического положения
1)
2)
Se (отруби пшеничные 77 мкг, семечки подсолнуха 53 мкг/100 г). Суточная потребность Se 55 мкг
Йод
Фукус содержит йода 65 мкг/100 г
ламинария – 56 мкг/100г Суточная потребность 150 мкг
Эндемический зоб
4. Состав живых организмов тесно связан с составом той земной коры, с которой они
контактируют
1) особи одного вида в разной местности могут иметь количественно разный состав элементов
Элементозы (Пример - дефицит йода в России. На большей части России 50 мкг/сутки
Норма 150 мкг/сутки)
14.
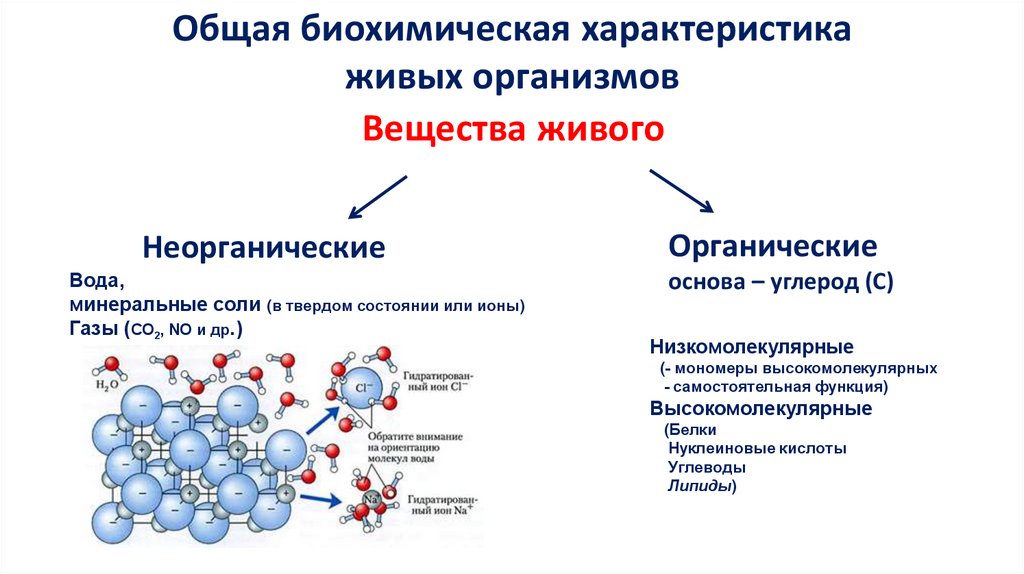
Общая биохимическая характеристикаживых организмов
Вещества живого
Неорганические
Вода,
минеральные соли (в твердом состоянии или ионы)
Газы (СО2, NO и др.)
Органические
основа – углерод (С)
Низкомолекулярные
(- мономеры высокомолекулярных
- самостоятельная функция)
Высокомолекулярные
(Белки
Нуклеиновые кислоты
Углеводы
Липиды)
15.
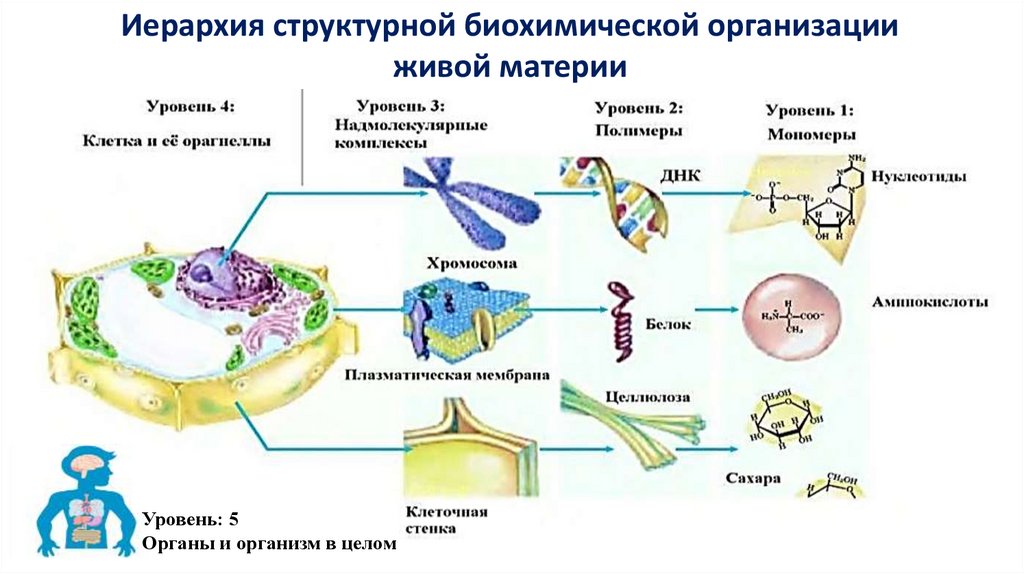
Иерархия структурной биохимической организацииживой материи
Уровень: 5
Органы и организм в целом
16.
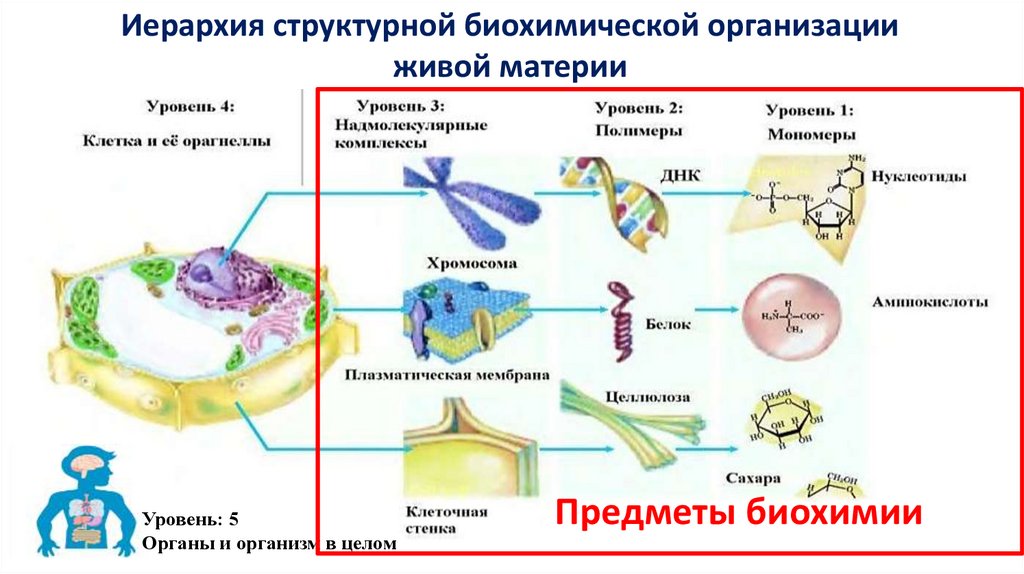
Иерархия структурной биохимической организацииживой материи
Уровень: 5
Органы и организм в целом
Предметы биохимии
17.
Общие принципы организации метаболизмав клетке
1. Высокая сложность организации.
2. Динамический характер постоянства состава. Катаболизм и анаболизм.
3. Каталитический характер. Ферменты.
4. Многоступенчатость и сопряженность (много реакций и процессов, одна реакция
вызывает другую). Метаболические пути.
5. Скоординированность во времени и пространстве. Метаболоны.
6. Компартментализация.
7. Авторегуляция (гомеостаз).
8. Каскадность и усиление сигналов.
18.
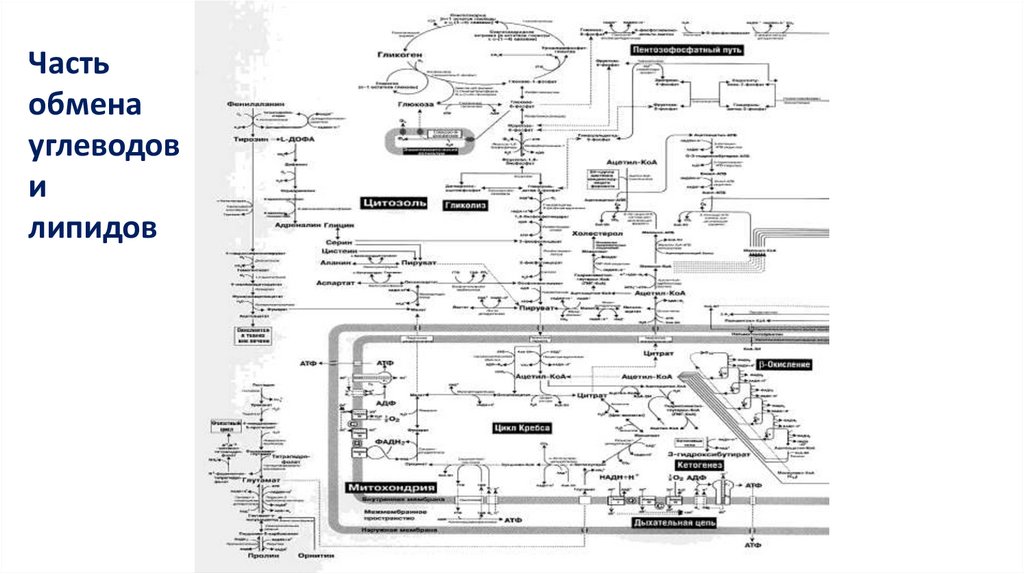
https://dytiscience.narod.ru/Chemistry/Metabolic_maps.htm
19.
Частьобмена
углеводов
и
липидов
20.
МетаболизмПервичный (центральный) метаболизм – цепи и циклы реакций, связанные с
пластическим и энергетическим обменом (например: синтез белка, образование
АТФ и т.д. Это углеродные потоки и оборот энергии.
Вторичный метаболизм – синтез организмом химических веществ, не играющих в
организме ни строительной, ни энергетической роли. Обычно синтезируются на
ответвлениях путей первичного метаболизма.
Катаболизм – процессы деградации
Анаболизм – процессы синтеза
21.
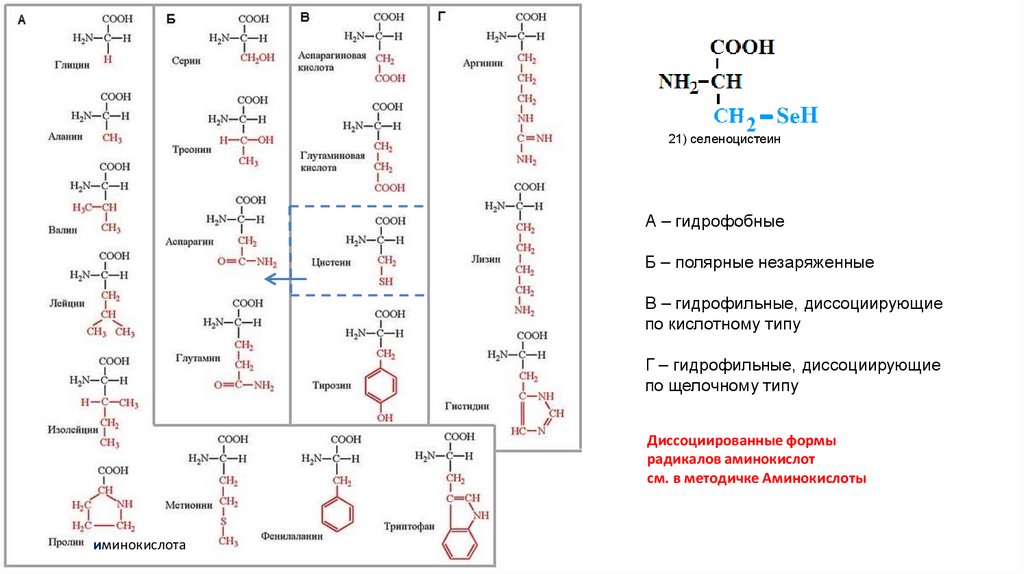
АМИНОКИСЛОТЫ22.
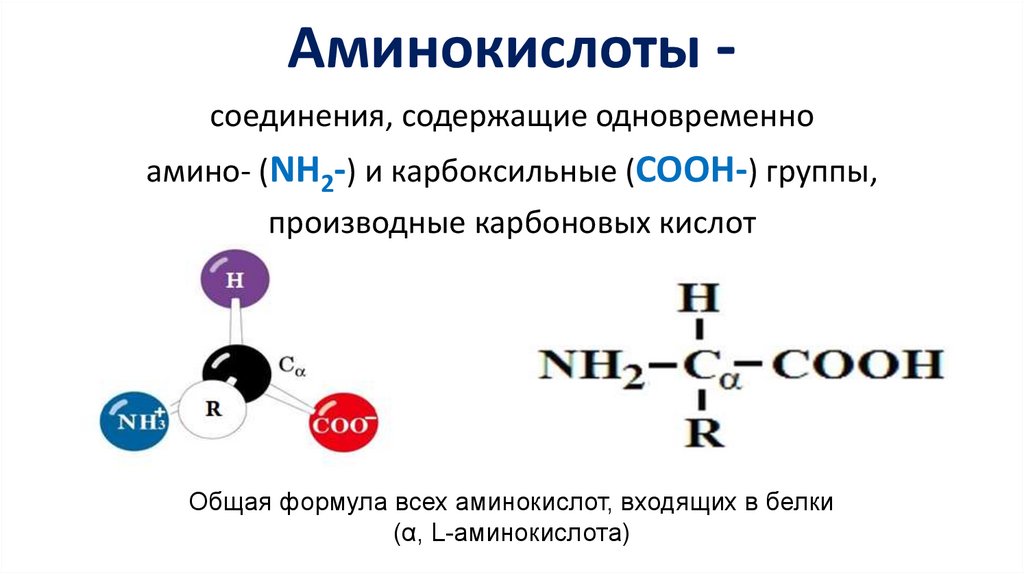
Аминокислоты соединения, содержащие одновременноамино- (NH2-) и карбоксильные (COOH-) группы,
производные карбоновых кислот
Общая формула всех аминокислот, входящих в белки
(α, L-аминокислота)
23.
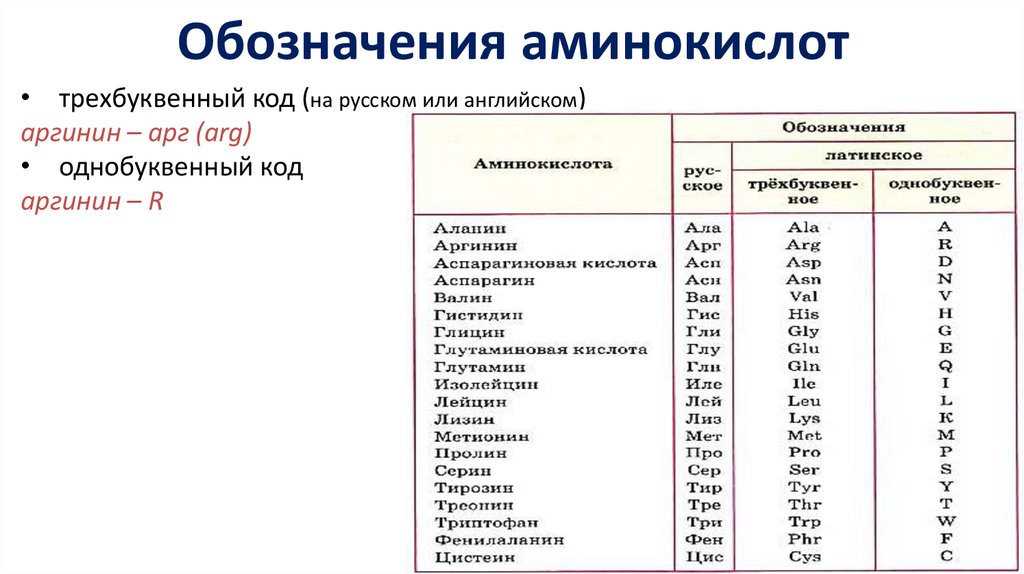
Обозначения аминокислот• трехбуквенный код (на русском или английском)
аргинин – aрг (arg)
• однобуквенный код
аргинин – R
24.
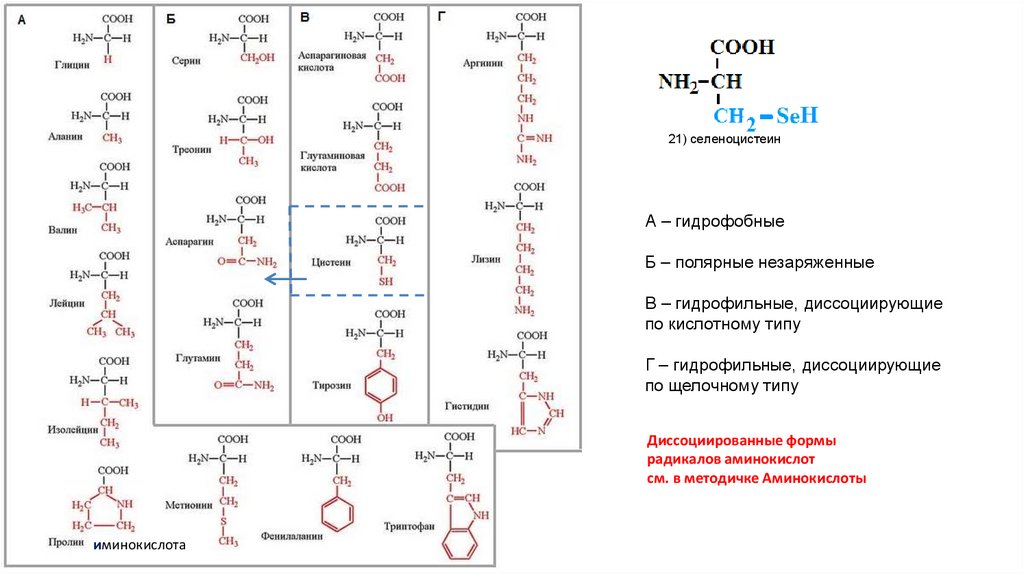
21) селеноцистеинА – гидрофобные
Б – полярные незаряженные
В – гидрофильные, диссоциирующие
по кислотному типу
Г – гидрофильные, диссоциирующие
по щелочному типу
Диссоциированные формы
радикалов аминокислот
см. в методичке Аминокислоты
иминокислота
25.
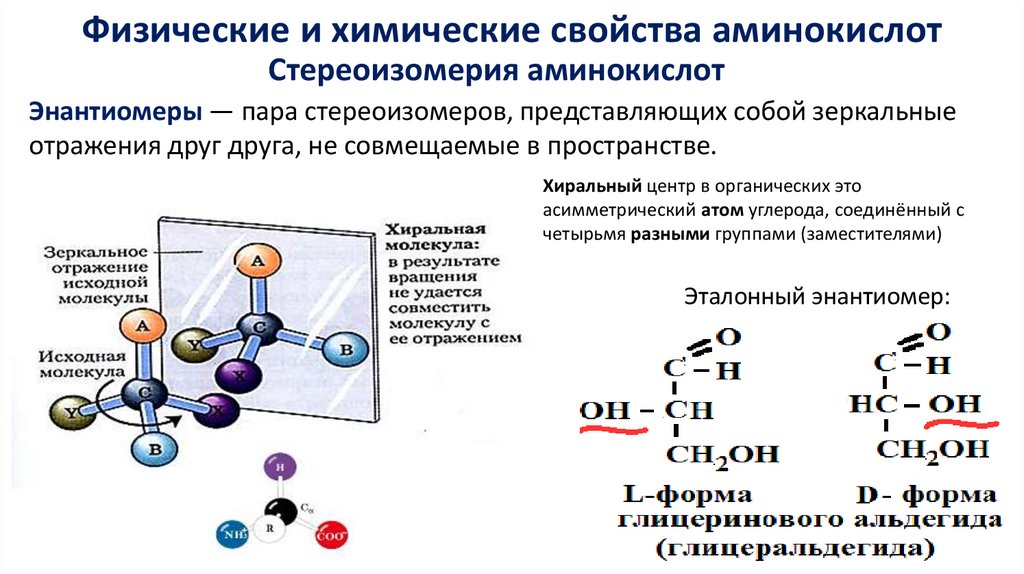
Физические и химические свойства аминокислотСтереоизомерия аминокислот
Энантиомеры — пара стереоизомеров, представляющих собой зеркальные
отражения друг друга, не совмещаемые в пространстве.
Хиральный центр в органических это
асимметрический атом углерода, соединённый с
четырьмя разными группами (заместителями)
Эталонный энантиомер:
26.
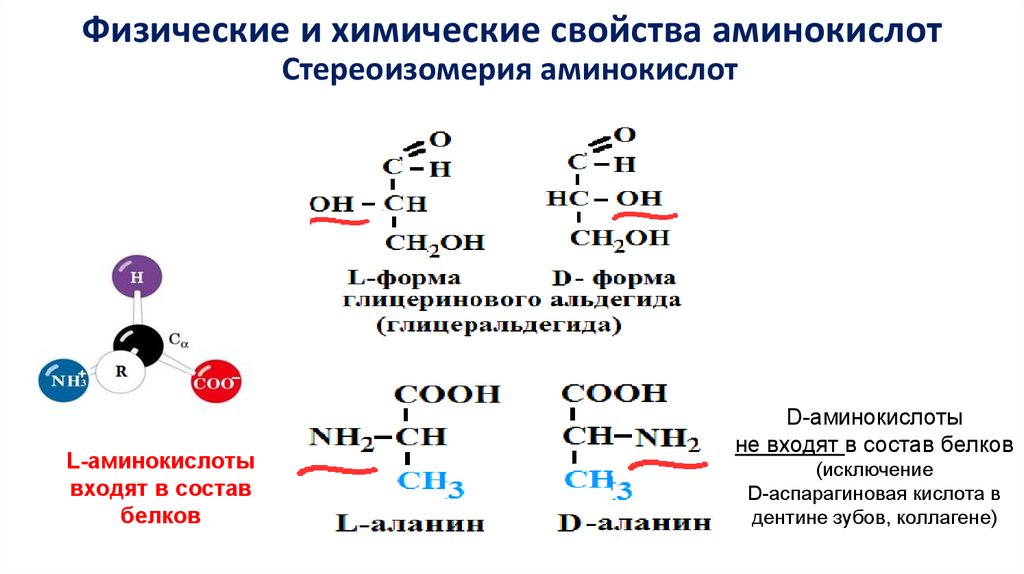
Физические и химические свойства аминокислотСтереоизомерия аминокислот
L-аминокислоты
входят в состав
белков
D-аминокислоты
не входят в состав белков
(исключение
D-аспарагиновая кислота в
дентине зубов, коллагене)
27.
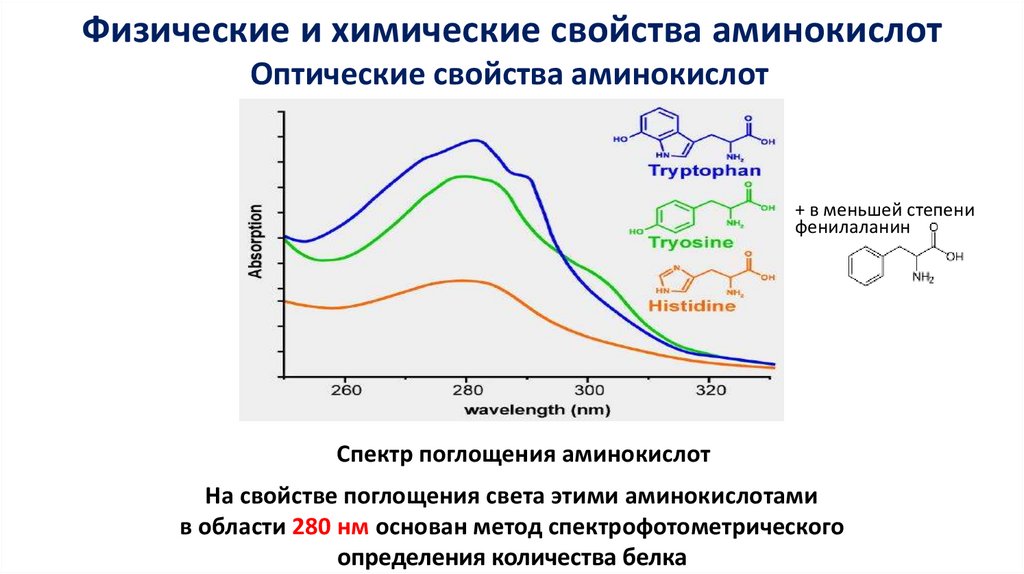
Физические и химические свойства аминокислотОптические свойства аминокислот
+ в меньшей степени
фенилаланин
Спектр поглощения аминокислот
На свойстве поглощения света этими аминокислотами
в области 280 нм основан метод спектрофотометрического
определения количества белка
28.
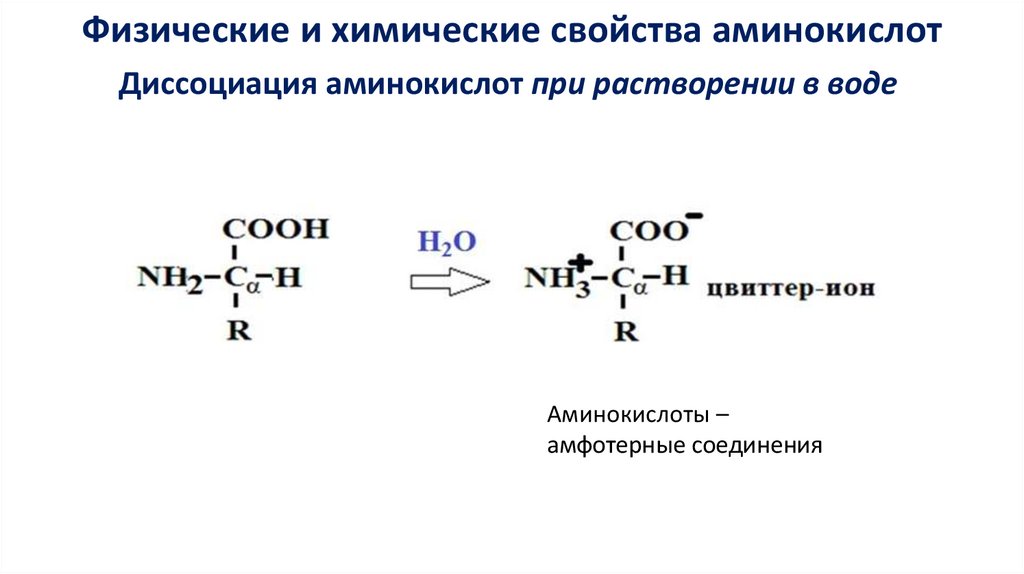
Физические и химические свойства аминокислотДиссоциация аминокислот при растворении в воде
Аминокислоты –
амфотерные соединения
29.
Физические и химические свойства аминокислотДиссоциация аминокислот при разном значении рН
Кислая среда
Щелочная среда
Диссоциация по
щелочному типу
Диссоциация по
кислотному типу
30.
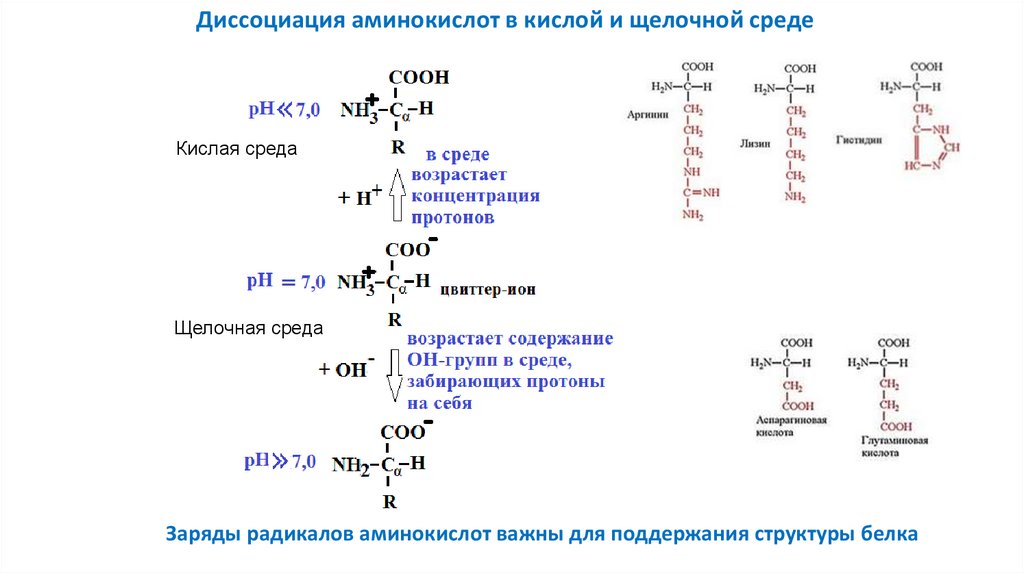
Диссоциация аминокислот в кислой и щелочной средеКислая среда
Щелочная среда
Заряды радикалов аминокислот важны для поддержания структуры белка
31.
Классификация аминокислот:1)
По химизму бокового радикала (алифатические, ароматические,
серусодержащие, гетероциклические …)
2)
По количеству СООН- (моноаминодикарбоновые) и NH2-групп
(диаминомонокарбоновые)
3)
По способности (или неспособности) к диссоциации бокового радикала
аминокислот (заряженные и не заряженные)
4)
По типу изомерии: α, ß и т.д. (по взаиморасположению СООН- и NH2-групп);
структурная изомерия (лей – илей), L- и D-изомеры (энантиомеры)
5)
Белковые (протеиногенные) и небелковые
6)
Заменимые – незаменимые
32.
21) селеноцистеинА – гидрофобные
Б – полярные незаряженные
В – гидрофильные, диссоциирующие
по кислотному типу
Г – гидрофильные, диссоциирующие
по щелочному типу
Диссоциированные формы
радикалов аминокислот
см. в методичке Аминокислоты
иминокислота
33.
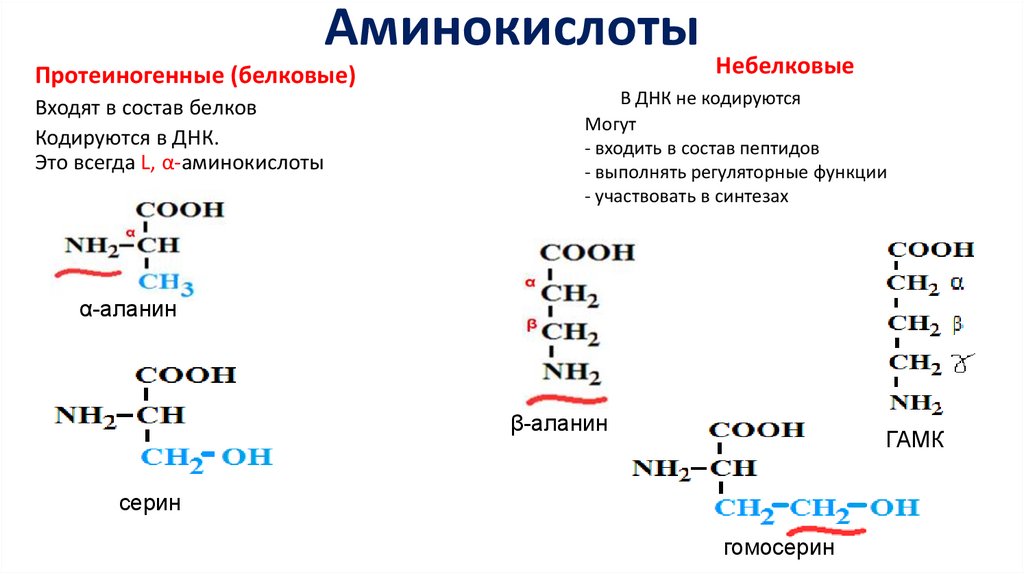
АминокислотыПротеиногенные (белковые)
Входят в состав белков
Кодируются в ДНК.
Это всегда L, α-аминокислоты
Небелковые
В ДНК не кодируются
Могут
- входить в состав пептидов
- выполнять регуляторные функции
- участвовать в синтезах
α-аланин
β-аланин
ГАМК
серин
гомосерин
34.
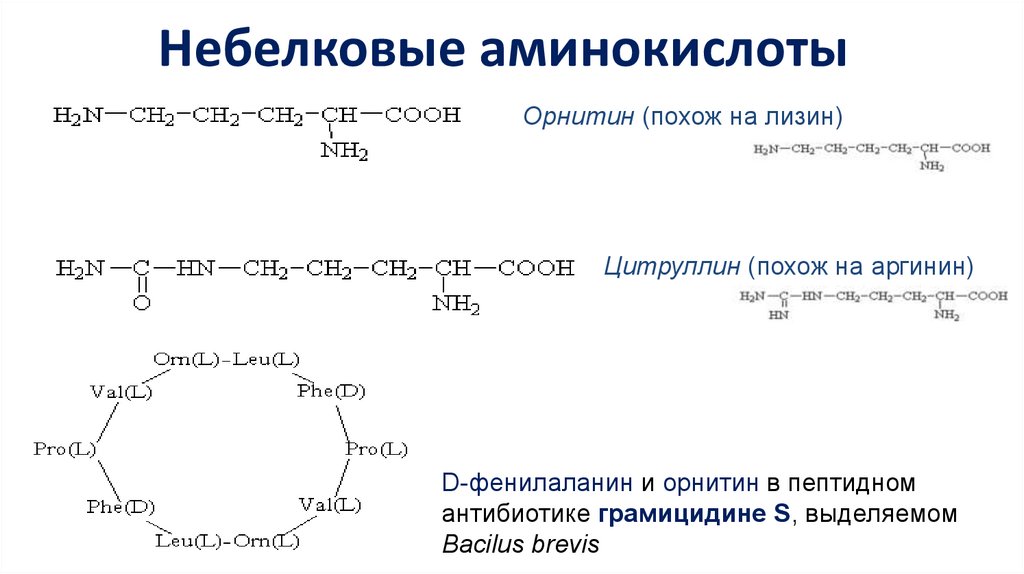
Небелковые аминокислотыОрнитин (похож на лизин)
Цитруллин (похож на аргинин)
D-фенилаланин и орнитин в пептидном
антибиотике грамицидине S, выделяемом
Bacilus brevis
35.
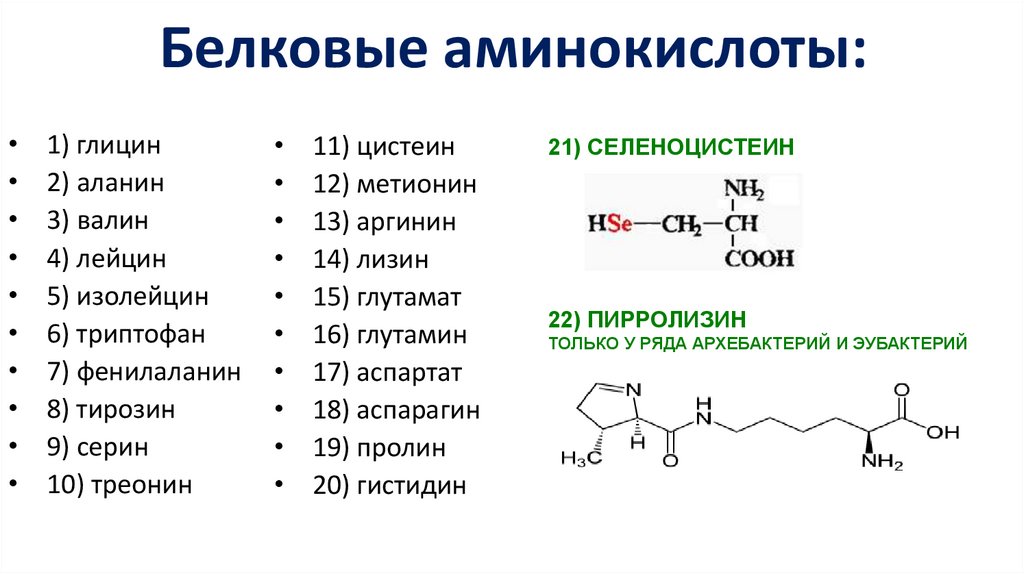
Белковые аминокислоты:1) глицин
2) аланин
3) валин
4) лейцин
5) изолейцин
6) триптофан
7) фенилаланин
8) тирозин
9) серин
10) треонин
11) цистеин
12) метионин
13) аргинин
14) лизин
15) глутамат
16) глутамин
17) аспартат
18) аспарагин
19) пролин
20) гистидин
21) СЕЛЕНОЦИСТЕИН
22) ПИРРОЛИЗИН
ТОЛЬКО У РЯДА АРХЕБАКТЕРИЙ И ЭУБАКТЕРИЙ
36.
Зачем нужен селеноцистеин?Обеспечение функционирования
белков-селенопротеинов:
йодотиронин-йодиназа (монодейодиназа) – превращение гормона тироксина в
трийодтиронин
тиоредоксинредуктаза – антиоксидантная активность: восстанавливает глутатион
глутатионпероксидаза – антиоксидантная активность: защита против Н2О2 и других
пероксидов
37.
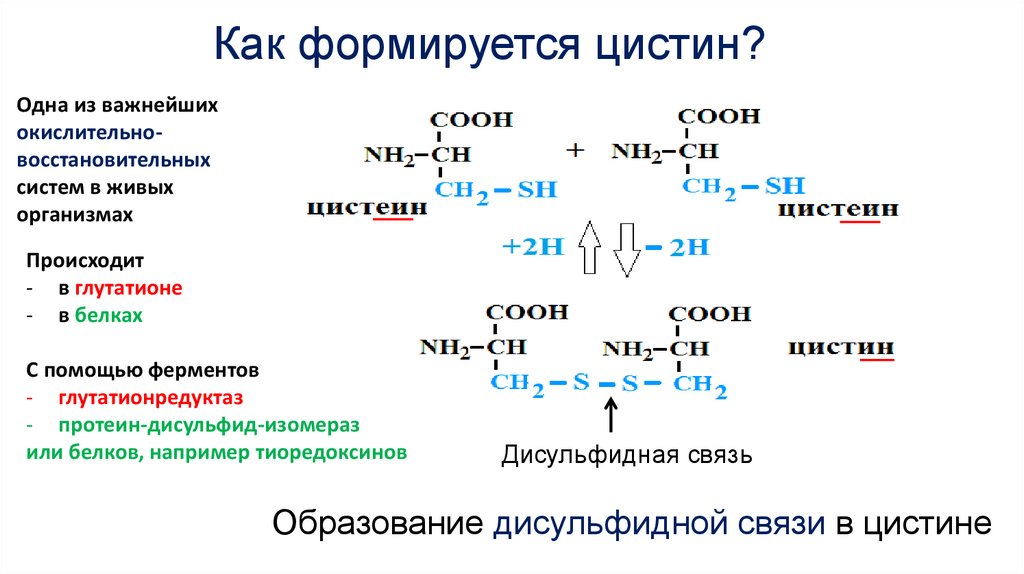
Как формируется цистин?Одна из важнейших
окислительновосстановительных
систем в живых
организмах
Происходит
- в глутатионе
- в белках
С помощью ферментов
- глутатионредуктаз
- протеин-дисульфид-изомераз
или белков, например тиоредоксинов
Дисульфидная связь
Образование дисульфидной связи в цистине
38.
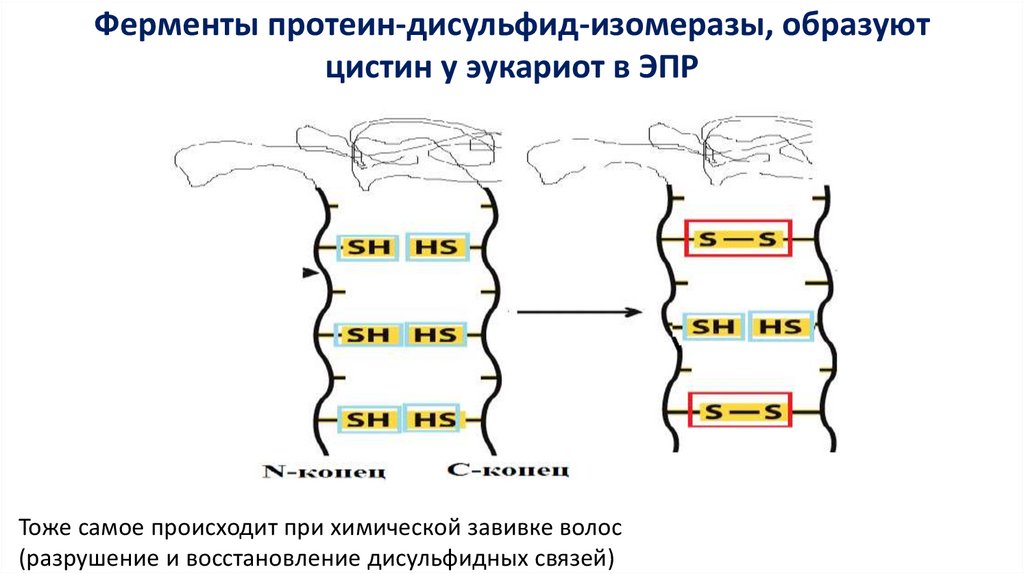
Ферменты протеин-дисульфид-изомеразы, образуютцистин у эукариот в ЭПР
Тоже самое происходит при химической завивке волос
(разрушение и восстановление дисульфидных связей)
39.
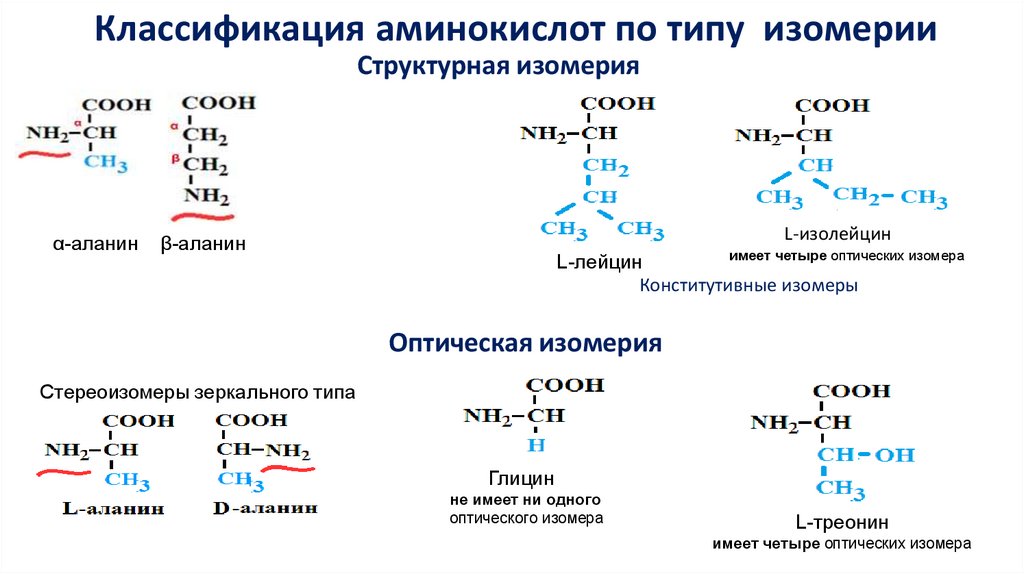
Классификация аминокислот по типу изомерииСтруктурная изомерия
α-аланин
L-изолейцин
β-аланин
имеет четыре оптических изомера
L-лейцин
Конститутивные изомеры
Оптическая изомерия
Стереоизомеры зеркального типа
Глицин
не имеет ни одного
оптического изомера
L-треонин
имеет четыре оптических изомера
40.
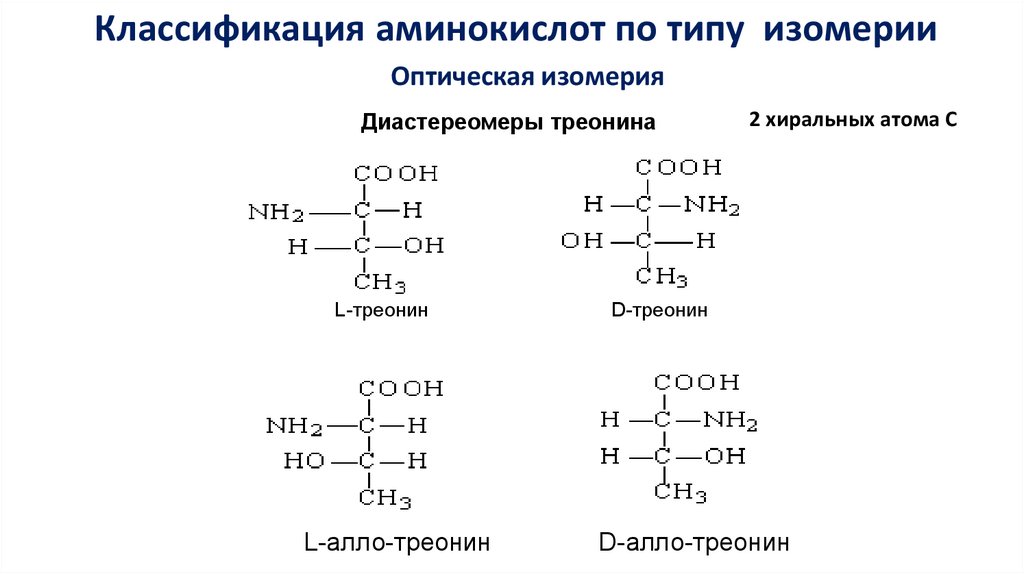
Классификация аминокислот по типу изомерииОптическая изомерия
Диастереомеры треонина
L-треонин
L-алло-треонин
2 хиральных атома С
D-треонин
D-алло-треонин
41.
Заменимые и незаменимые аминокислотыдля человека
Взрослый
организм
не нуждается
Селеноцистеин
Человек может синтезировать сам
Есть необходимые ферменты
Человек НЕ может синтезировать сам
Нет ферментов
Должен поглощать с пищей
• НО: для птиц незаменим глицин…
42.
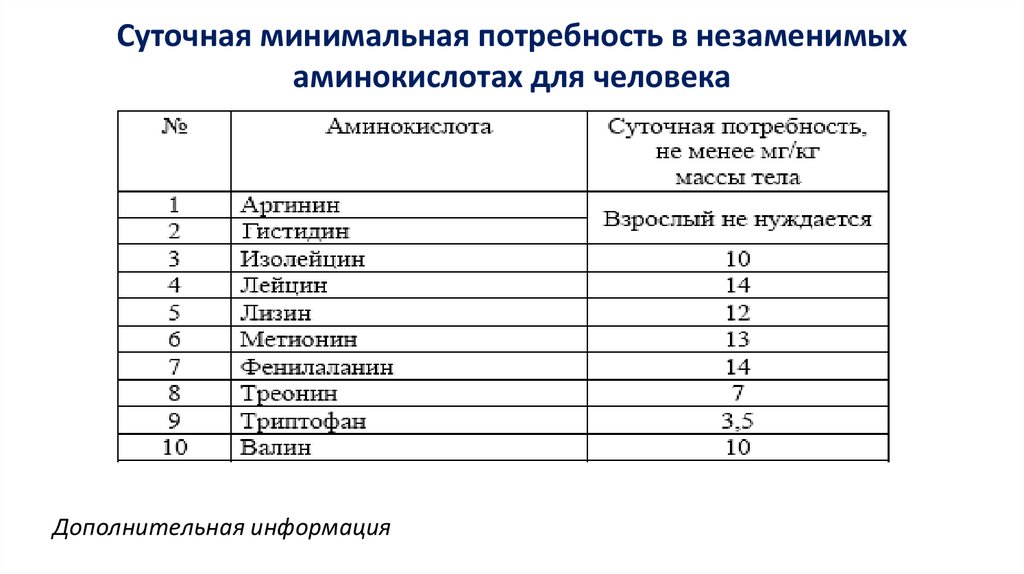
Суточная минимальная потребность в незаменимыхаминокислотах для человека
Дополнительная информация
43.
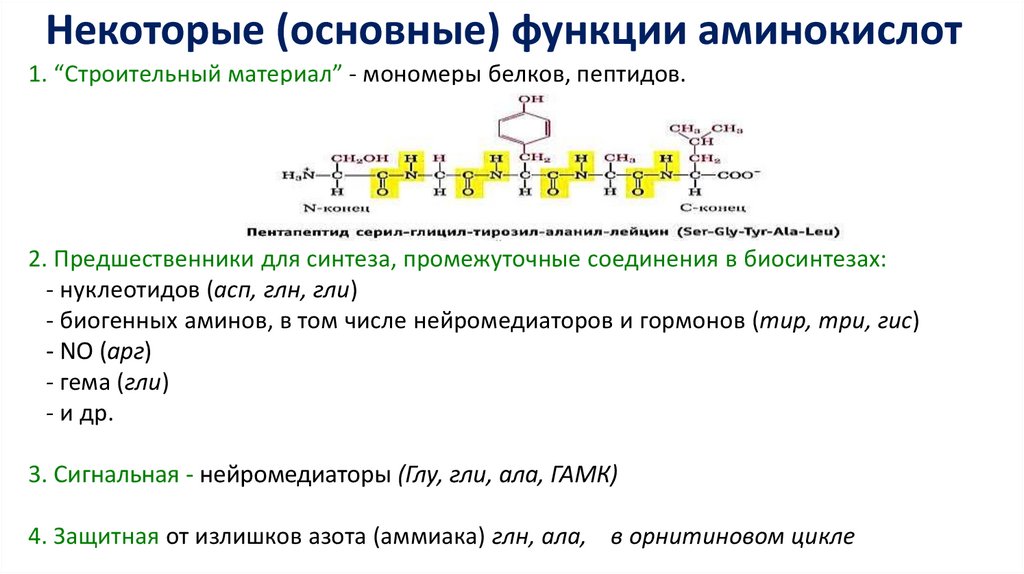
Некоторые (основные) функции аминокислот1. “Строительный материал” - мономеры белков, пептидов.
2. Предшественники для синтеза, промежуточные соединения в биосинтезах:
- нуклеотидов (асп, глн, гли)
- биогенных аминов, в том числе нейромедиаторов и гормонов (тир, три, гис)
- NO (арг)
- гема (гли)
- и др.
3. Сигнальная - нейромедиаторы (Глу, гли, ала, ГАМК)
4. Защитная от излишков азота (аммиака) глн, ала, в орнитиновом цикле
44.
Вопросы для подготовки к контрольной работе 1 “Аминокислоты”1. Формулы 21 белковой (протеиногенной) аминокислоты, включая селеноцистеин (пирролизин можно не
заучивать). См. методичку!!! Уметь указать свойства их боковых радикалов. Знать формулы цистина и
небелковых аминокислот β-аланина, орнитина, цитруллина, оксипролина, гомосерина (см. методичку).
2. Физико-химические свойства аминокислот: способность к оптической изомерии, характер диссоциации
боковых радикалов и связанная с ним классификация аминокислот. Уметь определять по заданной формуле,
к D- или L-ряду принадлежит аминокислота. Знать оптически неактивную аминокислоту.
3. Незаменимые аминокислоты (понятие, уметь перечислить незаменимые для человека аминокислоты).
4. Качественные реакции на аминокислоты и белки, химизм и алгоритм действий: биуретовая,
ксантопротеиновая, нингидриновая реакции; реакция обнаружения серы в белках, реакции осаждения
(лабораторное занятие 1).
5. Первичная структура белков и пептидов. Уметь написать трипептид из предложенных аминокислот и
указать пептидные связи (лабораторное занятие 1).
45.
Физические и химические свойства аминокислотДиссоциация. Кривая титрования
На способность к диссоциации
оказывают влияние радикалы
аминокислот.

















 biology
biology








