Similar presentations:
Строение атома. Ядро (протоны, нейтроны) и электроны. Изотопы
1.
Приготовь четвертинку !2.
Вариант 1.Вариант 2.
Вопрос 1.
Вопрос 1.
В ряду элементов Li → B → N → F
В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
1) убывает атомный радиус
2) возрастают металлические свойства
2) ослабевают металлические свойства
3)
уменьшается
число
протонов
в
атомном ядре
4) увеличивается число электронных
слоёв
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
3.
Вариант 1.Вариант 2.
Вопрос 2.
Основные
Вопрос 2.
свойства
соединений
усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
Основные
свойства
соединений
ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH
2) LiOH – Ba(OH)2 – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
4.
Вариант 1.Вариант 2.
Вопрос 3.
Химические
Вопрос 3.
элементы
перечислены
в
Химические
элементы
перечислены
в
порядке возрастания атомного радиуса в
порядке убывания атомного радиуса в
ряду
ряду
1) углерод, бериллий, магний
1) водород, бор, алюминий
2) калий, магний, алюминий
2) углерод, кремний, калий
3) хлор, натрий, фтор
3) натрий, хлор, фтор
4) азот, фосфор, фтор
4) сера, кремний, магний
5.
Сдаём работы!
6.
Урок 2. Строение атома.Ядро (протоны, нейтроны) и электроны.
Изотопы.
7.
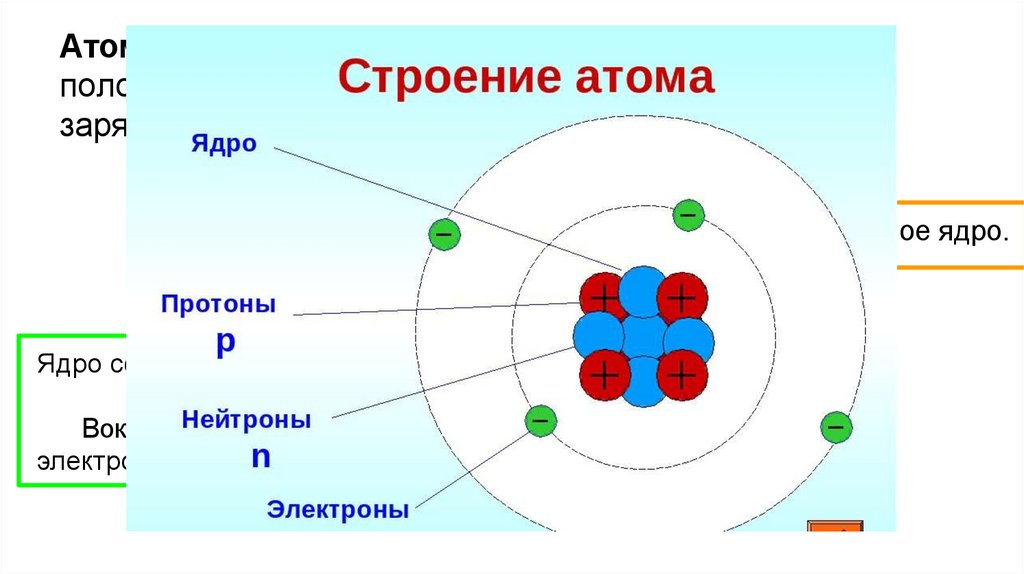
Атом - электронейтральная частица, состоящая изположительно заряженного ядра и отрицательно
заряженных электронов.
В центре атома находится положительно заряженное ядро.
Ядро состоит из элементарных частиц - протона и нейтрона
Вокруг атомного ядра по замкнутым орбиталям движутся
электроны
8.
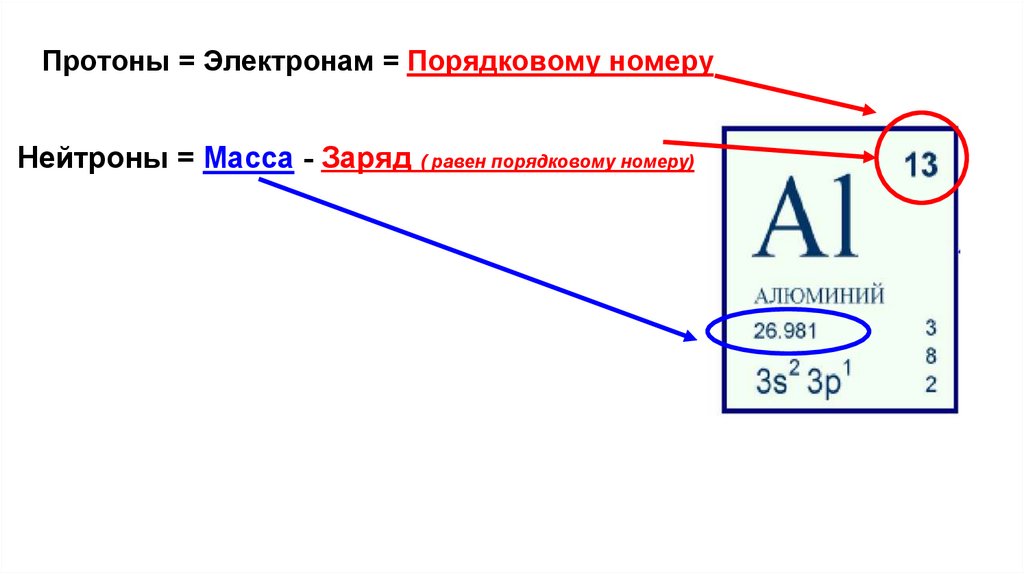
Протон (p) - Число протонов в атомном ядре равно порядковому номеруэлемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) - Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный
числу протонов (порядковому номеру).
(Al) n= 27-13= 14
Электрон ( е–) — условным зарядом –1.
Число электронов в атоме равно заряду ядра атома (порядковому
номеру элемента в Периодической системе Д.И. Менделеева).
9.
Протоны = Электронам = Порядковому номеруНейтроны = Масса - Заряд ( равен порядковому номеру)
10.
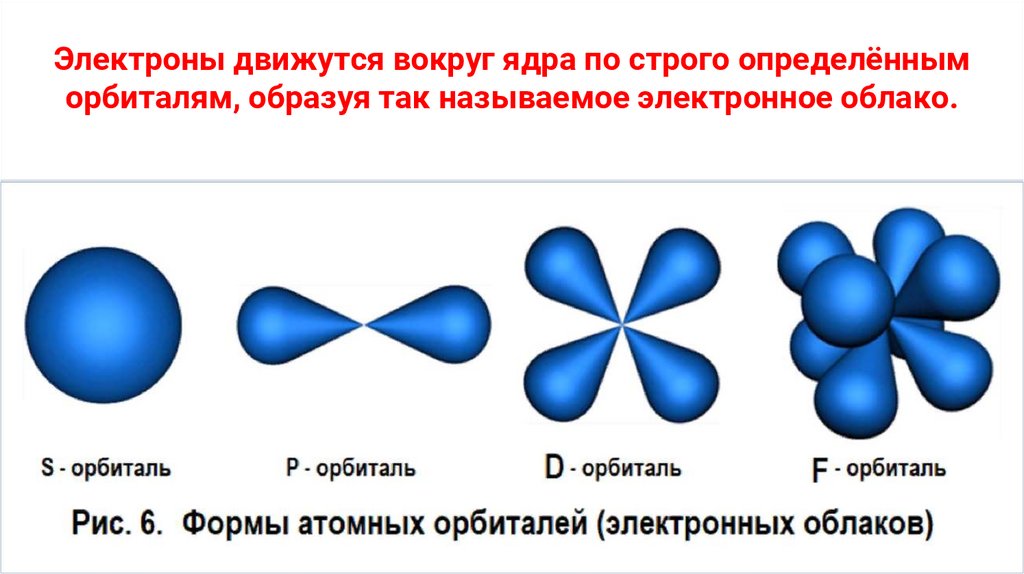
Электроны движутся вокруг ядра по строго определённыморбиталям, образуя так называемое электронное облако.
11.
12.
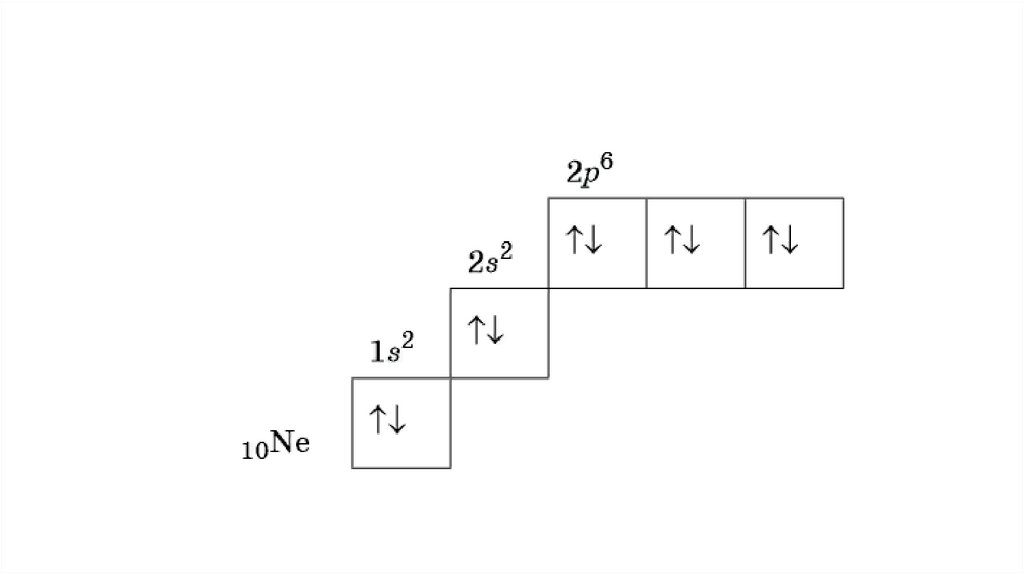
Орбитали изображают в виде квадрата, сверху или снизу которогопишут значения главного и побочного квантовых чисел,
описывающих данную орбиталь.
Такую запись называют графической электронной формулой,
например:
13.
В этой формуле стрелками обозначают электрон, а направление стрелкисоответствует направлению спина — собственного магнитного момента
электрона.
Электроны с противоположными спинами ↑↓ называют спаренными.
Максимальное количество электронов
S = 2 электрона P = 6 электронов d = 10 электронов f = 14 электронов
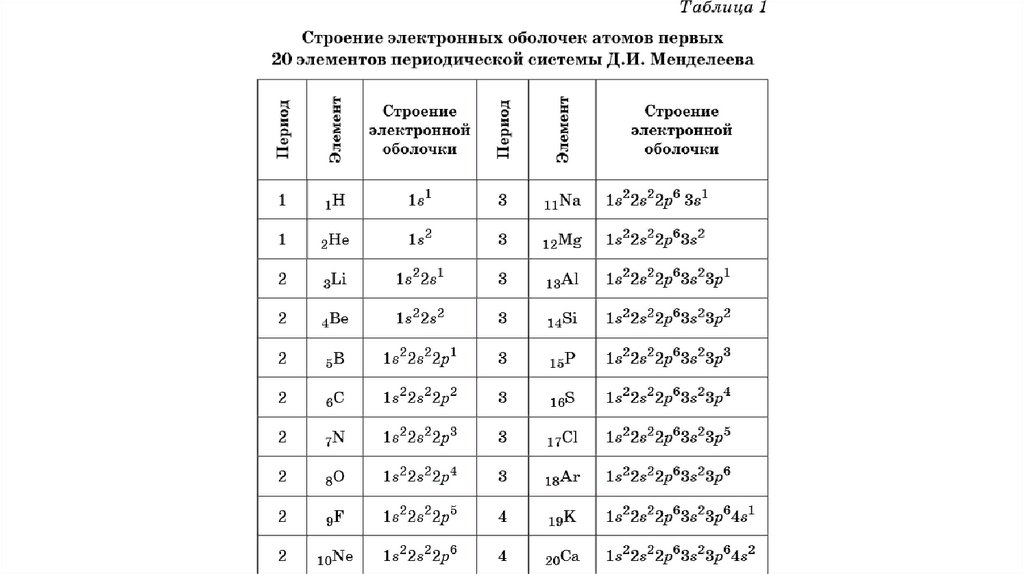
1 уровень: 1S2
2 уровень : 2S2 2p6
3 уровень : 3s2 3p6 3d10
4 уровень: 4S2 4p6 4d10
14.
равно периоду15.
16.
При заполнении энергетического подуровня каждый электронпрежде всего занимает отдельную ячейку, а только после этого
начинается их спаривание.
Например, у атома азота все p-электроны будут находиться в
отдельных ячейках, а у кислорода начнётся их спаривание, которое
полностью закончится у неона.
17.
18.
Изотопами называют атомы одного и того же элемента, содержащие всвоих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов
19.
Типовые заданияПример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
1. Li
2. Na
3. K
4. Cl
20.
На внешнем энергетическом уровне у данного элемента находится один 4sэлектрон. Следовательно, этот химический элемент находится в четвёртомпериоде первой группе главной подгруппе.
Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех
электронов, получим 19. Общее число электронов равно порядковому
номеру элемента.
Под номером 19 в периодической системе находится калий.
21.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электроннойконфигурации внешнего энергетического уровня атома этого элемента соответствует
электронная формула:
1.
ns2np4
2.
ns2np2
3.
ns2np3
4.
ns2np6
22.
По формуле высшего оксида (смотрите на формулы высших оксидов вПериодической системе) устанавливаем, что этот химический элемент
находится в четвёртой группе главной подгруппы.
У этих элементов на внешнем энергетическом уровне находятся четыре
электрона — два s и два p.
Следовательно, правильный ответ 2.
23.
Тренировочные задания1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
24.
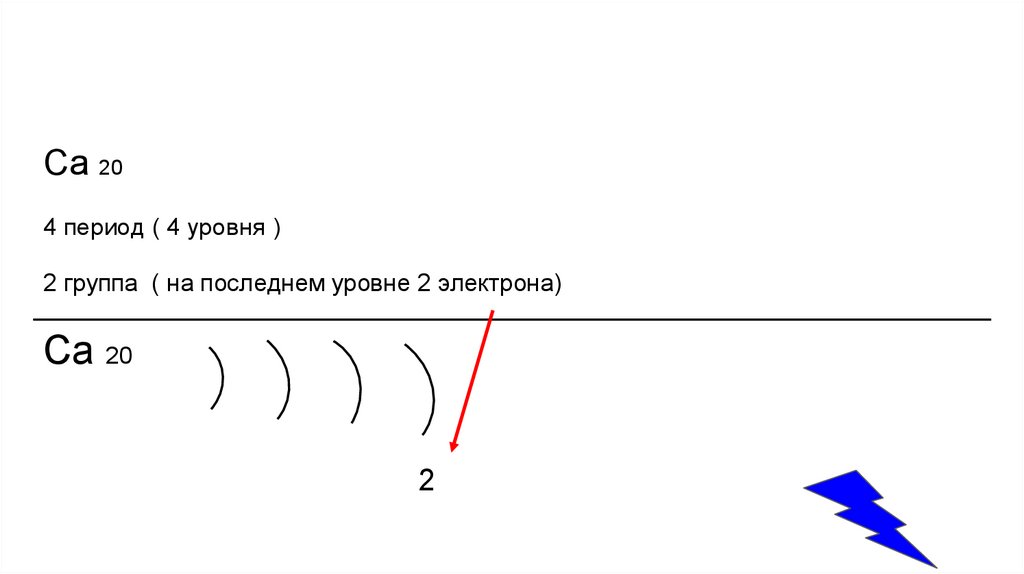
Ca 204 период ( 4 уровня )
2 группа ( на последнем уровне 2 электрона)
Ca 20
2
25.
Ca 201S2
2
2S2 2P6
8
3s2 3p6
8
4s2
2
cчитаем S электроны = 8
26.
2. Число спаренных p-электронов в атоме азота равно1) 7
2) 14
3) 3
4) 4
27.
3. Число неспаренных s-электронов в атоме азота равно1) 7
2) 14
3) 3
4) 4
28.
4. Число электронов на внешнем энергетическом уровне атома аргона равно1) 18
2) 6
3) 4
4) 8
29.
5. Число протонов, нейтронов и электронов в атоме 94Be равно1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
30.
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому,расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
31.
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схемаэлектронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
32.
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучееводородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
33.
9. Число электронных слоёв в атоме химического элемента равно1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
34.
10. Число внешних электронов в атомах химических элементов главныхподгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
35.
11. Два электрона находятся во внешнем электронном слое атомовкаждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
36.
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1,образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
37.
13. Число электронных слоев и число p-электронов в атоме серы равно1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
38.
14. Электронная конфигурация ns2np4 соответствует атому1) хлора
2) серы
3) магния
4) кремния
39.
15. Валентные электроны атома натрия в основном состояниинаходятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
40.
16. Атомы азота и фосфора имеют1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
41.
17. Одинаковое число валентных электронов имеют атомы кальция и1) калия
2) алюминия
3) бериллия
4) бора
42.
18. Атомы углерода и фтора имеют1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
43.
19. У атома углерода в основном состоянии число неспаренных электроновравно
1) 1
3) 3
2) 2
4) 4
44.
20. В атоме кислорода в основном состоянии число спаренных электроновравно
1) 2
3) 4
2) 8
4) 6






































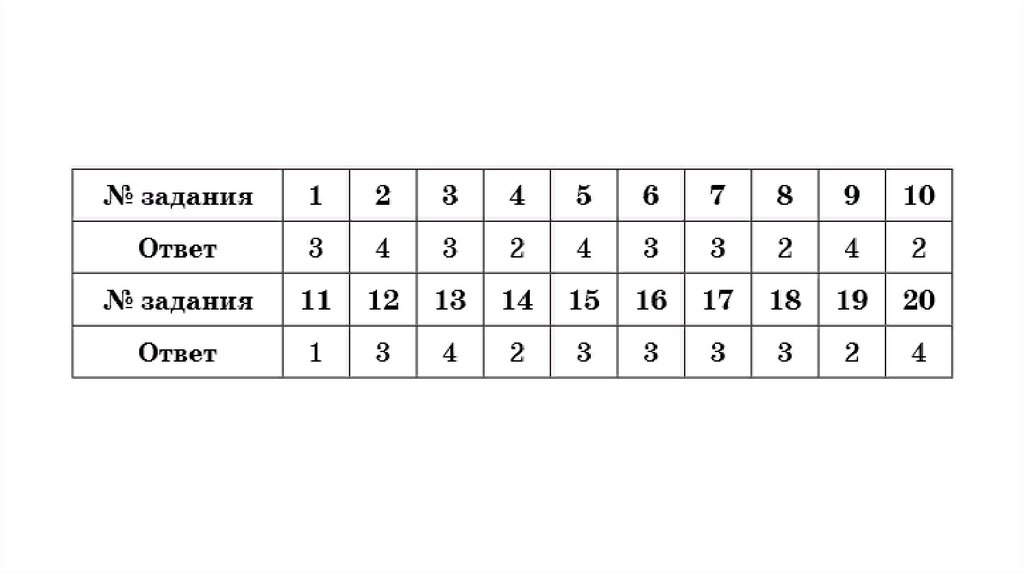
 chemistry
chemistry








