Similar presentations:
Скорость химической реакции
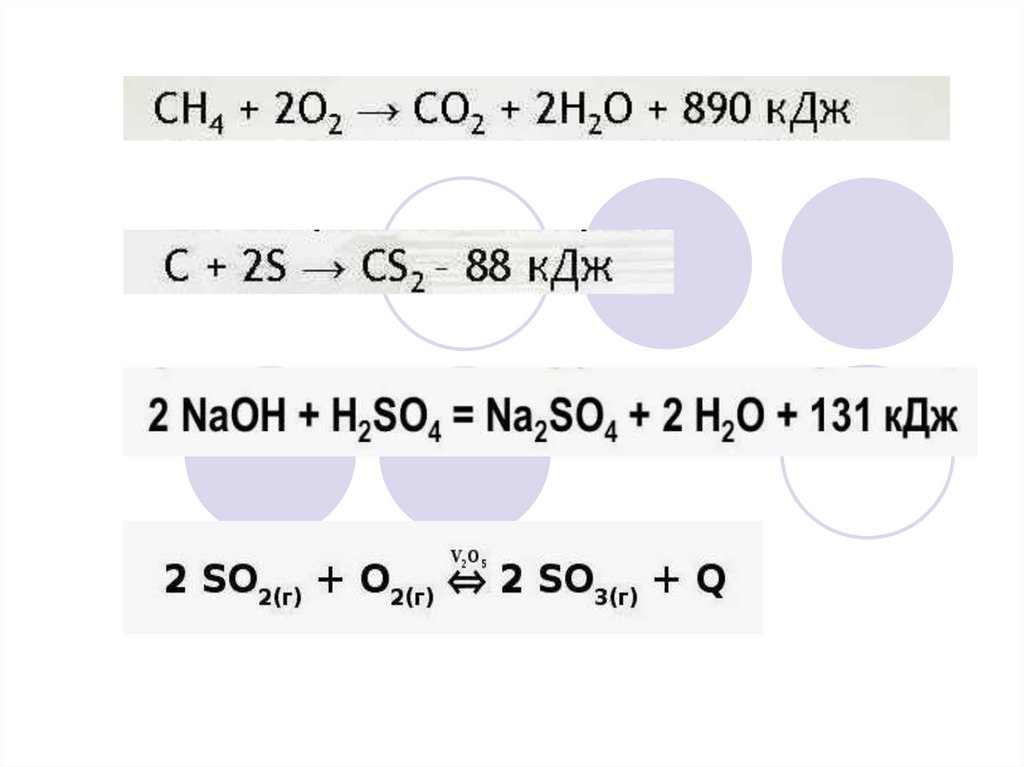
1.
2.
3.
- раздел химии, который изучает скоростихимических реакций, их зависимость от
различных факторов.
Знание скорости химической
реакции имеет большое
практическое значение:
позволяет замедлять или ускорять процессы,
сопровождающие нас в повседневной жизни:
коррозия металлов, хранение продуктов питания и
т. д.
4.
определяется изменением количества вещества за единицувремени в единице объёма
v
V t
•«+» - если скорость определяется по продукту реакции;
•«-» - если по исходному веществу
v
S t
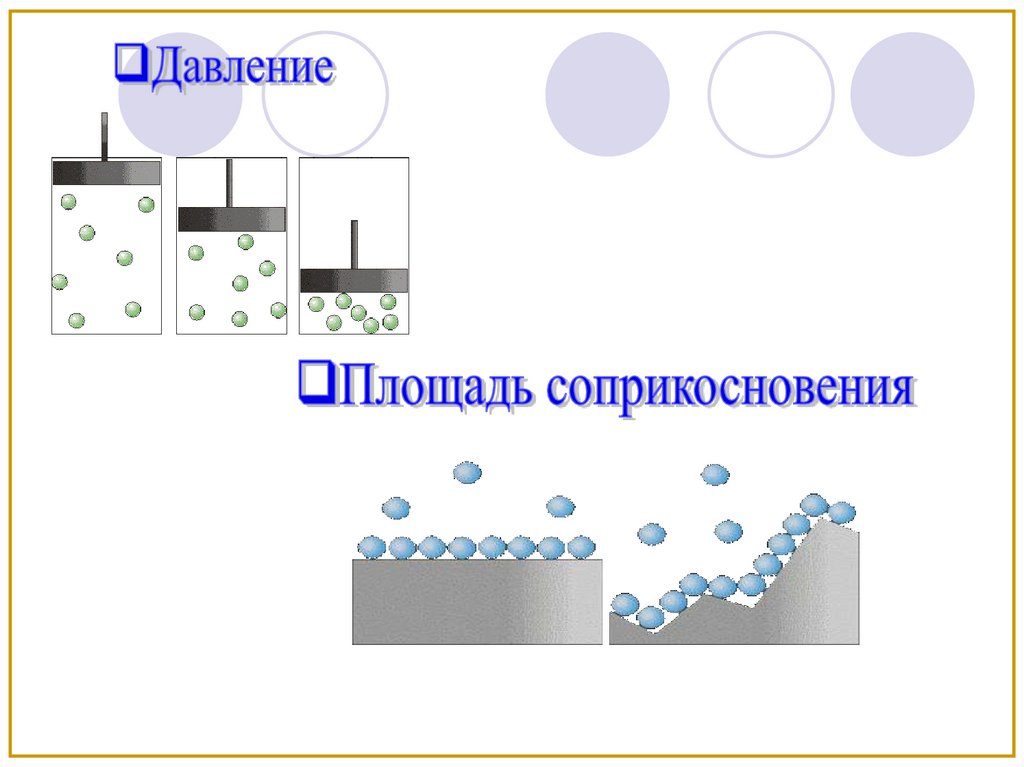
Взаимодействие происходит только на
поверхности раздела между веществами
5.
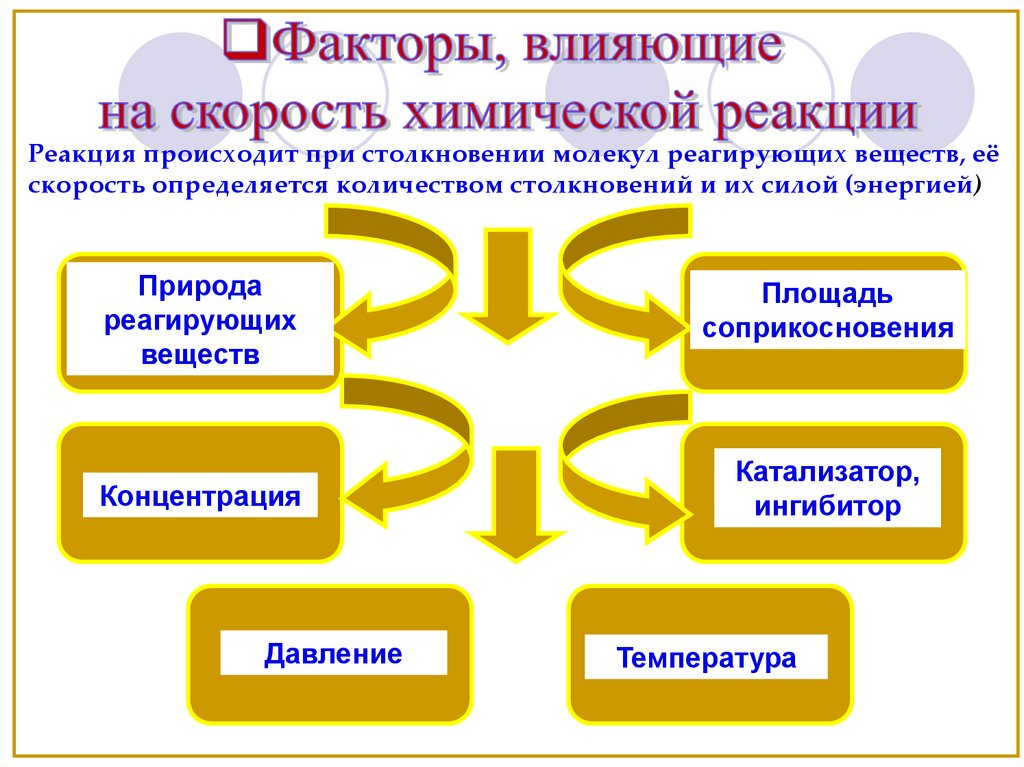
Реакция происходит при столкновении молекул реагирующих веществ, еёскорость определяется количеством столкновений и их силой (энергией)
Природа
реагирующих
веществ
Площадь
соприкосновения
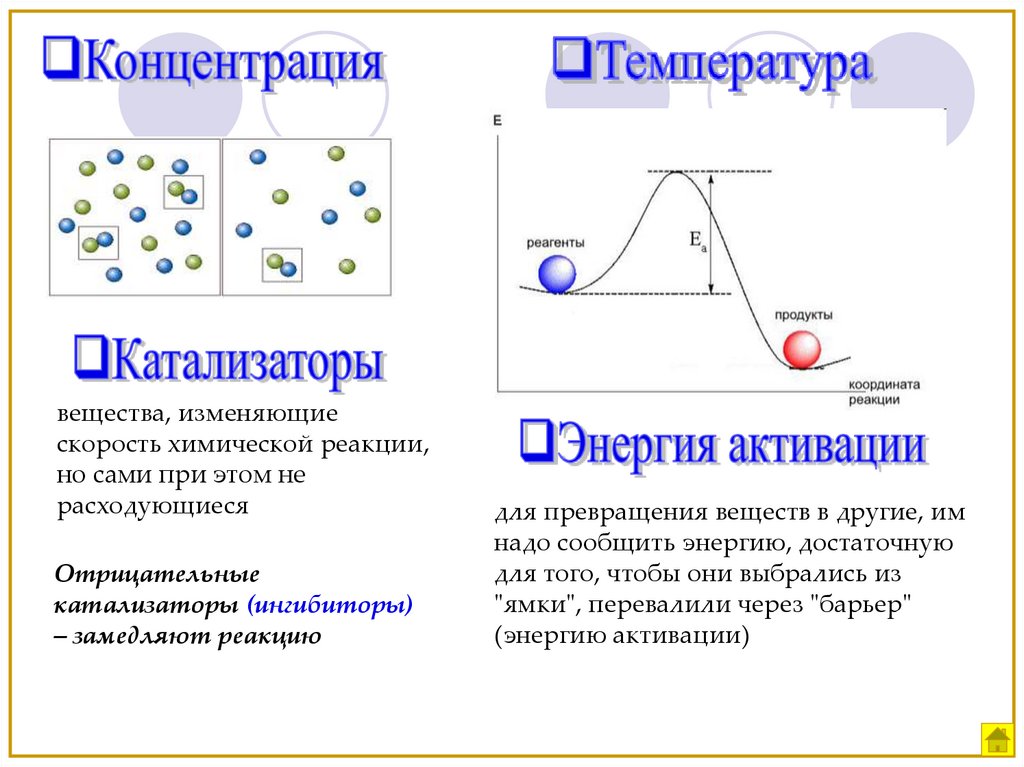
Концентрация
Катализатор,
ингибитор
Давление
Температура
6.
вещества, изменяющиескорость химической реакции,
но сами при этом не
расходующиеся
Отрицательные
катализаторы (ингибиторы)
– замедляют реакцию
для превращения веществ в другие, им
надо сообщить энергию, достаточную
для того, чтобы они выбрались из
"ямки", перевалили через "барьер"
(энергию активации)
7.
8.
1.Вычислите среднюю скорость химической реакции, если через
20 с от начала реакции концентрация веществ составляла 0,05
моль/л, а через 40 с – 0,04 моль/л.
Дано:
τ1 = 20c
τ2 = 40c
c1 = 0,05моль/л
с2 = 0,04моль/л
Найти: v
Расчёт ведём по исходному веществу,
значит перед формулой ставим знак «-»
υ = -∆с/∆τ
υ = -(с2-с1)/(τ2- τ1)
υ = -(0,04-0,05)/(40-20) = 0,0005 (моль/(л∙с))
Ответ: средняя скорость реакции 0,0005моль/(л∙с)
9.
Химическое равновесиеРавновесие – состояние системы, при которой ее
параметры (температура, давление, концентрация
реагентов и продуктов) не меняются во времени.
Достижение
реакции
равновесия
не
означает
прекращения
Принцип Ле-Шателье: если на систему, находящуюся в
состоянии равновесия, оказать внешнее воздействие
(концентрация, температура, давление), то равновесие
смещается в сторону ослабления этого воздействия.
10.
Условия смещения равновесия1) При повышении температуры равновесие смещается
в сторону эндотермической реакции (-Q), а при понижении
температуры в сторону экзотермической реакции (+Q).
2) При увеличении давления равновесие смещается
в сторону меньших объемов, а при понижении
давления в сторону больших объемов. (только для газов)
3) Чтобы сместить равновесие в сторону продуктов реакции
(вправо), необходимо повысить концентрацию одного из
исходных веществ.
Чтобы сместить равновесие в сторону исходных веществ
(влево), необходимо повысить концентрацию одного из
продуктов реакции.
2SО2 (г) + O2 (г) ↔ 2SO3 (г) + Q
11.
1. Химическое равновесие реакции2NO2 (г) ↔ 2NO (г) + O2 (г) - Q
смещается в сторону образования продуктов при:
а) понижении to;
б) повышении to;
в) использовании катализатора; г) повышении давления.
2. Химическое равновесие реакции
3O2 (г) ↔ 2O3(г) - Q
смещается в сторону исходных веществ (влево) при:
а) повышении to;
б) понижении to;
в) повышении давления;
г) уменьшения О3.
3. Химическое равновесие реакции
Н2 (г) + С2Н4 (г) ↔ С2Н6 (г) + Q
смещается в сторону образования продукта при:
а) понижении давления;
б) повышении давления;
в) использовании катализатора;
г) повышении to.
11
12.
Домашнее задание:1) Выучить параграф 3.
2) Решить задачу 5 на с. 23.
3) Ответить на вопросы:
А) Химическое равновесие реакции
S (тв) + Н2 (г) ↔ Н2S(г) + Q
смещается в сторону исходных веществ (влево) при:
а) повышении давление; б) уменьшении to;
в) уменьшении Н2;
г) применении катализатора.
Б) Химическое равновесие реакции
2СО (г) + O2 (г) ↔ 2СO2 (г) + Q
смещается в сторону образования продукта при:
а) повышении to;
б) понижении to;
в) понижении давления; г) применении катализатора.
В) Какое воздействие на реакционную систему
FeO (тв) + Н2 (г) ↔ Fe (тв) + Н2O (г) - Q
не приведет к смещению равновесия?:
а) понижение давления;
б) повышение to;
в) добавление водорода;
г) понижение to








 chemistry
chemistry








