Similar presentations:
Скорость химических реакций. Химическое равновесие
1.
Скорость химических реакций.Химическое равновесие.
2.
План лекции:1. Понятие о скорости химической реакции
2. Факторы, влияющие на скорость химической реакции
3.
Химическое равновесие. Факторы, влияющие на
смещение равновесие. Принцип Ле Шателье
2
3.
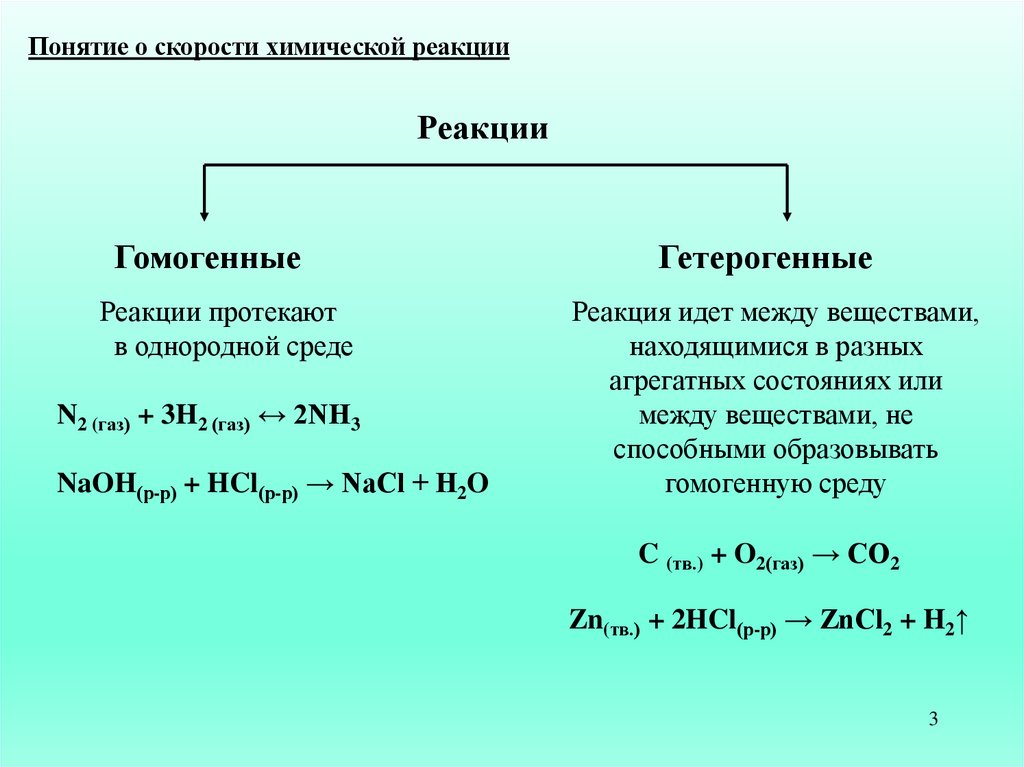
Понятие о скорости химической реакцииРеакции
Гомогенные
Гетерогенные
Реакции протекают
в однородной среде
Реакция идет между веществами,
находящимися в разных
агрегатных состояниях или
между веществами, не
способными образовывать
гомогенную среду
N2 (газ) + 3H2 (газ) ↔ 2NH3
NaOH(р-р) + HCl(р-р) → NaCl + H2O
C (тв.) + O2(газ) → CO2
Zn(тв.) + 2HCl(р-р) → ZnCl2 + H2↑
3
4.
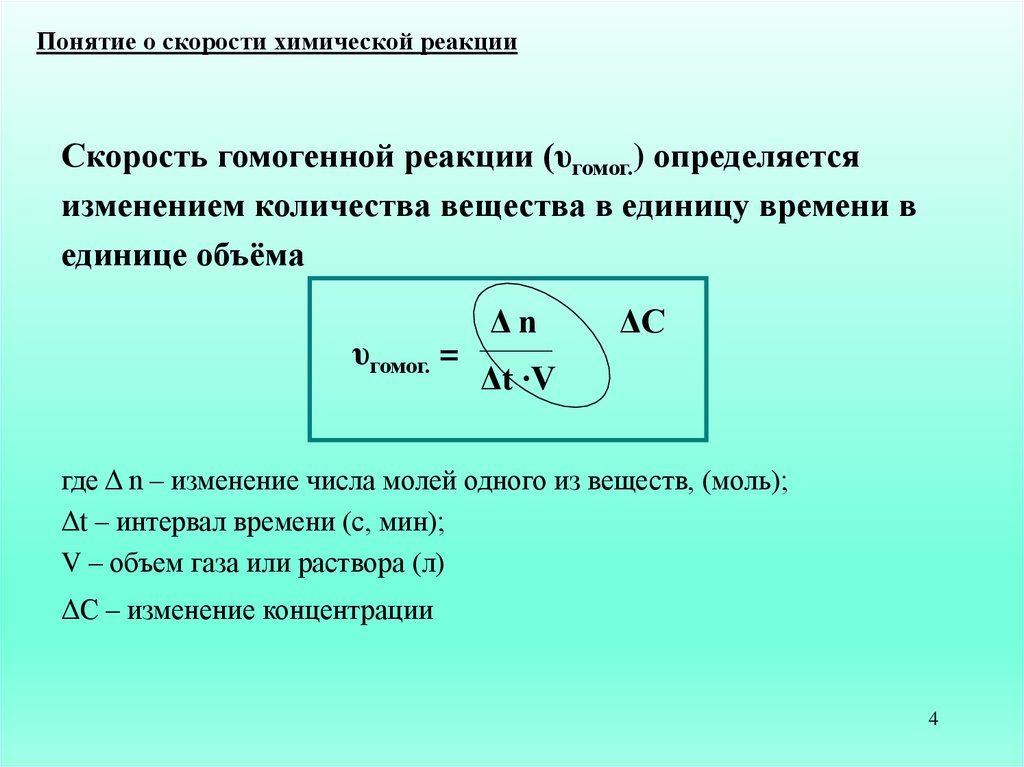
Понятие о скорости химической реакцииСкорость гомогенной реакции (υгомог.) определяется
изменением количества вещества в единицу времени в
единице объёма
υгомог. =
Δn
ΔC
Δt ∙V
где Δ n – изменение числа молей одного из веществ, (моль);
Δt – интервал времени (с, мин);
V – объем газа или раствора (л)
ΔC – изменение концентрации
4
5.
Понятие о скорости химической реакцииСкорость гомогенной реакции (υгомог.) определяется
изменением концентрации одного из веществ в
единицу времени
υгомог. =
ΔC
моль
[
]
Δt
л·с
5
6.
Понятие о скорости химической реакцииСкорость гетерогенной реакции (υгетер.) определяется
изменением количества вещества в единицу времени на
единице поверхности соприкосновения веществ
υгетер. = Δ n
Δt ∙ S
где Δ n – изменение количества вещества (реагента или продукта), (моль);
Δt – интервал времени (с, мин);
S – площадь поверхности соприкосновения веществ (см2, м2)
6
7.
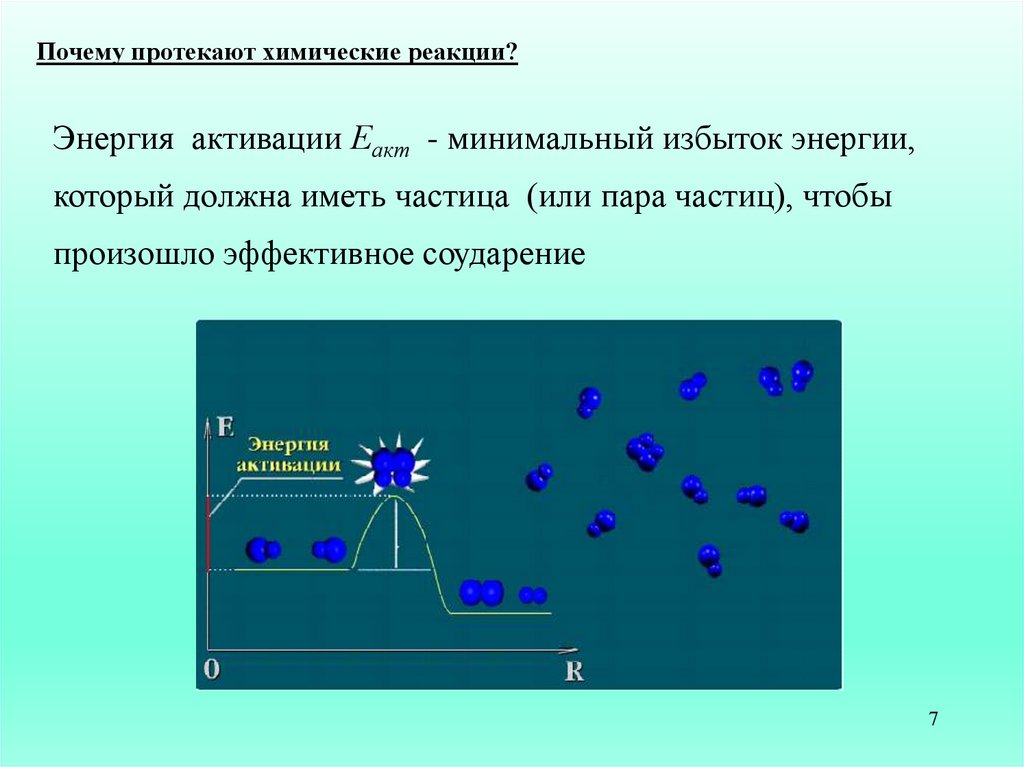
Почему протекают химические реакции?Энергия активации Еакт - минимальный избыток энергии,
который должна иметь частица (или пара частиц), чтобы
произошло эффективное соударение
7
8.
2. Факторы, влияющие на скорость химической реакции1. Природа реагирующих веществ: их состав, строение
=> энергия активации
▪ чем меньше Еакт, тем больше υ;
8
9.
Если Еакт < 40 кДж/моль,скорость такой реакции очень большая.
FeCl3 + K4[Fe(CN)6] →
Fe4[Fe(CN)6]3
берлинская лазурь
9
10.
Если Еакт > 120 кДж/моль,скорость таких реакций очень мала.
4Fe + 2Н2О + ЗО2 = 2(Fe2O3 • Н2О)
ржавление железа
10
11.
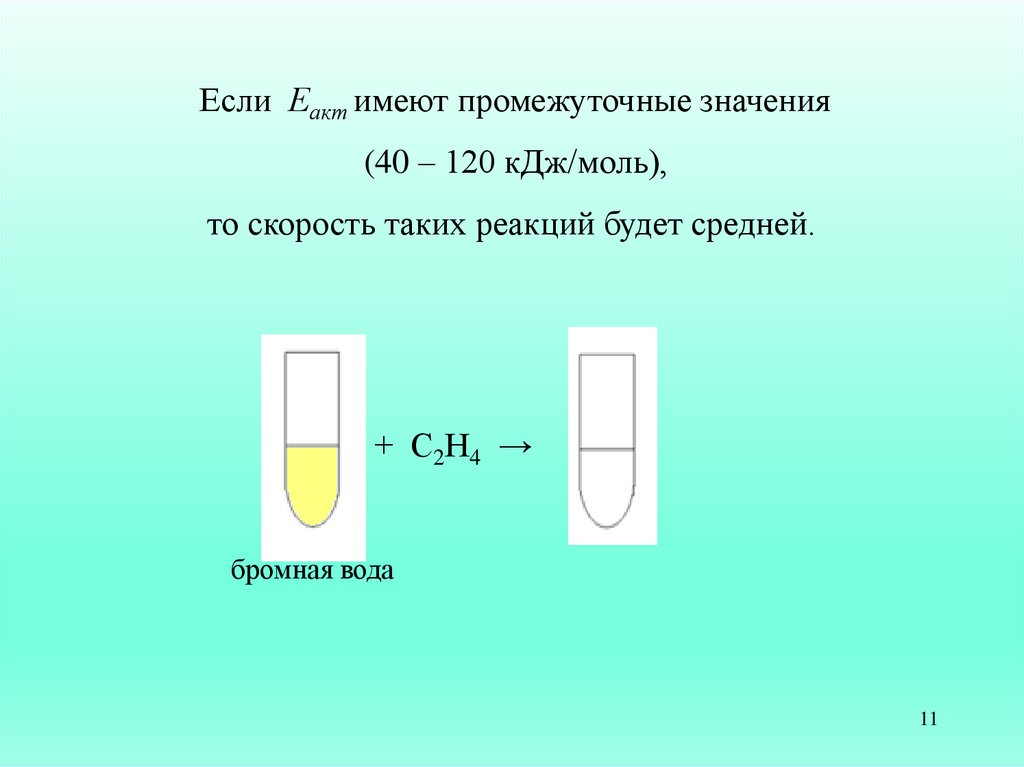
Если Еакт имеют промежуточные значения(40 – 120 кДж/моль),
то скорость таких реакций будет средней.
+ С2Н4 →
бромная вода
11
12.
Факторы, влияющие на скорость химической реакцииЯкоб Хендрик Вант-Гофф
1852 – 1911г.г.
Голландский химик. Один из основателей
физической химии и стереохимии.
Предложил классификацию химических реакций.
Установил, что повышении температуры на каждые
100С скорость реакции увеличивается в 2-4 раза.
12
13.
Факторы, влияющие на скорость химической реакции2. Температура: при ↑ t на каждые 100 С, υ ↑ в 2-4 раза
(правило Вант-Гоффа)
При ↑ t, ↑ количество активных частиц (с Еакт) и их
активных соударений.
13
14.
Факторы, влияющие на скорость химической реакцииЗадача 1.
Скорость некоторой реакции при 00С равна 1 моль/л ∙ ч,
температурный коэффициент реакции равен 3. Какой будет скорость
данной реакции при 300С?
Дано:
υt1 = 1 моль/л ∙ ч
γ =3
t1 = 00С
t2 = 300С
Решение:
υt2 = υt1 ∙ γ Δt/10
υt2 =1∙330 - 0/10 = 33 = 27 моль/л∙ч
Найти: υt2
Ответ: Скорость данной реакции при 300С будет равна 27 моль/л∙ч
14
15.
Факторы, влияющие на скорость химической реакции3. Концентрация: чем ↑ С, тем чаще происходят соударения
и υ ↑.
Закон действующих масс (з. д. м.):
Скорость химической реакции (υх.р.) прямо пропорциональна
произведению концентраций реагирующих веществ,
взятых в степенях их коэффициентов в уравнении реакции
15
16.
Факторы, влияющие на скорость химической реакцииДля реакции mA + nB = C по закону действующих масс:
υ = k ∙ СAm ∙ CBn
где k – константа скорости;
С – концентрация (моль/л)
* З.д.м. не учитывает концентрации реагирующих веществ, находящихся в
твердом состоянии, т.к. они реагируют на поверхности и их концентрации обычно
остаются постоянными.
16
17.
Факторы, влияющие на скорость химической реакцииЗадача 2.
Реакция идет по уравнению А +2В → С. Во сколько раз и как
изменится скорость реакции, при увеличении концентрации
вещества В в 3 раза?
Дано:
Решение:
↑СВ в 3 раза
А +2В → С
По з.д.м. υ = k ∙ СA ∙ CB2
Пусть СА = а, СВ = в, тогда
υ1 = k ∙ а ∙ в2
υ2 = k ∙ а ∙ 3в2
υ1/ υ2 = а ∙ в2 / а ∙ 9в2 = 1/9
Найти:
Как измениться
υх.р.
Ответ: скорость реакции увеличится в 9 раз
17
18.
Факторы, влияющие на скорость химической реакцииДля газообразных веществ υ х.р. зависит от давления
(что аналогично изменению концентрации
реагирующих веществ)
Чем ↑ р, тем ↑ υ
18
19.
Факторы, влияющие на скорость химической реакции4. Катализаторы – вещества, которые изменяют
механизм реакции, уменьшают Еакт => υ ↑.
▪ Катализаторы остаются неизменными по окончании
реакции
▪ Ферменты – биологические катализаторы, по природе
белки
▪ Ингибиторы – вещества, которые ↓ υ
19
20.
Факторы, влияющие на скорость химической реакции5. Для гетерогенных реакций υ зависит:
▪ от состояния поверхности соприкосновения реагирующих
веществ.
1. Железный гвоздь
2. Железные опилки
р-р H2SO4
H2SO4 + Fe = FeSO4 + Cu
20
21.
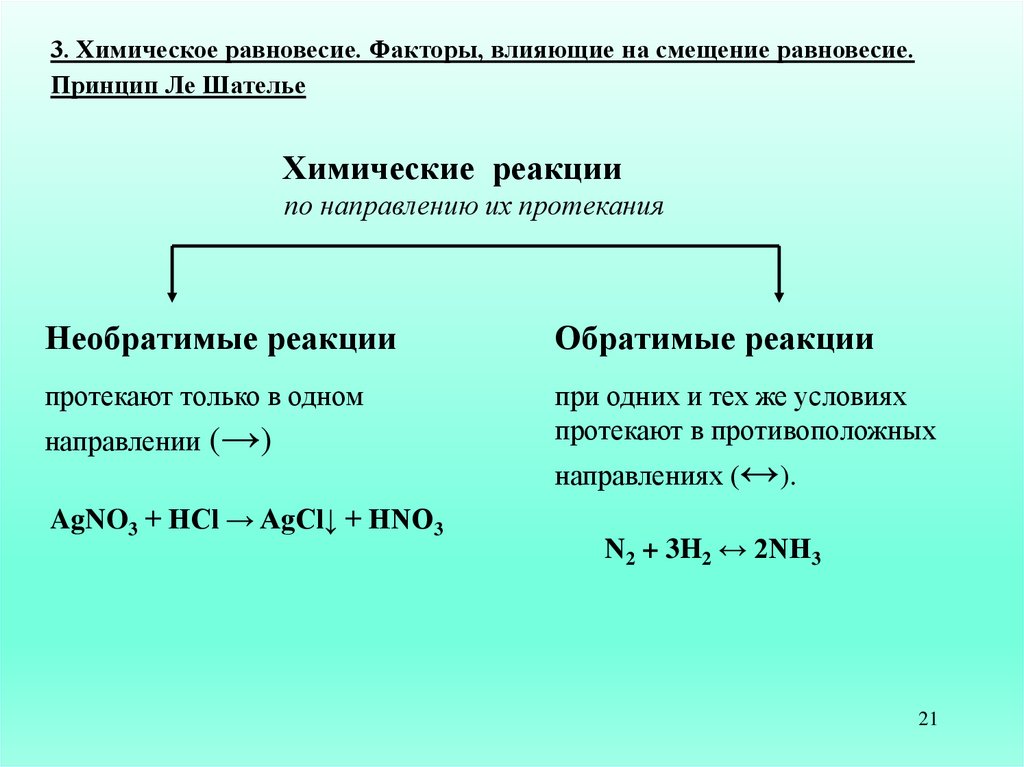
3. Химическое равновесие. Факторы, влияющие на смещение равновесие.Принцип Ле Шателье
Химические реакции
по направлению их протекания
Необратимые реакции
Обратимые реакции
протекают только в одном
при одних и тех же условиях
протекают в противоположных
направлении (→)
AgNO3 + HCl → AgCl↓ + HNO3
направлениях (↔).
N2 + 3H2 ↔ 2NH3
21
22.
Химическое равновесиеСостояние обратимой реакции, при котором
→
υ =←
υ
пр.
обр.
называется химическим равновесием
22
23.
Химическое равновесие. Факторы, влияющие на смещение равновесие.Принцип Ле Шателье
Анри Луи Ле Шателье
1850 – 1936 г.г.
Французский физико-химик.
Член парижской Академии наук,
почетный член Петербургской академии наук
(с 1913г.) и Академии наук СССР (с 1926г.)
В 1884 г. сформулировал принцип смещения
равновесия, названный его именем.
23
24.
Химическое равновесие. Факторы, влияющие на смещение равновесие.Принцип Ле Шателье
Принцип Ле Шателье (1844 г.)
Если на систему, находящуюся в состоянии равновесия,
оказать внешнее воздействие (изменить t, р, С), то
равновесие сместится в ту сторону, которая ослабит это
воздействие
24
25.
Влияние концентрации на смещение химического равновесияРавновесие смещается
при ↑ Среаг.в-в.
→
при ↑ Спрод .р-ции ←
25
26.
Влияние давления на смещение химического равновесияРавновесие смещается
при ↑ p (для газов) - в сторону уменьшения объема (V)
газообразных веществ
при ↓ р – в сторону увеличения V;
* если реакция протекает без изменения числа молекул газообразных
веществ, то давление не влияет на равновесие в данной системе
26
27.
Влияние температуры на смещение химического равновесияРавновесие смещается
при ↑ t – в сторону эндотермической реакции (- Q)
при ↓ t – в сторону экзотермической реакции (+ Q)
27
28.
Химическое равновесие. Факторы, влияющие на смещение равновесие.Принцип Ле Шателье
Задача 3.
Как надо изменить концентрации веществ, давление и температуру
гомогенной системы PCl5 ↔ PCl3 + Cl2 – Q , чтобы сместить равновесие
в сторону разложения PCl5 (→)
1V
Решение:
→
PCl5(тв.) ↔ PCl3(тв.) + Cl2(газ) – Q
↑ С реаг. в-в (PCl5)
↓ С прод. р-ции (PCl3) и С (Cl2)
↓ р (реакция идет с увеличением V)
↑ t (реакция эндотермическая – Q )
28
29.
Задача 4.Как сместиться химическое равновесие реакции
2СО + О2 ↔ 2СО2 + Q при
а) повышении температуры;
б) повышении давлении
Ответ:
2V
1V
2V
Q - 2СО + О2 ↔ 2СО2 + Q
а) ←
б) →
29
























 chemistry
chemistry








