Similar presentations:
Катализ және термодинамика химиялы қ жүйенің потенциалдық энергиясының өзгеруі. 2 лекция
1.
2 ЛЕКЦИЯКАТАЛИЗ ЖӘНЕ ТЕРМОДИНАМИКА ХИМИЯЛЫ Қ ЖҮЙЕНІҢ
ПОТЕНЦИАЛДЫҚ ЭНЕРГИЯСЫНЫҢ ӨЗГЕРУІ
2.
Катализатор термодинамикалық мүмкін болатын үдерістердің жылдамдығын арттырады, бірақхимиялық термодинамиканың заңдарына сəйкес берілген жағдайда жүруі мүмкін емес реакцияны
иницирлей алмайды
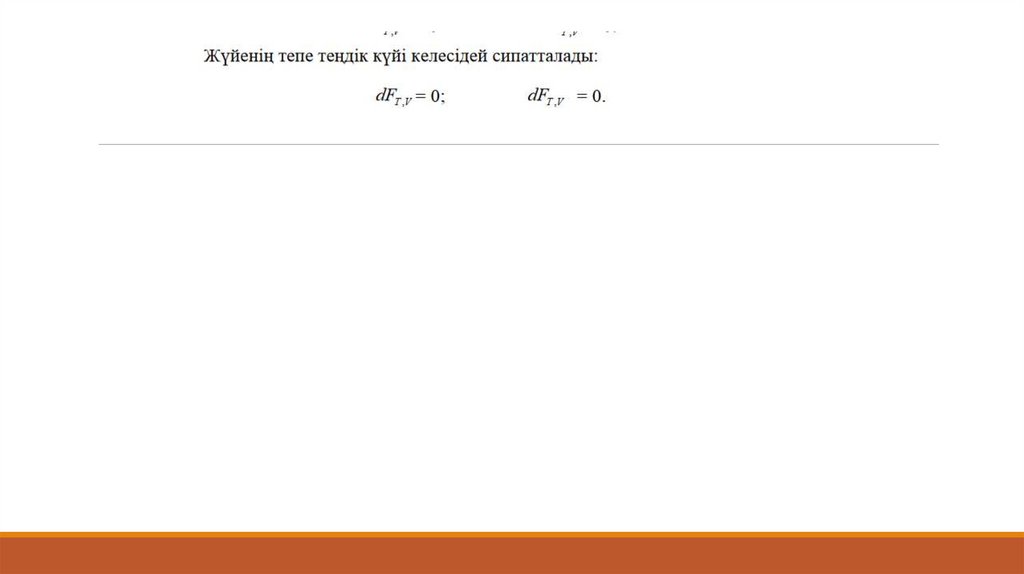
Катализатор химиялық тепе-теңдіктің термодинамикалық жағдайын өзгертпейді
GT0 0
Катализатор термодинамикалық рекацияның қабілетін өзгертпеу, жүйенің кинетикалық
реакцияның мүмкіндігін ұлғайтады.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
GT0 RT ln K aКатализатордың рөлі – тепе-теңдік күйге жету жылдамдығын өзгерту болып табылады.
Катализатор оның дəрежесін тездетеді, яғни катализатор түра жəне теріс реакцияны
бірақлыпты ретте жылдамдығын көбейтеді.
k
K
k
13.
Белсендікатализатордың
өлшемі
(немесе
оның
каталитикалық
белсенділігі),
жəне
каталитикалық
реакцияның
қабелетінің
өлшемі,
катализатордың
қатысуымен
болатын
реакцияның
жылдамдық
константасы болып табылады.
Катализаторсыз
рекацияны
жəне
қатысуымен болатын рекацияны мына теңдеумен көруге болады
A — шығыс реагент; Р — реакцияның өнімі; К — катализатор.
оның
14.
15.
Кейбір химиялық реакциялар активтендіру энергиясы өте жоғары болғандықтанкатализаторсыз мүлдем жүрмейді. Жоғары энергетикалық тосқауылдан өту үшін
температураны арттыру арқылы молекулалардың кинетикалық энергиясын жоғарылатуға
болар еді.
Бірақ көптеген қайтымды экзотермиялық реакциялар үшін температураны арттыру тепетеңдікті кері бағытқа ығыстыруға əкеледі де, термодинамикалық мүмкін емес реакцияға
айналдырады.
Мұндай жағдайда катализатор қолдану қажет. Катализатор реакцияның активтендіру
энергиясын төмендетеді жəне оны төмен температурада жүзеге асыруға мүмкіндік береді
16.
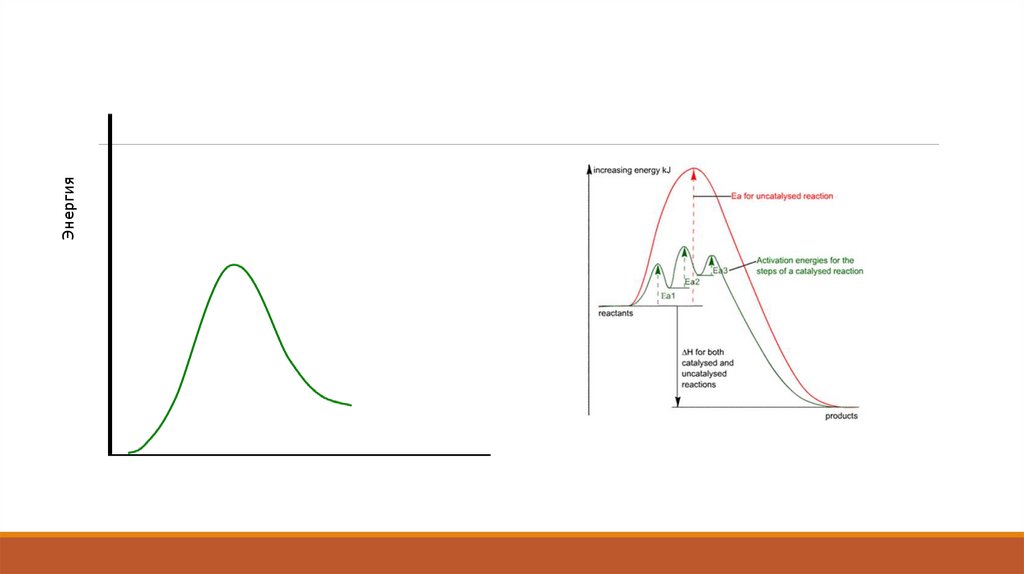
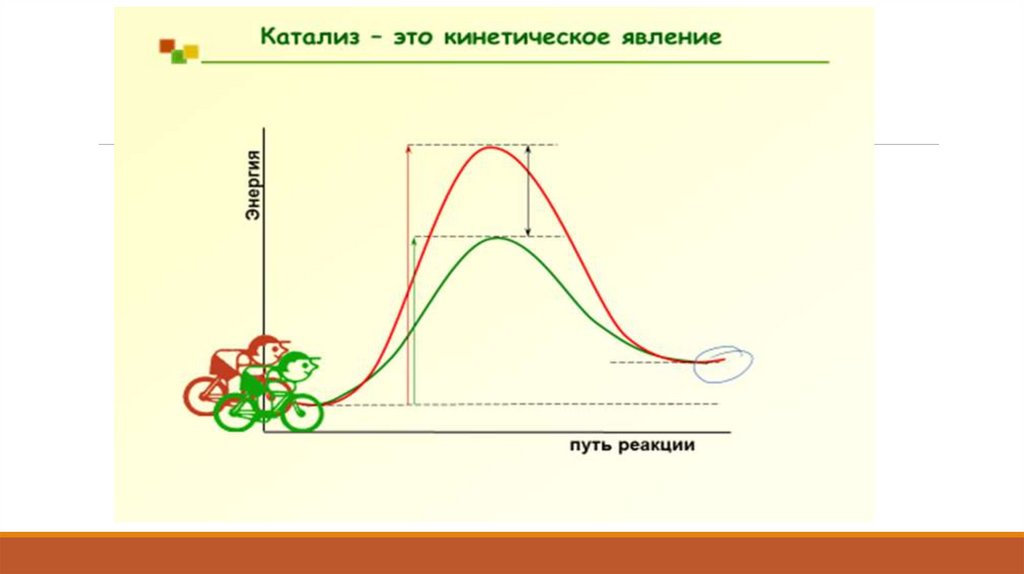
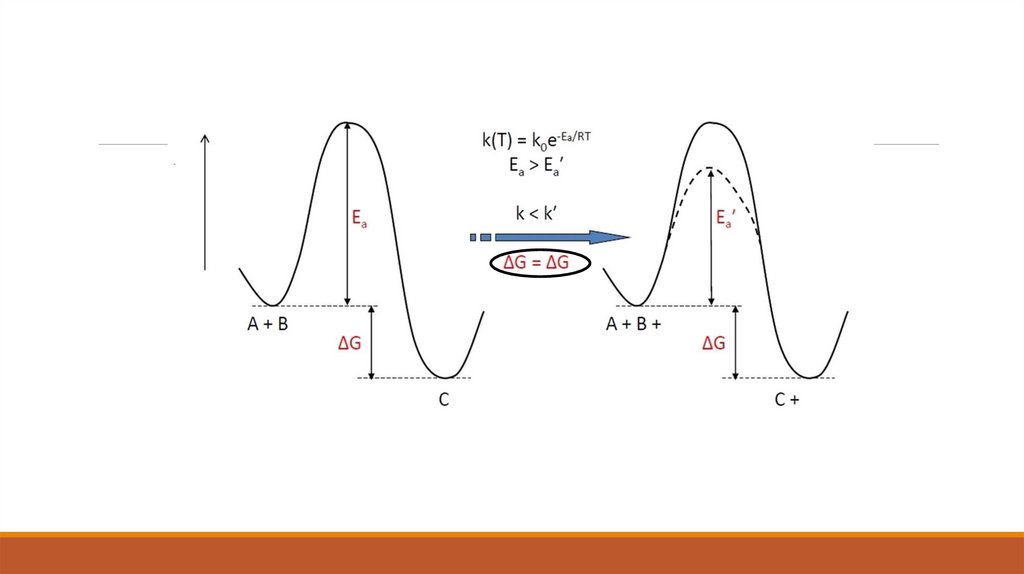
Канализатордың әсерінен химиялық реакция жылдамдығының өзгеруі белсенді энергияныңтөмендеуімен түсіндіріледі, яғни патенттік кедергіні төмендетеді.
Сонымен қатар, экспоненциалдық фактордың алды Аррениус теңдеуінде өзгеруі мүмкін. Белсенді
энергияның өзгеруі кей-кезде катализатордың белсенді мінездемесінде қолданылады.
17.
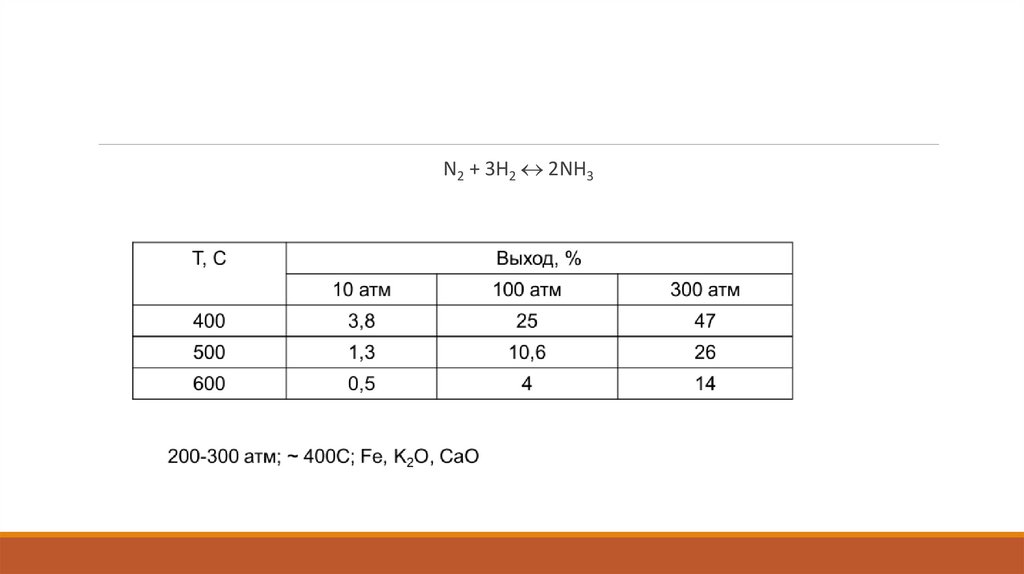
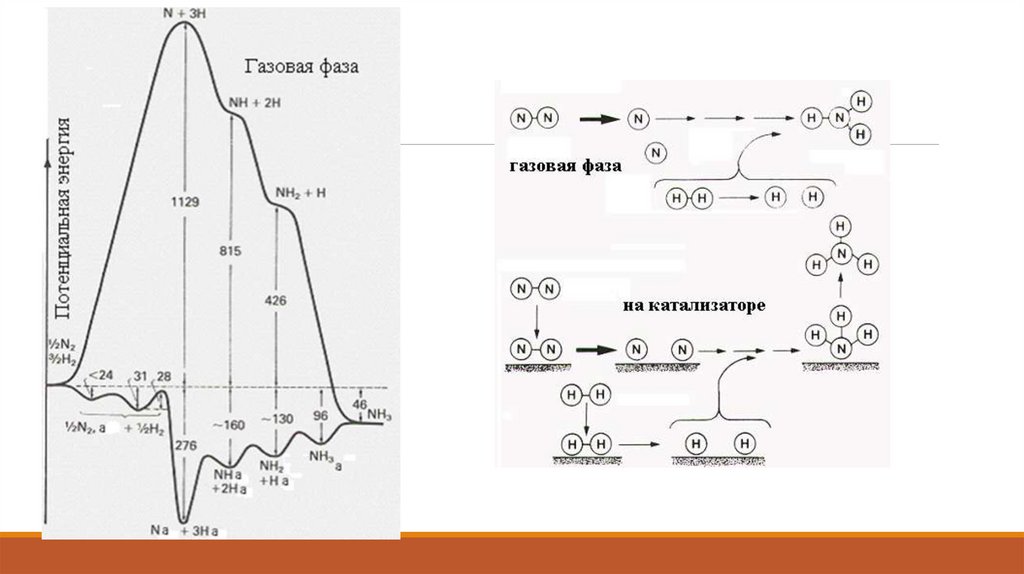
N2 + 3H2 2NH318.
Энергия19.
20.
21.
22.
Гомогенді катализде де, гетерогенді катализде де катализа- тордың жылдамдыққа әсері оныңбастапқы заттармен аралық ак- тивті комплекс түзуімен түсіндіріледі.
Аралық активті комплекс екі түрлі механизммен түзіледі:
а) біріккен
б) дараланған механизмдер.
23.
а) Біріккен механизмде: катализаторсыз реакция болса, катализатор (К) қатысында:24.
25.
26.
Катализатор әсері немен байланысты?Реакция соңында катализатор таза күйінде бөлініп шығуына қарағанда, ол реакцияға түсетін
заттармен химиялық әрекетке түспейтін сияқты, бірақ катализатор бастапқы заттармен
реакцияның аралық сатыларында әрекеттесіп аралық активті комплекс түзеді.
Соған байланысты, реакцияның энергиясының өзгерісі (энергиялық профилі) күрделілеу болады
(әсіресе гетерогенді катализде)





















 chemistry
chemistry








