Similar presentations:
Периодический закон и система химических элементов Д.И. Менделеева
1. Периодический закон и система химических элементов Д.И.Менделеева
2. 1 марта 1869 г. считается датой открытия одного из важнейших законов химии – периодического закона. Д.И. Менделеев
сформулировал открытый имзакон следующим образом:
свойства элементов, а также
формы и свойства их соединений
находятся в периодической
зависимости от величины
атомной массы элемента.
3. Лишь в начале XX в., после открытия строения атома, был объяснен физический смысл периодического закона и появилась его
современная формулировка:свойства элементов, а также
формы и свойства их соединений
находятся в периодической
зависимости от величины заряда
ядер их атомов.
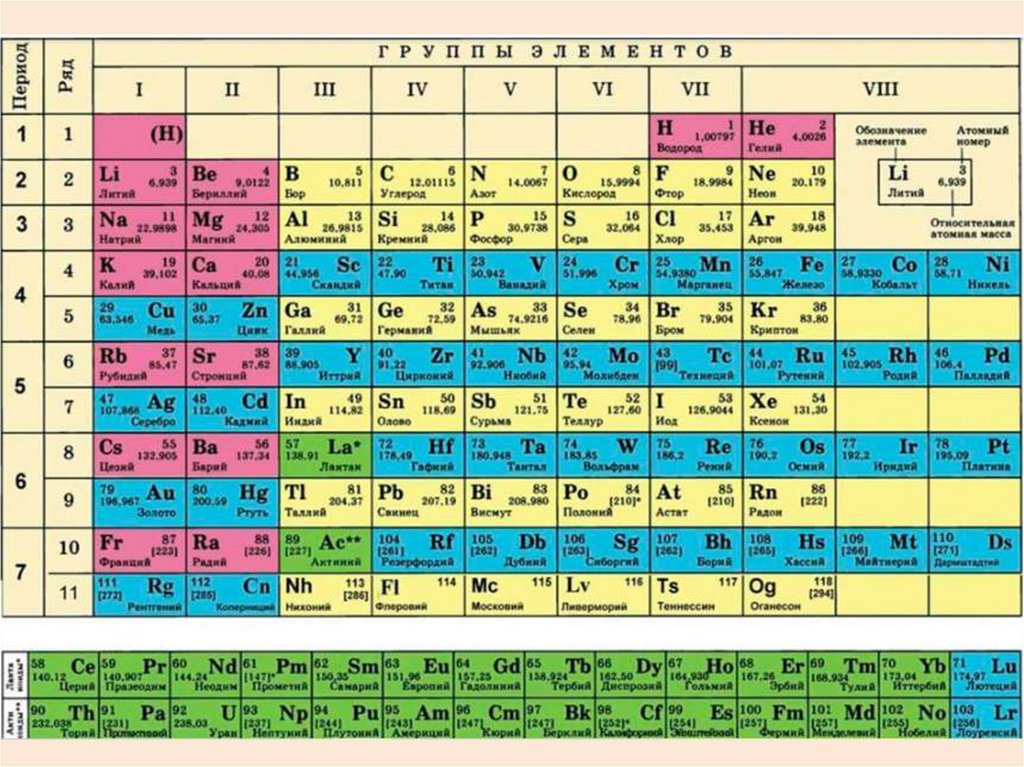
4. Графическим отражением периодического закона является периодическая система химических элементов Менделеева. Основными
структурными элементамикоторой являются – период, группа и
подгруппа.
5.
6. Периодом с номером n называют горизонтальный ряд элементов, в котором по мере увеличения заряда ядра атомов происходит
заполнениеэлектронами внешнего энергетического
уровня от ns- до np-подуровня.
7.
8. Группа – вертикальный ряд элементов разных периодов с одинаковым числом валентных электронов. Подгруппа – это вертикальный ряд
элементовс одинаковой электронной конфигурацией
валентных электронов.
Различают главные подгруппы (А),
объединяющие s- или p-элементы, и
побочные подгруппы (В), содержащие dэлементы.
9. Семейства химических элементов
• Элементы, в атомах которых происходит заполнениеэлектронами s-подуровня внешнего энергетического
уровня, называются s-элементами.
Это первые 2 элемента каждого периода, составляющие главные
подгруппы I и II групп.
• Элементы, в атомах которых электронами
заполняется pподуровень внешнего энергетического уровня,
называются p-элементами.
Это последние 6 элементов каждого периода (за исключением I и VII),
составляющие главные подгруппы III-VIII групп.
10. Семейства химических элементов
• Элементы, в которых заполняется d подуровеньвторого снаружи уровня, называются d-элементами.
Это элементы вставных декад IV, V, VI периодов.
• Элементы, в которых заполняется f-подуровень
третьего снаружи уровня, называются f-элементами.
К f-элементам относятся лантаноиды и актиноиды.
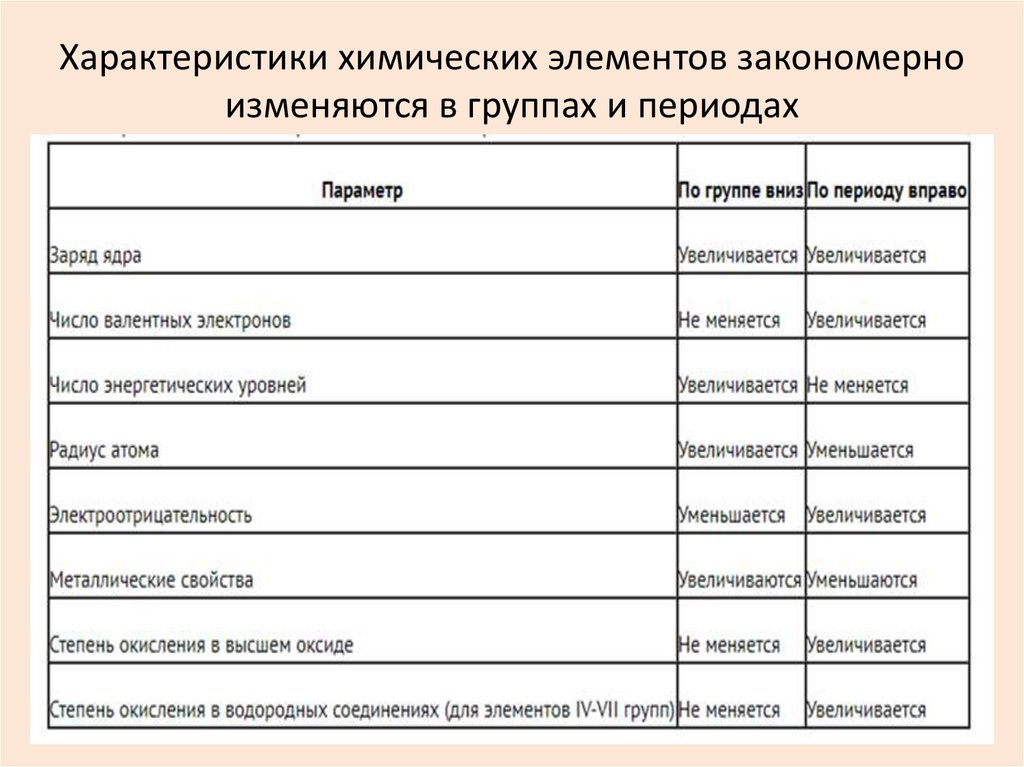
11. Металличность – это способность атомов химического элемента отдавать электроны. Неметалличность – это способность атомов
Металличность – это способность атомов химическогоэлемента отдавать электроны.
Неметалличность – это способность атомов химического
элемента присоединять электроны.
Универсальной характеристикой металличности и
неметалличности является электроотрицательность (ЭО)
элемента.
ЭО элемента характеризует способность его атомов притягивать к
себе электроны, которые участвуют в образовании химических
связей с другими атомами в молекуле.
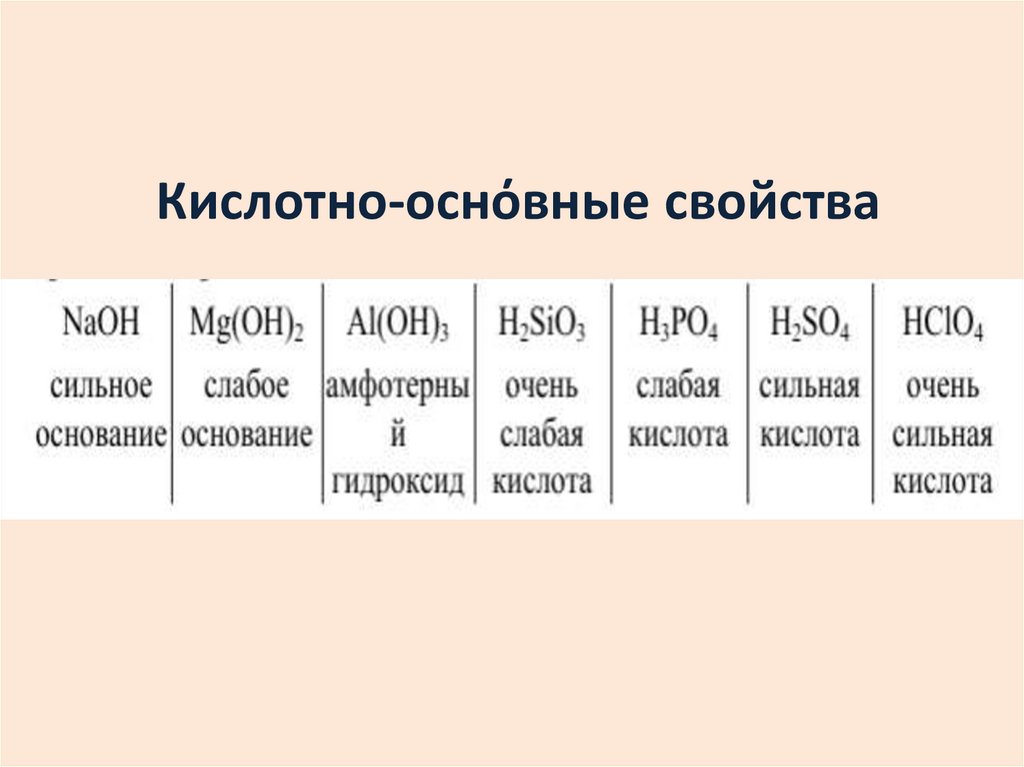
Чем больше металличность, тем меньше ЭО.
Чем больше неметалличность, тем больше ЭО.











 chemistry
chemistry








