Similar presentations:
Распределение электронов в атомах
1.
Тема :Распределение электронов в атомах
2.
• Атом – сложная частица, которая состоитиз атомного ядра и электронной
оболочки (совокупности всех электронов в
атоме)
• Электрон заряжен отрицательно, его
условный заряд -1.
• Число электронов равно числу протонов,
а заряд ядра атома соответствует
порядковому номеру элемента.
3.
• Каждый электрон имеет свою траекториюдвижения и запас энергии
• Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его
труднее вырвать из электронной оболочки
• По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
4.
• Электроны, движущиеся вблизи ядра, как бызагораживают (экранируют) ядро от других
электронов, которые притягиваются к ядру
слабее и движутся на большем удалении от
него. Так образуются электронные слои в
электронной оболочке атома.
• Каждый электронный слой состоит из
электронов с близкими значениями энергии;
поэтому электронные слои называют еще
энергетическими уровнями.
5.
На каждом энергетическом уровнерасполагается определенное
ограниченное количество электронов.
На одном энергетическом уровне
располагаются электроны,
обладающие близкими значениями
энергий.
Важно!!! Количество энергетических
уровней соответствует номеру
периода.
6.
Просмотр видеоролика• https://www.youtube.com/watch?v=U6Oq4EB
ghIM
7.
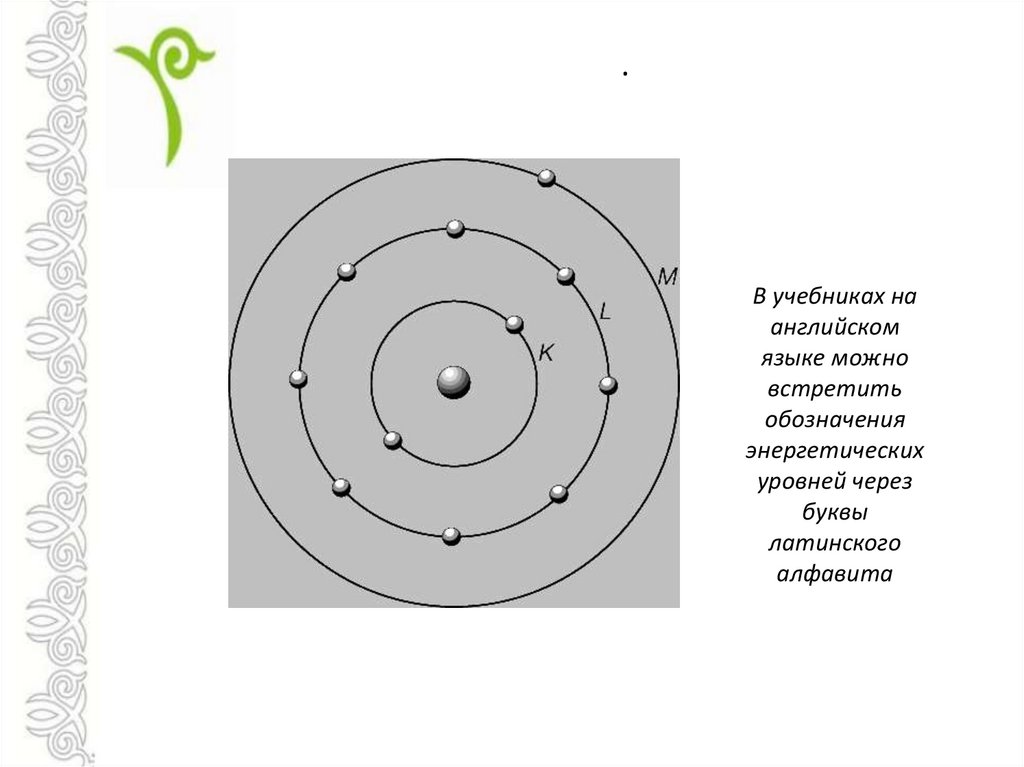
.В учебниках на
английском
языке можно
встретить
обозначения
энергетических
уровней через
буквы
латинского
алфавита
8.
Задание :Определите количество
энергетических уровней у
следующих элементов
He,Be, Si, Ca
9.
Ответы :He – 1, т.к. расположен в 1 периоде
Периодической системы
Be – 2, т.к.расположен во 2 периоде
Si – 3, т.к.находится в 3 периоде
Ca – 4, т.к.расположен в 4 периоде
10.
Необходимо запомнить!• Номер периода = число энергетических
уровней
• Максимальное количество электронов
на одном энергетическом уровне
рассчитывается по формуле
N = 2n2
где n – номер энергетического уровня
• Номер группы = число электронов на
последнем энергетическом уровне
11.
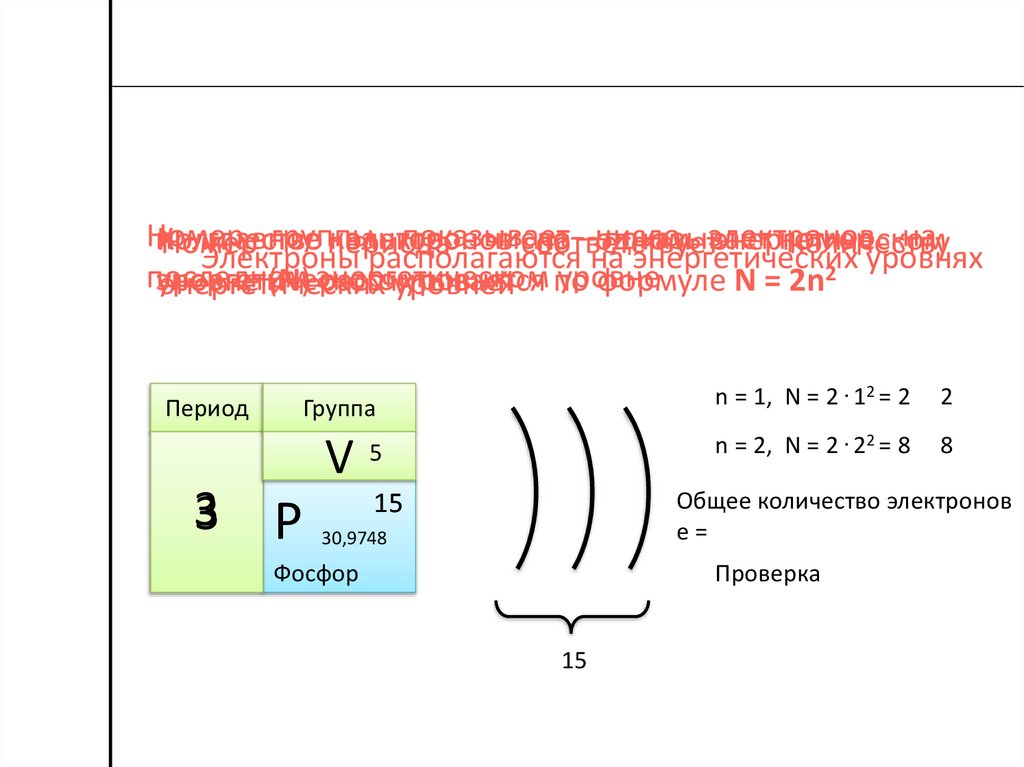
Номергруппы
показывает
число
электронов
на
n
– главное
квантовое
число
показывает
номер
Количество
электронов
на –одном
энергетическом
Номер
периода
соответствует
количеству
Электроны располагаются на энергетических
уровнях
2
последнем
энергетическом
уровне
энергетического
уровня по формуле N = 2n
уровне
(N) рассчитывается
энергетических
уровней
Период
Группа
V
3
Р
5
n = 1, N = 2 . 12 = 2
2
n = 2, N = 2 . 22 = 8
8
Общее количество электронов
е=
15
30,9748
Проверка
Фосфор
15
12.
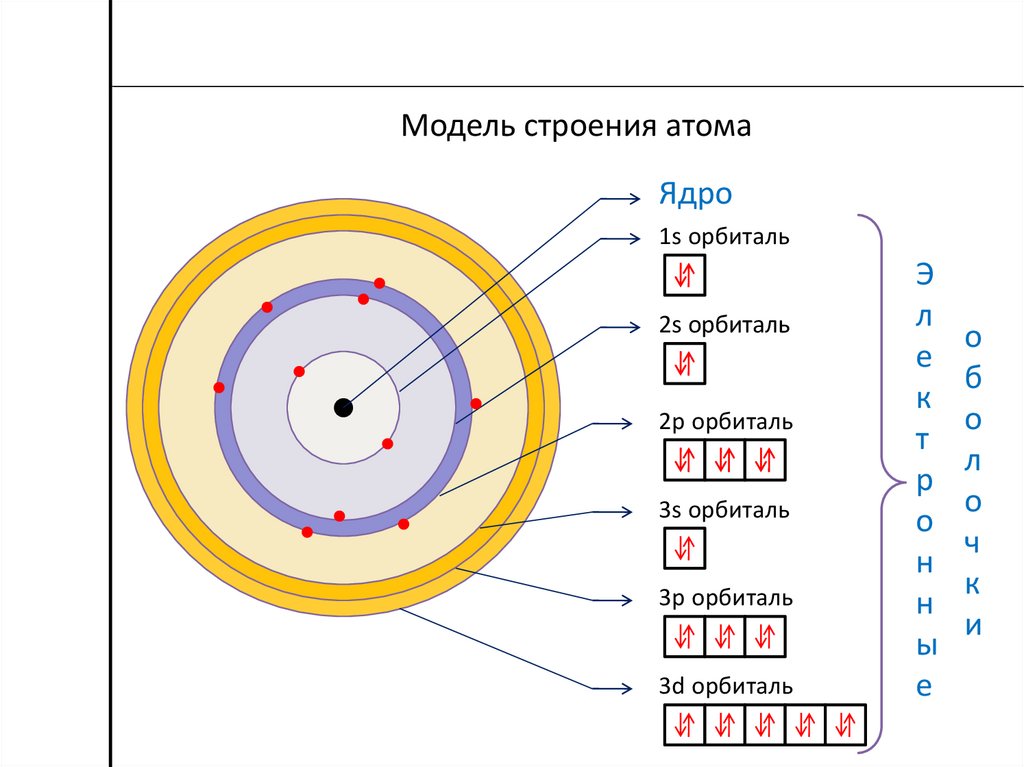
Модель строения атомаЯдро
1s орбиталь
2s орбиталь
2p орбиталь
3s орбиталь
3p орбиталь
3d орбиталь
Э
л
е
к
т
р
о
н
н
ы
е
о
б
о
л
о
ч
к
и
13.
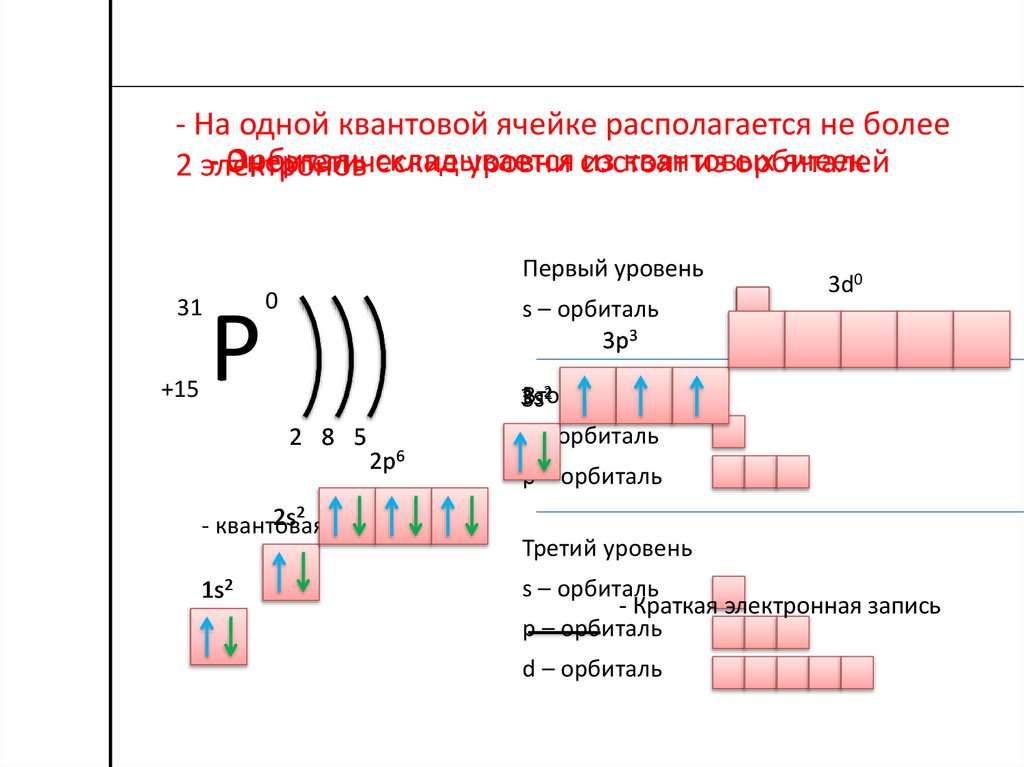
- На одной квантовой ячейке располагается не более- Орбиталь
складывается
из квантовых
ячеек
Энергетические
уровни состоят
из орбиталей
2 электронов
Первый уровень
31
+15
Р
0
s – орбиталь
3p3
2 8 5
2p6
2s2 ячейка
- квантовая
1s2
3d0
2
Второй
уровень
3s
s – орбиталь
p – орбиталь
Третий уровень
s – орбиталь
- Краткая электронная запись
p – орбиталь
d – орбиталь
14.
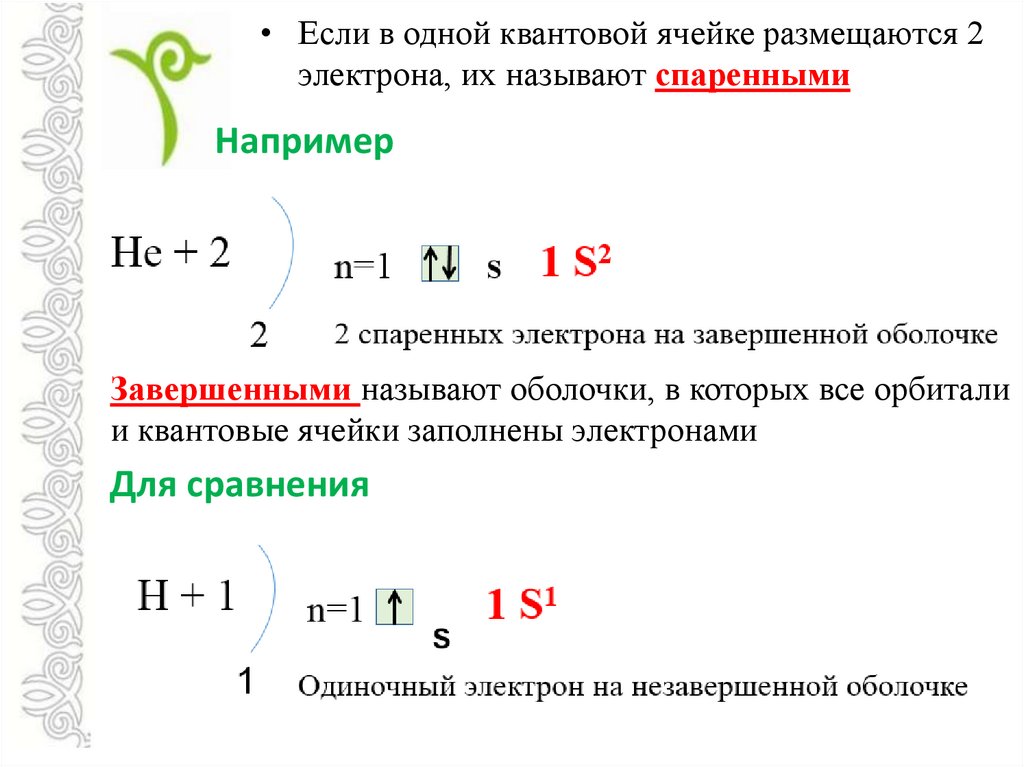
• Если в одной квантовой ячейке размещаются 2электрона, их называют спаренными
Например
Завершенными называют оболочки, в которых все орбитали
и квантовые ячейки заполнены электронами
Для сравнения
15.
Алгоритм составленияэлектронных формул
Записываем знак химического элемента и заряд
ядра его атома – он равен порядковому номеру
элемента.
Определяем количество энергетических уровней
(оно равно номеру периода) и количество
электронов на каждом уровне.
Составляем электронную формулу, учитывая
порядок заполнения каждого уровня – сначала sэлектроны, затем – р-электроны: номер уровня,
вид орбитали и количество электронов на ней.
16.
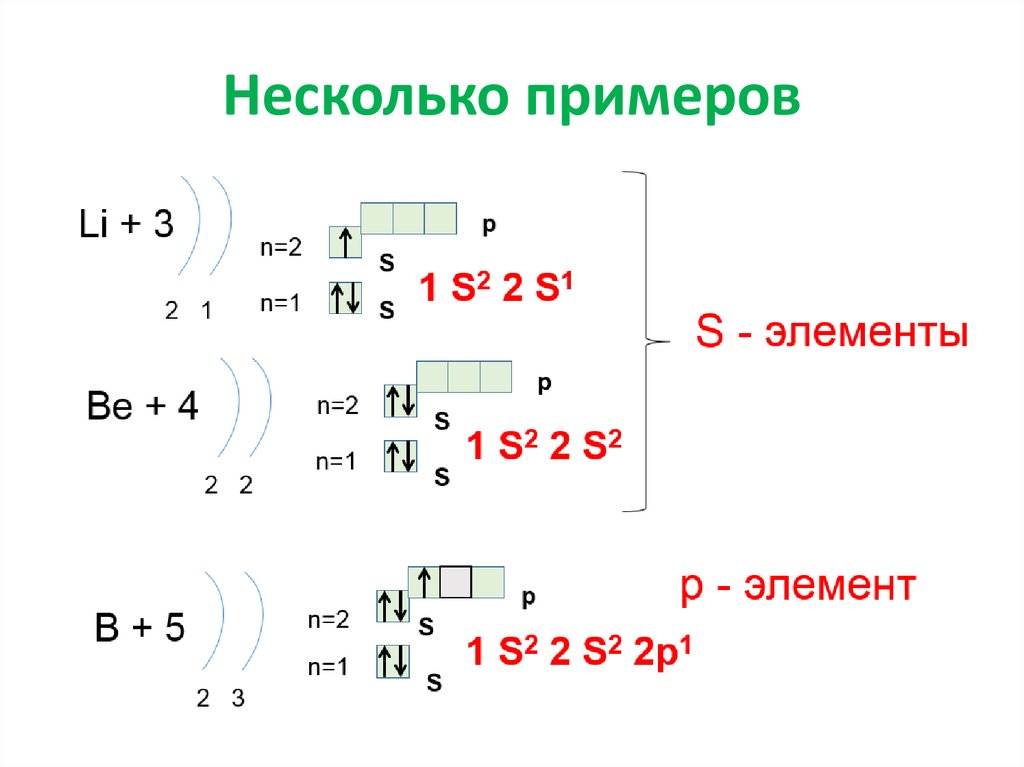
Несколько примеров17.
Задание :• Напишите графические и
электронные формулы
распределения электронов в атомах
для натрия и серы
18.
Домашнее задание• Напишите графические и
электронные формулы
распределения электронов в атоме
10 первых элементов ПСХЭ












 chemistry
chemistry








