Similar presentations:
Электролитическая диссоциация. Электролиты и неэлектролиты
1. Электролитическая диссоциация
1. Электролиты и неэлектролиты2. Механизм диссоциации
электролитов.
3. Уравнения диссоциации
электролитов
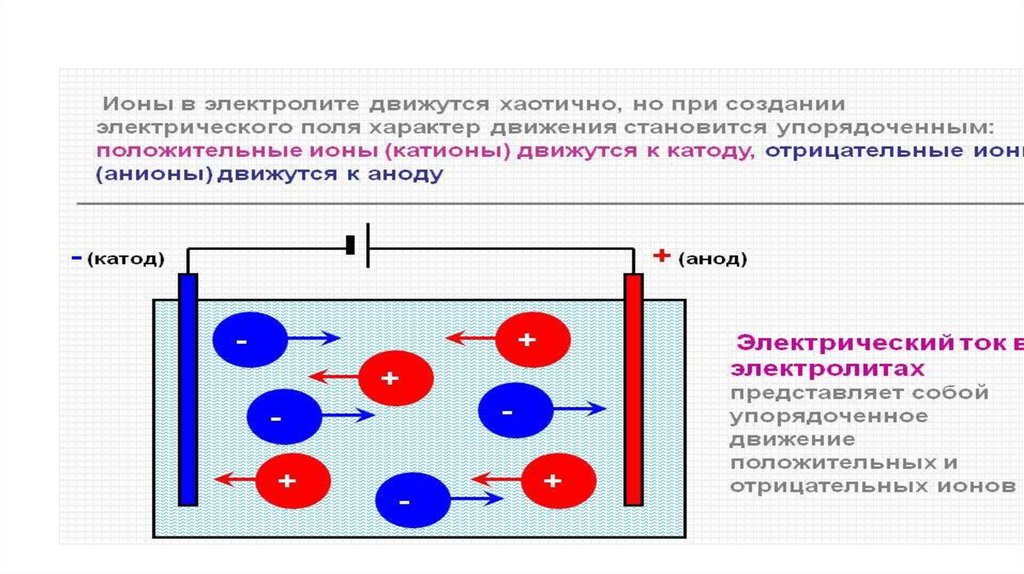
2. Электрический ток
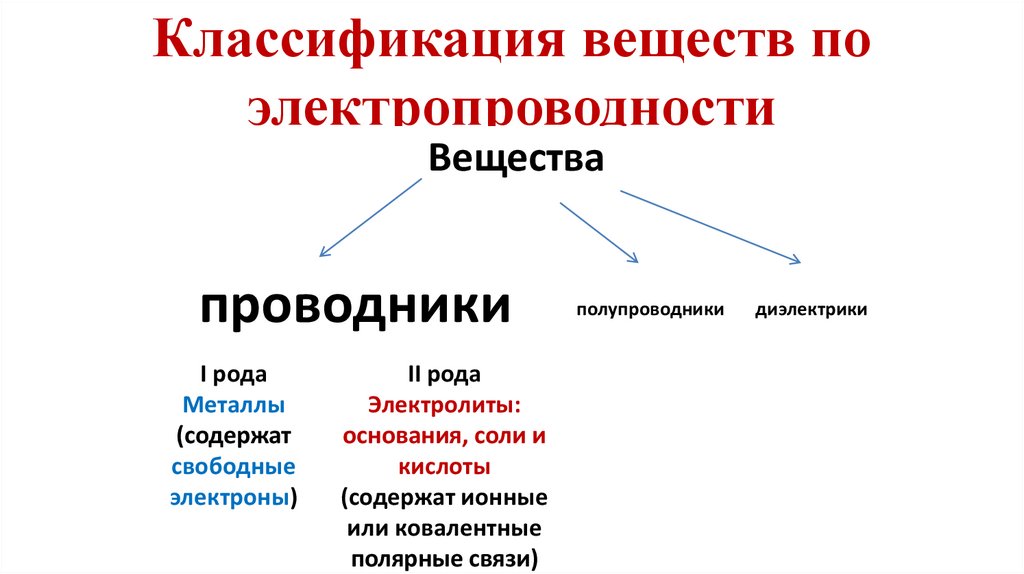
- Направленное движение заряженных частиц3. Классификация веществ по электропроводности
Веществапроводники
I рода
Металлы
(содержат
свободные
электроны)
II рода
Электролиты:
основания, соли и
кислоты
(содержат ионные
или ковалентные
полярные связи)
полупроводники
диэлектрики
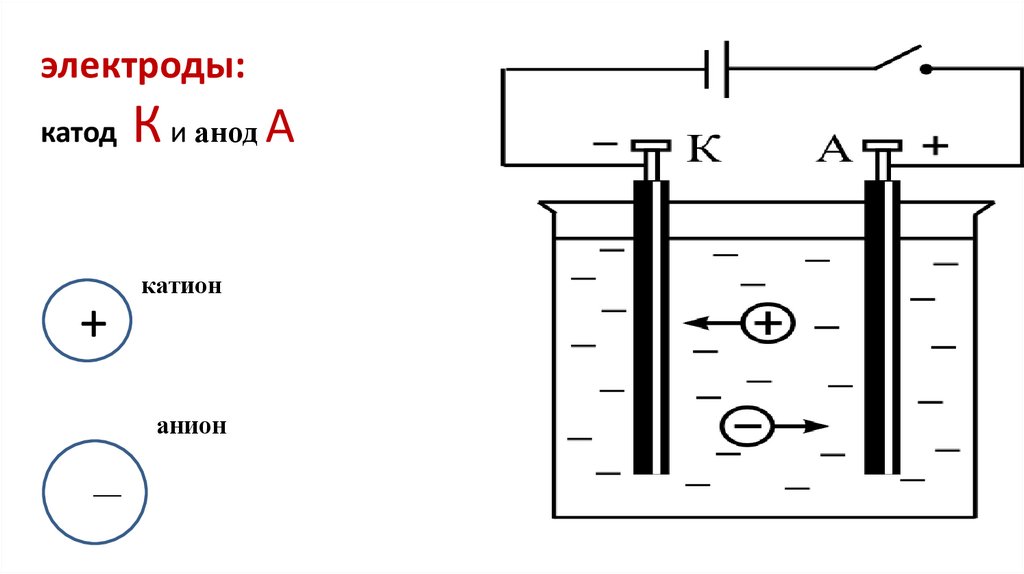
4. электроды: катод К и анод А
электроды:катод
+
+
К и анод А
катион
анион
5. Исследование веществ на электропроводность
6.
Электролитическая диссоциация процесс распада вещества на ионыпри растворении в воде или
расплавлении
Электролиты – вещества, водные растворы и
расплавы которых проводят электрический ток
7.
8. Вывод
Вещества с ионной кристаллическойрешеткой и с молекулярной
полярной в водном растворе проводят
электрический ток
9. Классификация проводников
1. Проводники первого рода – металлы,носителями электричества в металлах
являются свободные электроны
2. Проводники второго рода –
электролиты, носителями
электричества в электролитах являются
гидратированные ионы
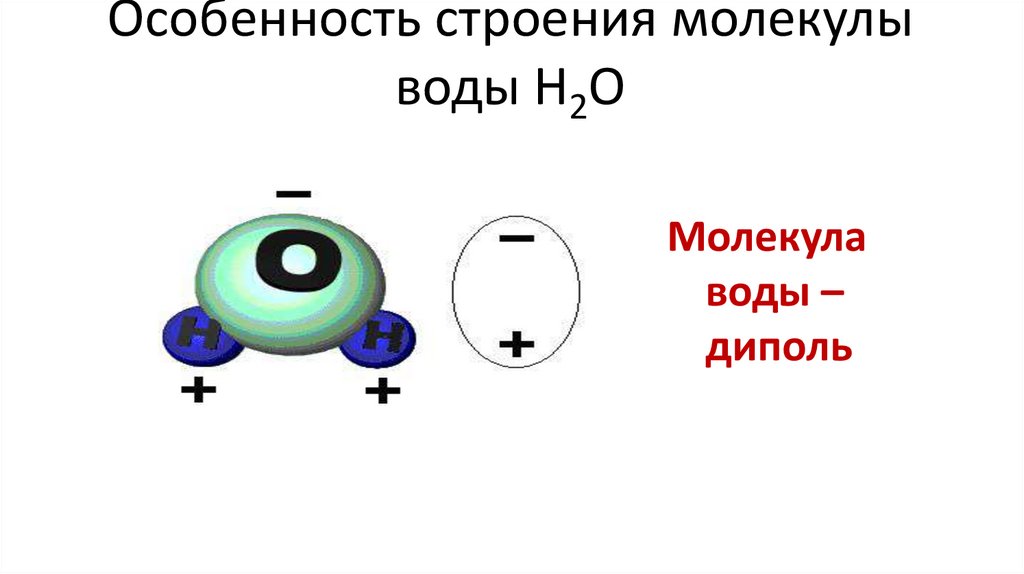
10. Особенность строения молекулы воды Н2О
Молекулаводы –
диполь
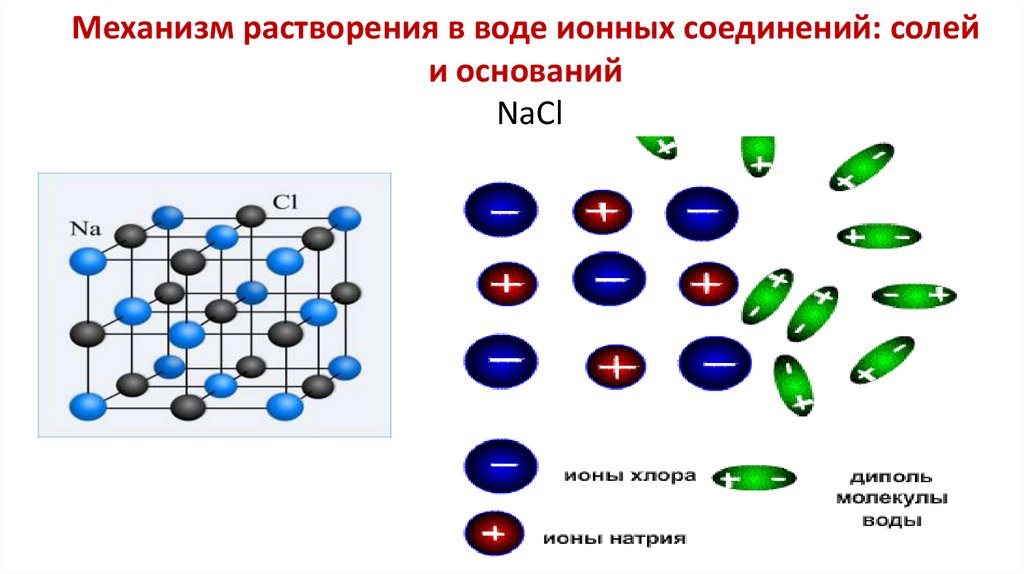
11. Механизм растворения в воде ионных соединений: солей и оснований NaCl
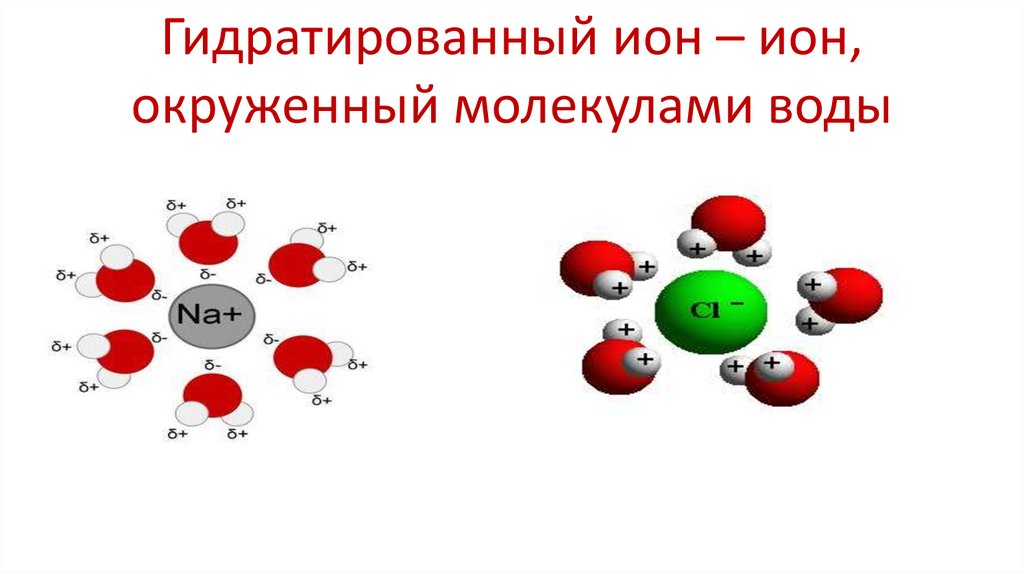
12. Гидратированный ион – ион, окруженный молекулами воды
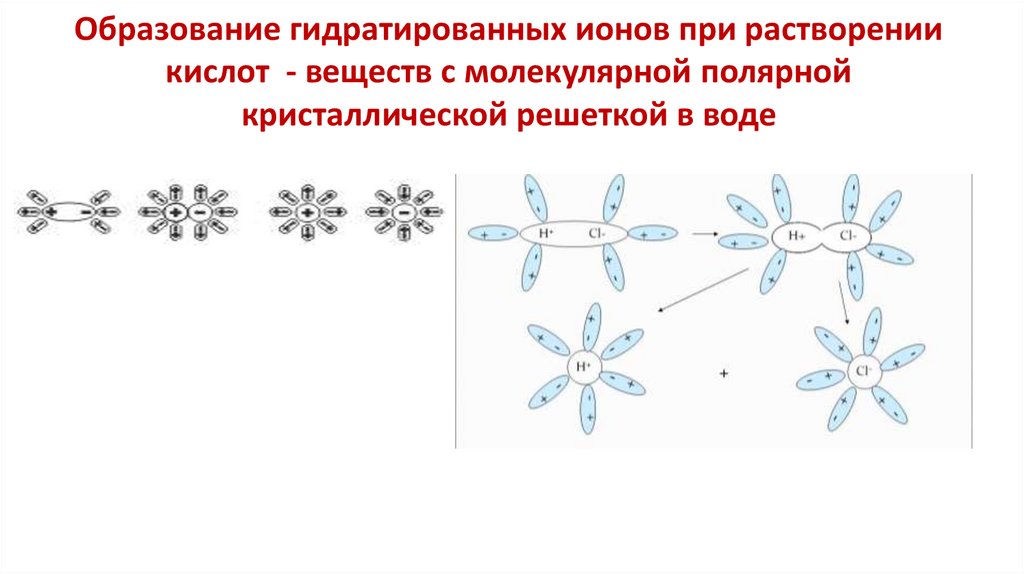
13. Образование гидратированных ионов при растворении кислот - веществ с молекулярной полярной кристаллической решеткой в воде
14.
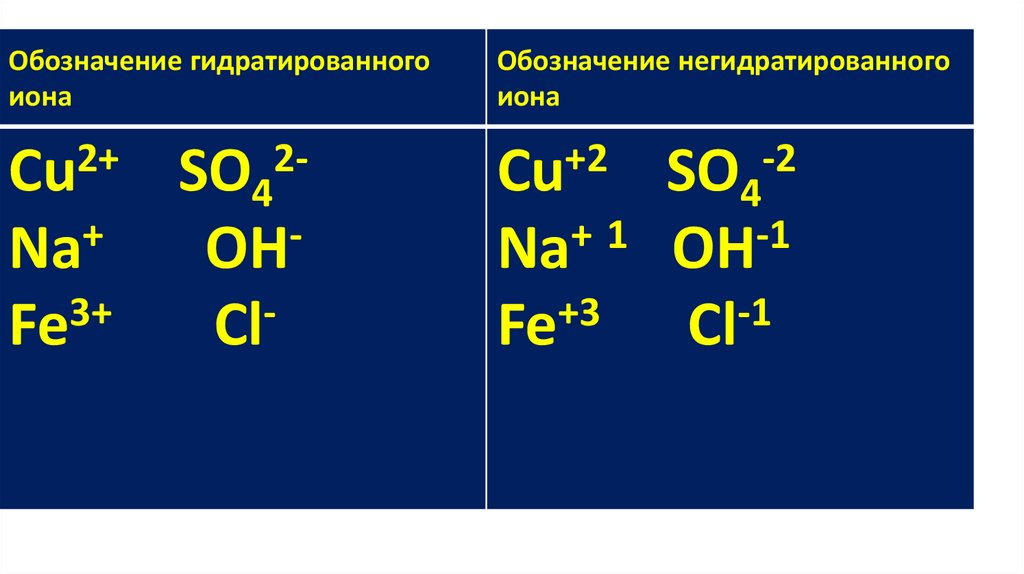
Обозначение гидратированногоиона
Обозначение негидратированного
иона
Cu2+ SO42+
Na
OH
Fe3+
Cl-
Cu+2 SO4-2
+
1
-1
Na
OH
Fe+3 Сl-1
15.
16. Основные положения «Теории электролитической диссоциации» (ТЭД)
Основные положения «Теории электролитической диссоциации» (ТЭД)• При растворении в воде (или расплавлении)
электролиты распадаются на положительно и
отрицательно заряженные гидратированные
ионы (подвергаются электролитической
диссоциации).
• Электролитическая диссоциация - процесс
обратимый (обратная реакция называется
ассоциацией).
17. Уравнения диссоциации электролитов
Kt – катион (+ ион)An – анион (- ион)
Ktm Ann– обозначение электролита
Ktm Ann+zH2O→mKt ∙xH2O+ nAn∙yH2O
z=x + y
18. Общепринятая запись уравнения диссоциации электролитов
n+mKtmAnn→mKt + nAn
19. Уравнения диссоциации
CuCl2 →Cu2++ 2ClAl2 (SO4)3→2Al3+ +3SO42NaOH→Na+ + OH2+Ba(OH)2→Ba + 2OH
+
3H3PO4→3H + PO4









 chemistry
chemistry








