Similar presentations:
Электроны в атоме
1.
2.
хлорид натриянатрий
гидроксид натрия
Почему вещества,
содержащие атомы одного и
того же элемента, так
сильно различаются по
свойствам?
3.
ЧастицаЗаряд
Массовое
число
Электрон е–
-1
0
Протон р+
+1
1
Нейтрон n0
0
1
Электрон проявляет свойства и частицы и волны,
т.е. имеет двойственную природу:
• обладает массой и зарядом
• нельзя точно определить положение электрона
в пространстве в данный момент времени
4.
Электронное облакоАтомная орбиталь – часть электронного облака,
где электрон проводит наибольшее время
5.
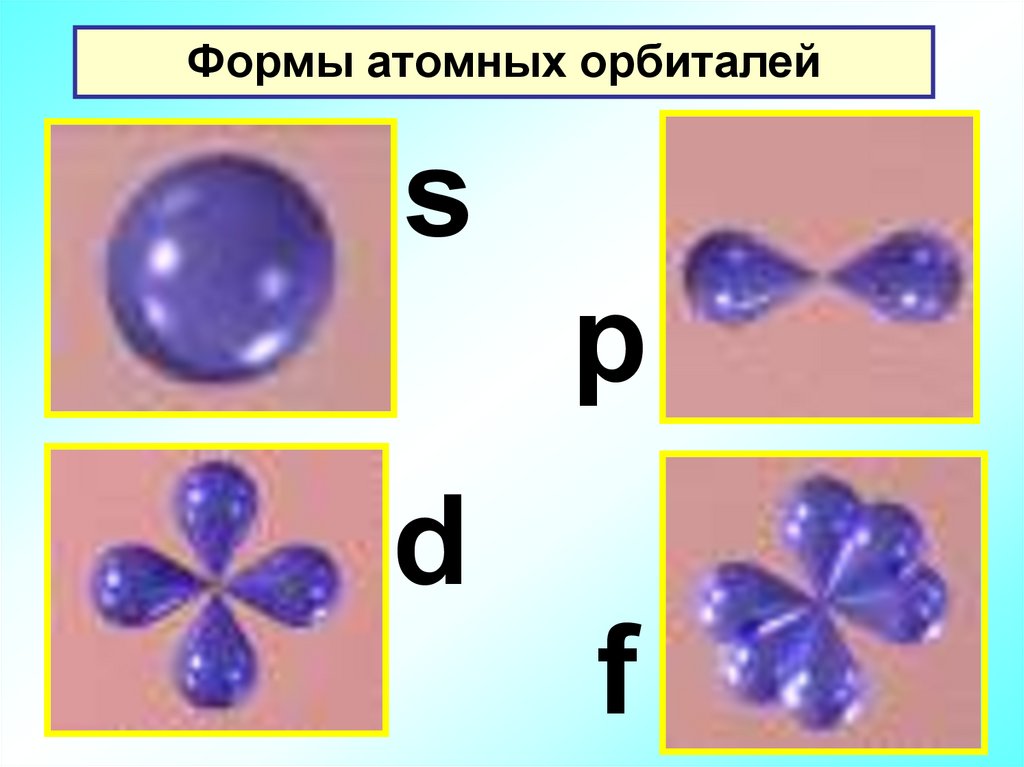
Формы атомных орбиталейs
p
d
f
6.
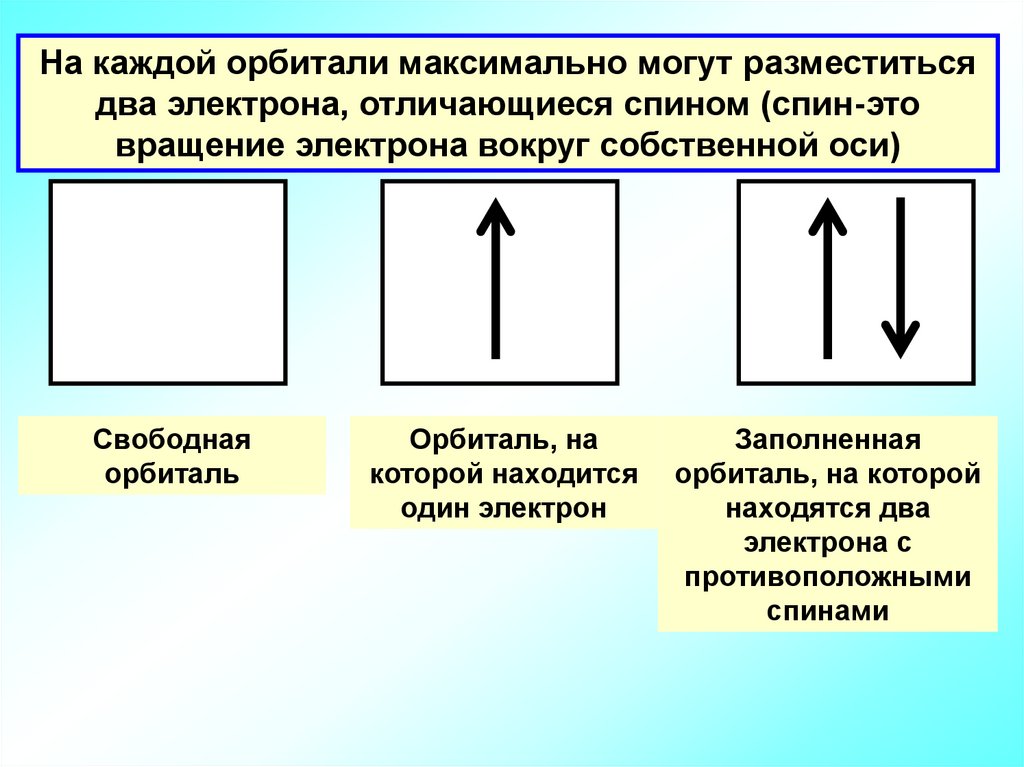
На каждой орбитали максимально могут разместитьсядва электрона, отличающиеся спином (спин-это
вращение электрона вокруг собственной оси)
Свободная
орбиталь
Орбиталь, на
которой находится
один электрон
Заполненная
орбиталь, на которой
находятся два
электрона с
противоположными
спинами
7.
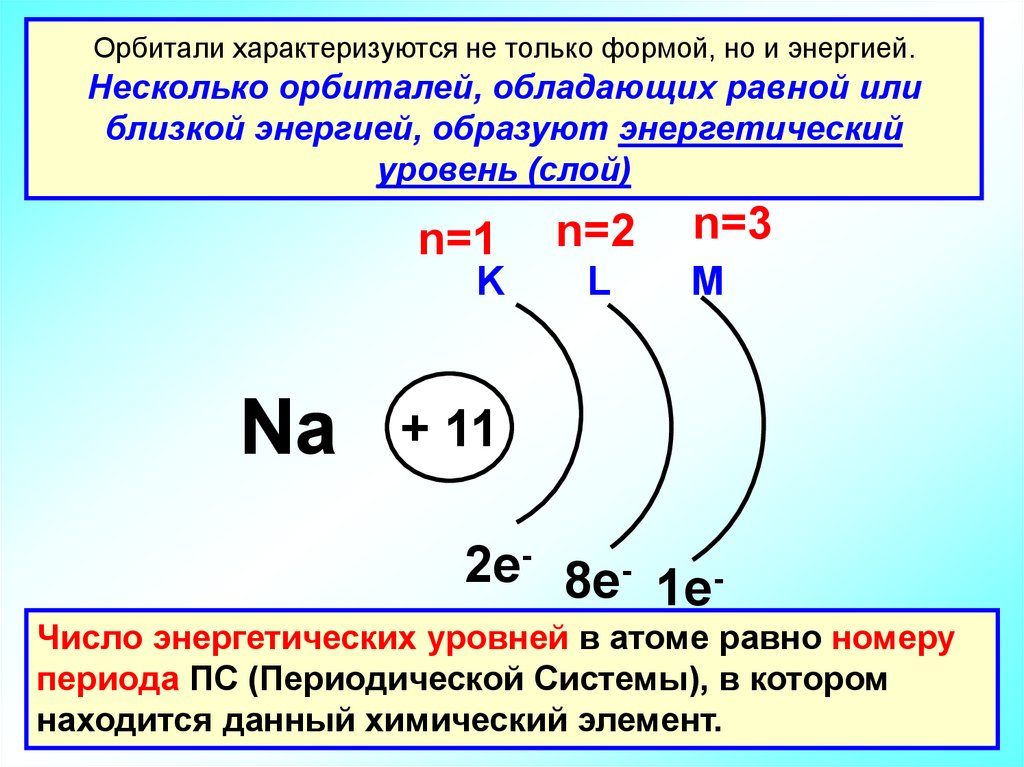
Орбитали характеризуются не только формой, но и энергией.Несколько орбиталей, обладающих равной или
близкой энергией, образуют энергетический
уровень (слой)
Na
n=1
n=2
n=3
K
L
M
+ 11
2e- 8e- 1eЧисло энергетических уровней в атоме равно номеру
периода ПС (Периодической Системы), в котором
находится данный химический элемент.
8.
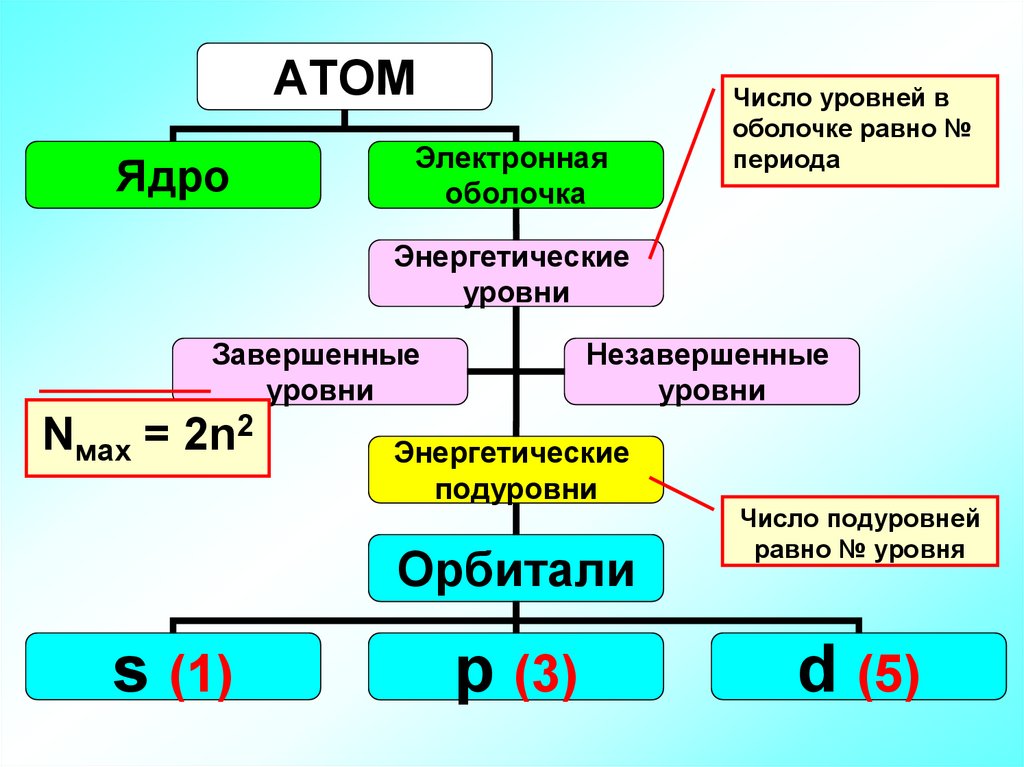
АТОМЯдро
Электронная
оболочка
Число уровней в
оболочке равно №
периода
Энергетические
уровни
Завершенные
Незавершенные
уровни
уровни
Nмах = 2n2
Энергетические
подуровни
Орбитали
s (1)
p (3)
Число подуровней
равно № уровня
d (5)
9.
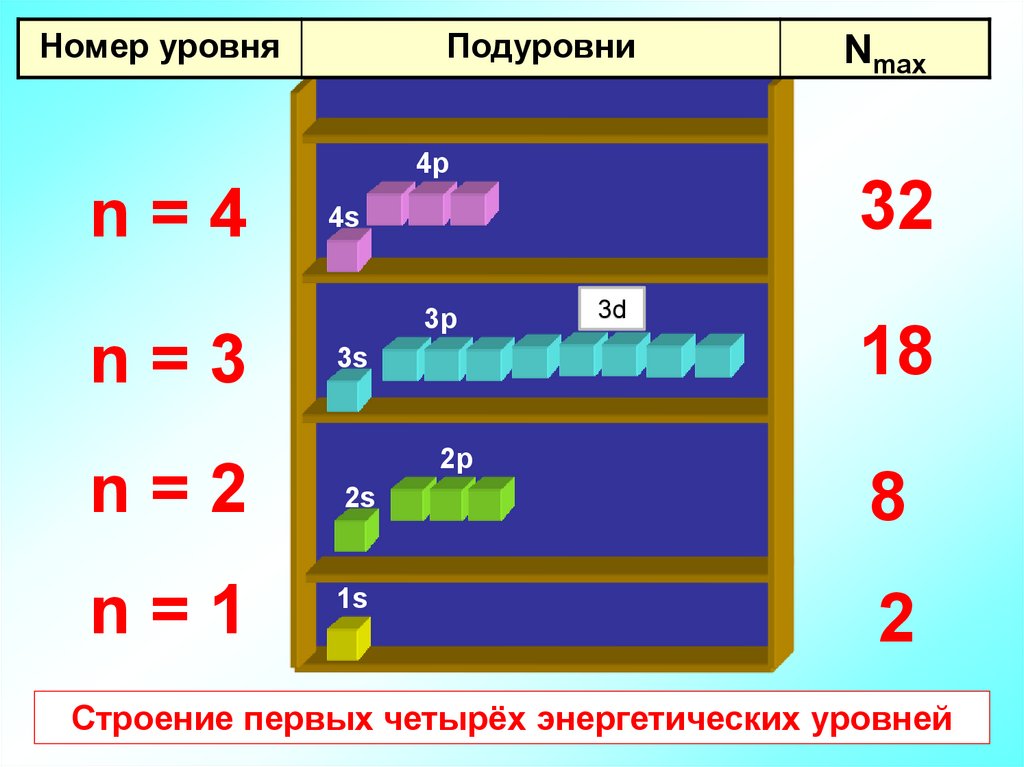
Номер уровняПодуровни
Nmax
4p
n=4
n=3
n=2
n=1
32
4s
3p
3s
2p
2s
1s
3d
18
8
2
Строение первых четырёх энергетических уровней
10.
Электроннаяконфигурация атома –
перечень энергетических
уровней с указанием числа
электронов на орбиталях.
11.
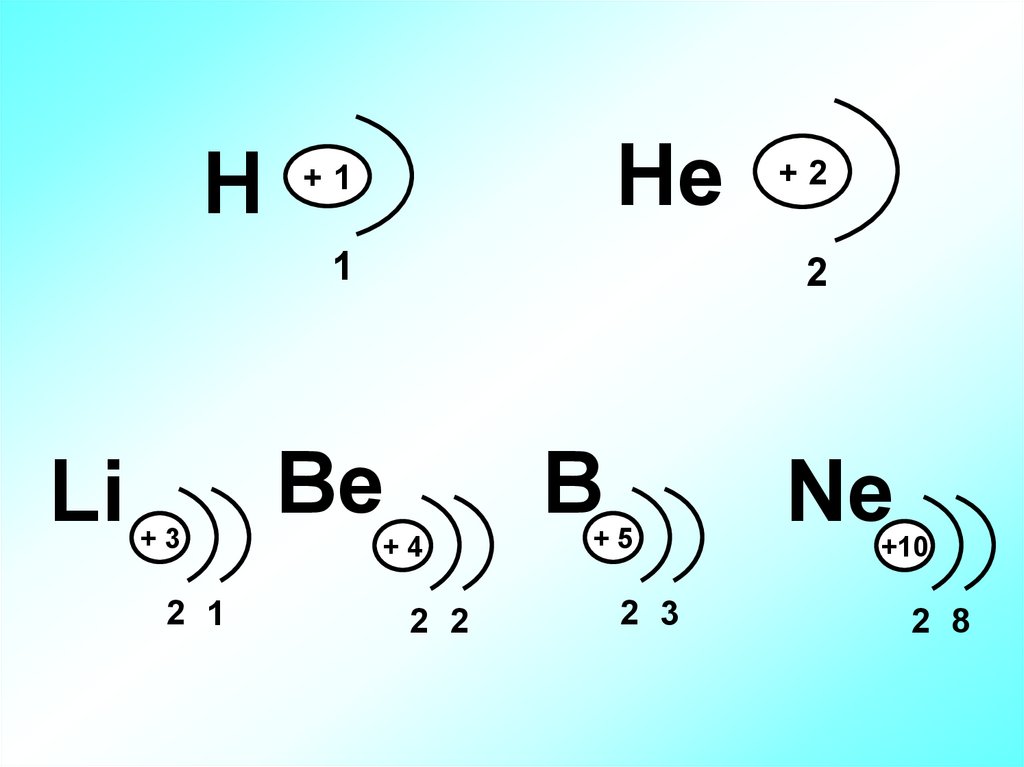
HHe
+1
1
Li
+3
2 1
+2
2
Be
B
+4
2 2
+5
2 3
Ne
+10
2 8
12.
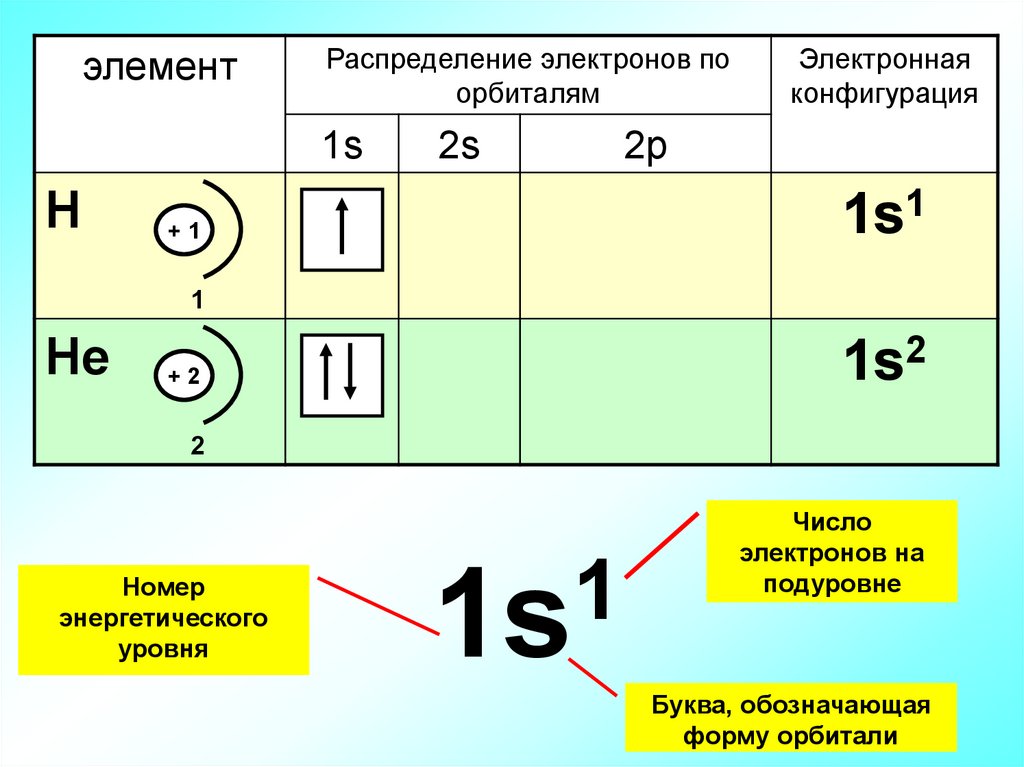
элементРаспределение электронов по
орбиталям
1s
Н
2s
Электронная
конфигурация
2p
1s1
+1
1
Не
1s2
+2
2
Номер
энергетического
уровня
1
1s
Число
электронов на
подуровне
Буква, обозначающая
форму орбитали
13.
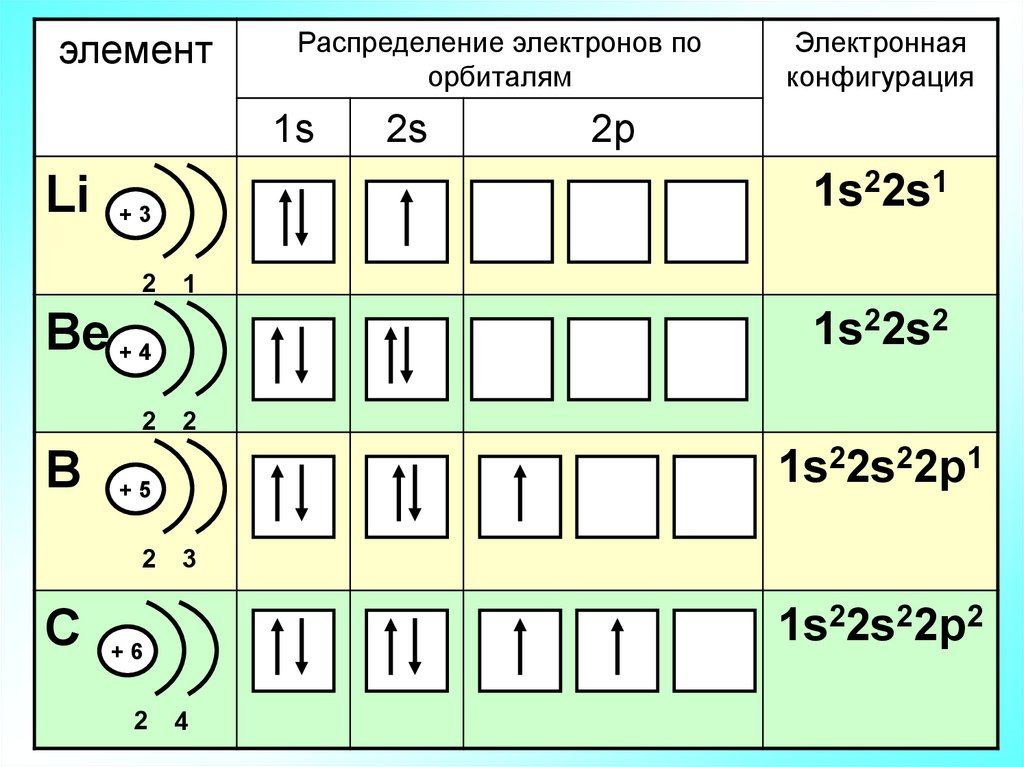
элементРаспределение электронов по
орбиталям
1s
1
1s22s2
Bе + 4
2
B
2
1s22s22p1
+5
2
3
1s22s22p2
C +6
2
2p
1s22s1
Li + 3
2
2s
Электронная
конфигурация
4
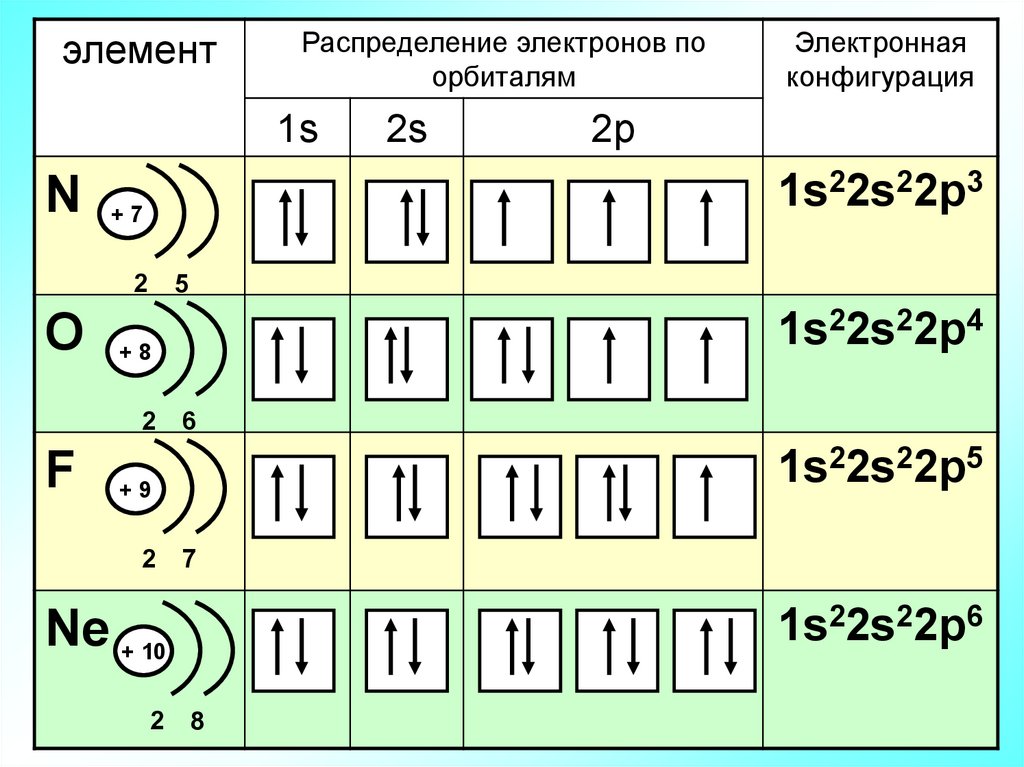
14.
элементРаспределение электронов по
орбиталям
1s
2p
1s22s22p3
N +7
2
5
1s22s22p4
O +8
2
F
2s
Электронная
конфигурация
6
1s22s22p5
+9
2
7
1s22s22p6
Ne + 10
2
8
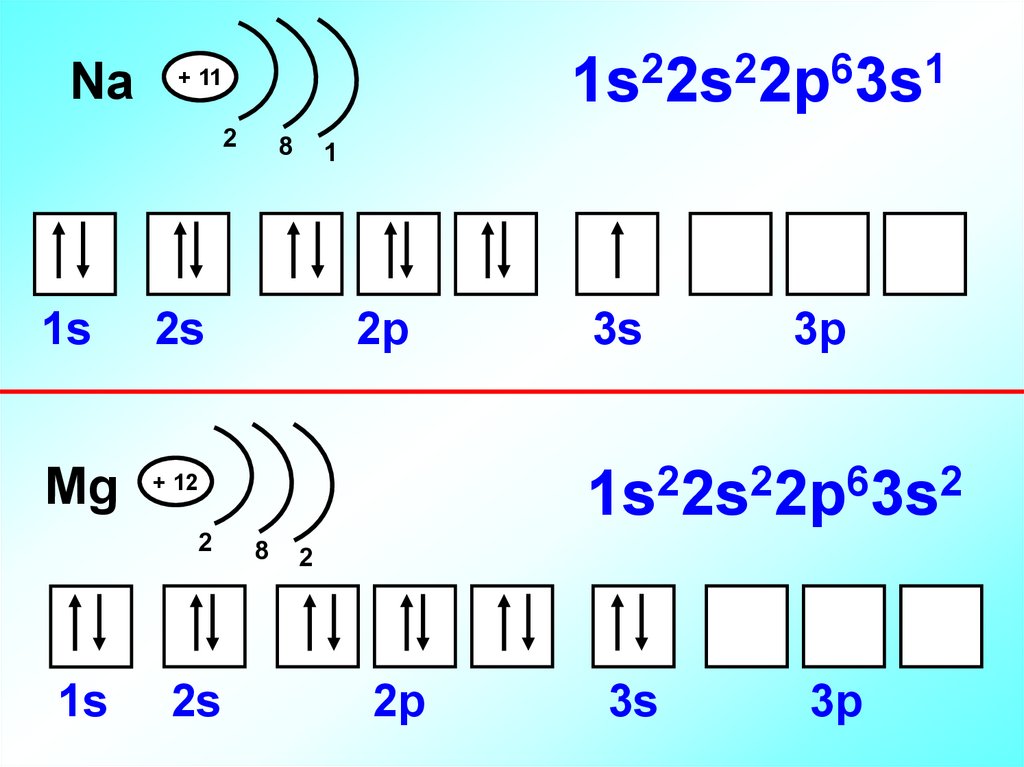
15.
Na2
2
6
1
1s 2s 2p 3s
+ 11
2
1s
8
1
2s
2p
3p
1s22s22p63s2
Mg + 12
2
1s
3s
2s
8
2
2p
3s
3p
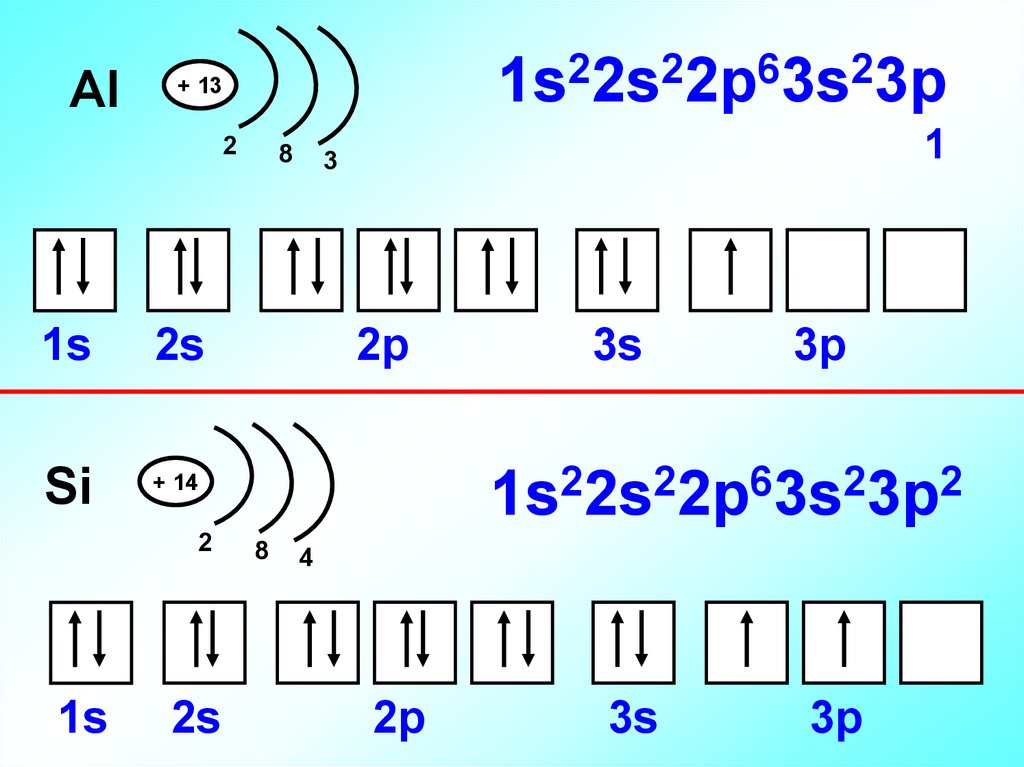
16.
Al2
2
6
2
1s 2s 2p 3s 3p
+ 13
2
1s
2s
Si
+ 14
1
3
2p
3s
3p
1s22s22p63s23p2
2
1s
8
2s
8
4
2p
3s
3p
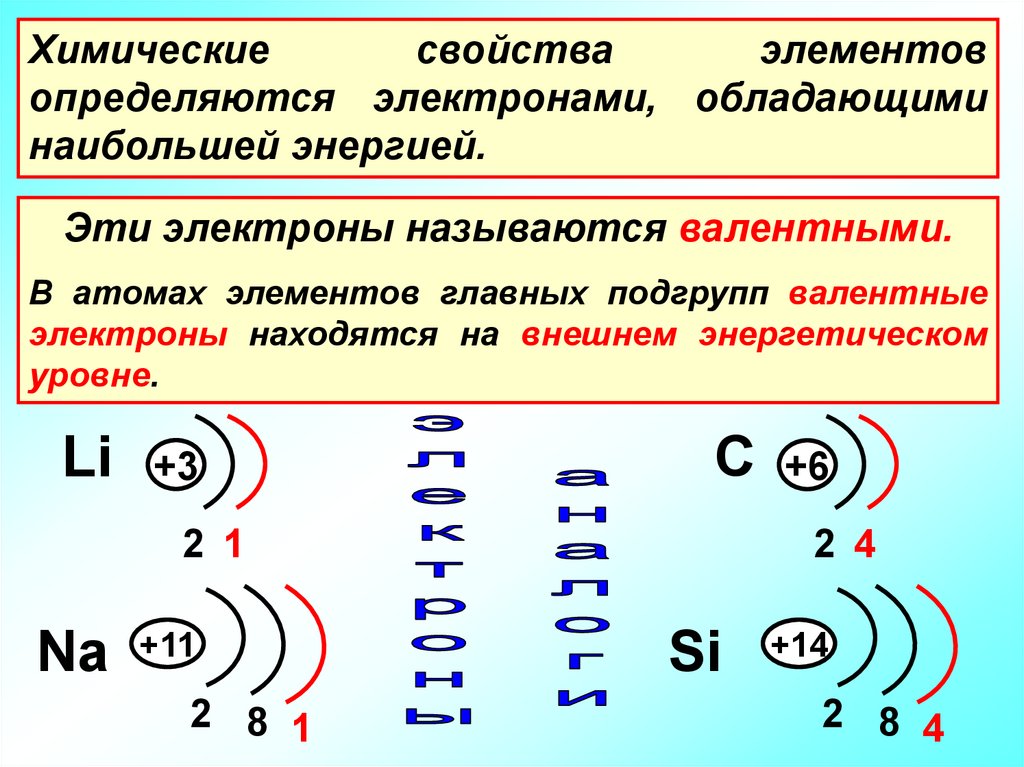
17.
Химическиесвойства
элементов
определяются электронами, обладающими
наибольшей энергией.
Эти электроны называются валентными.
В атомах элементов главных подгрупп валентные
электроны находятся на внешнем энергетическом
уровне.
Li
+3
С +6
2 1
Na +11
2 8 1
2 4
Si
+14
2 8 4
18.
С увеличением порядкового номераэлемента в ПС
число валентных электронов
периодически повторяется, что
приводит к периодическому изменению
свойств элементов
и образованных ими веществ.






 chemistry
chemistry








