Similar presentations:
Строение атома Модели строения атома. Ядро и нуклоны. Изотопы. Электронные конфигурации атомов. Классификация
1.
Строение атомаМодели строения атома. Ядро и нуклоны. Изотопы.
Электронные конфигурации атомов. Классификация химических
элементов (s-, p-, d-, f-элементы)
2.
Модели строения атома• Джозеф Джон Томсон — «пудинговая модель» — в 1904 году. Томсон
открыл существование электронов (Нобелевскую премия).
• Однако наука на тот момент не могла объяснить существование
электронов в пространстве. Томсон предположил, что атом состоит из
отрицательных электронов, помещенных в равномерно заряженный
положительно «суп», который компенсирует заряд электронов.
3.
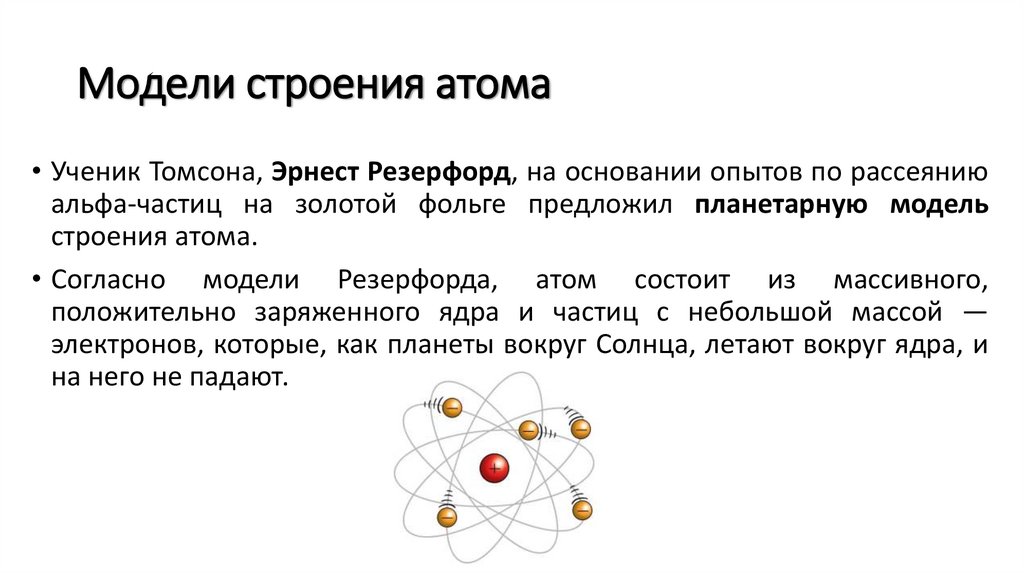
Модели строения атома• Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию
альфа-частиц на золотой фольге предложил планетарную модель
строения атома.
• Согласно модели Резерфорда, атом состоит из массивного,
положительно заряженного ядра и частиц с небольшой массой —
электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и
на него не падают.
4.
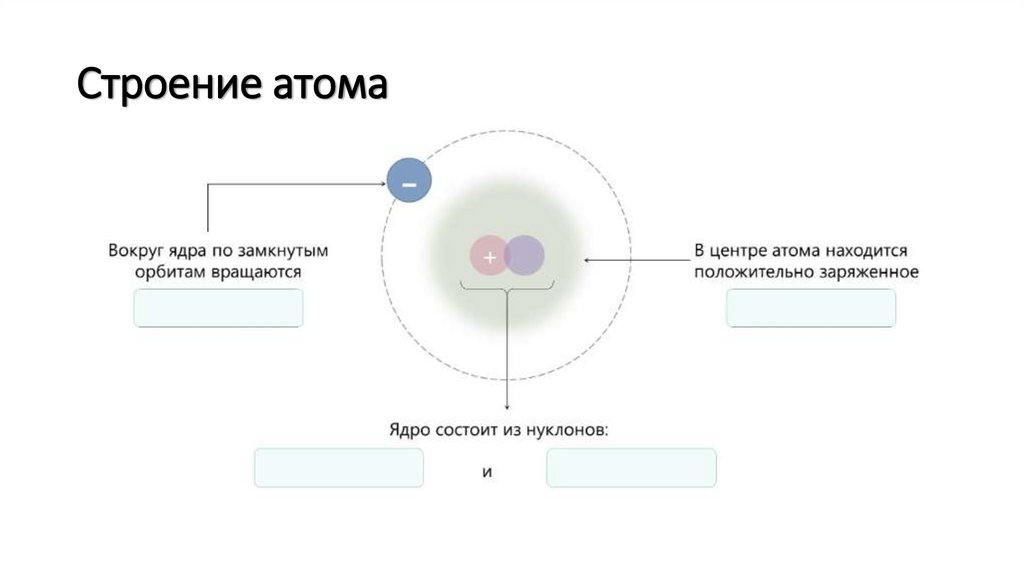
Строение атома5.
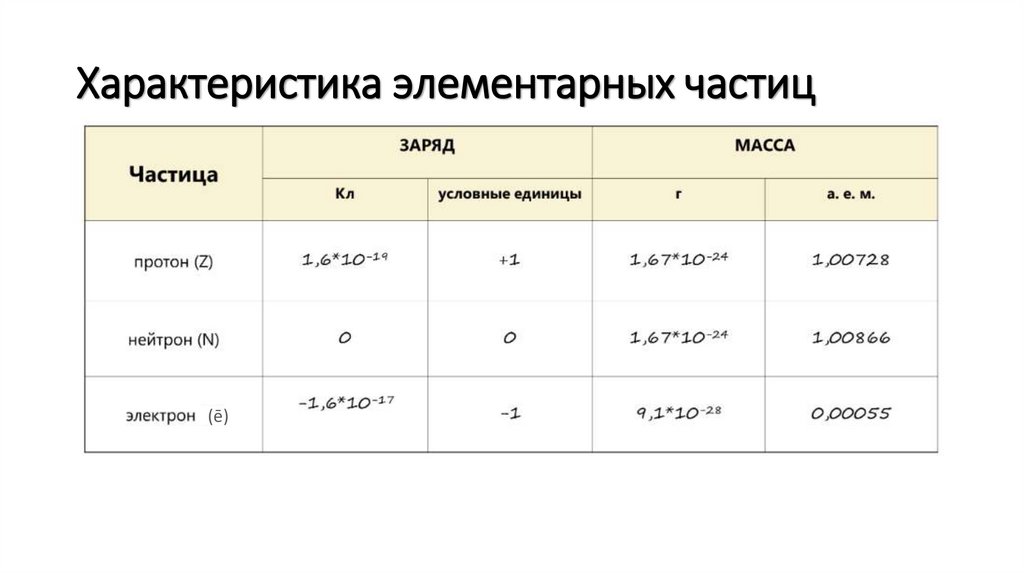
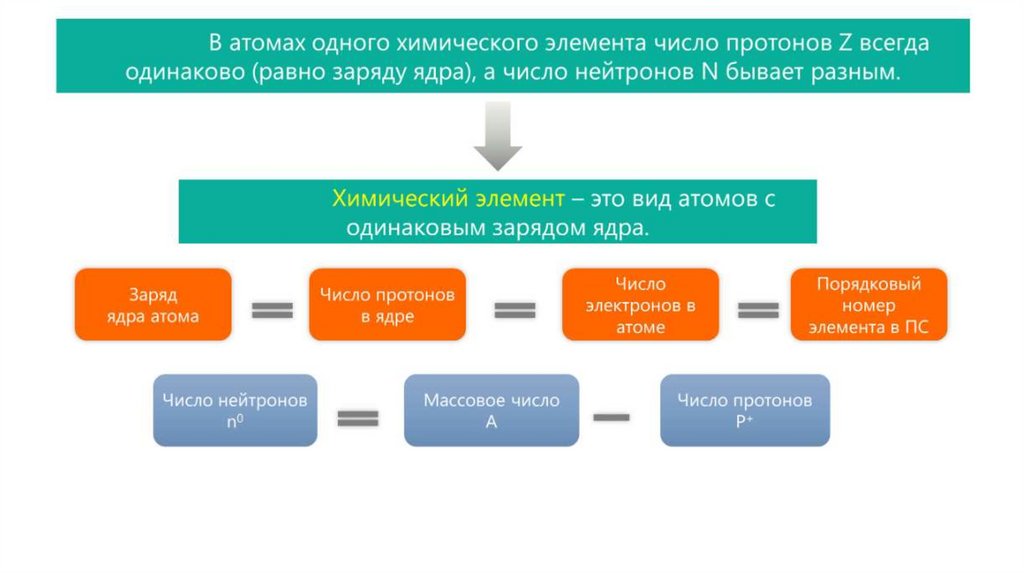
Характеристика элементарных частиц(ē)
6.
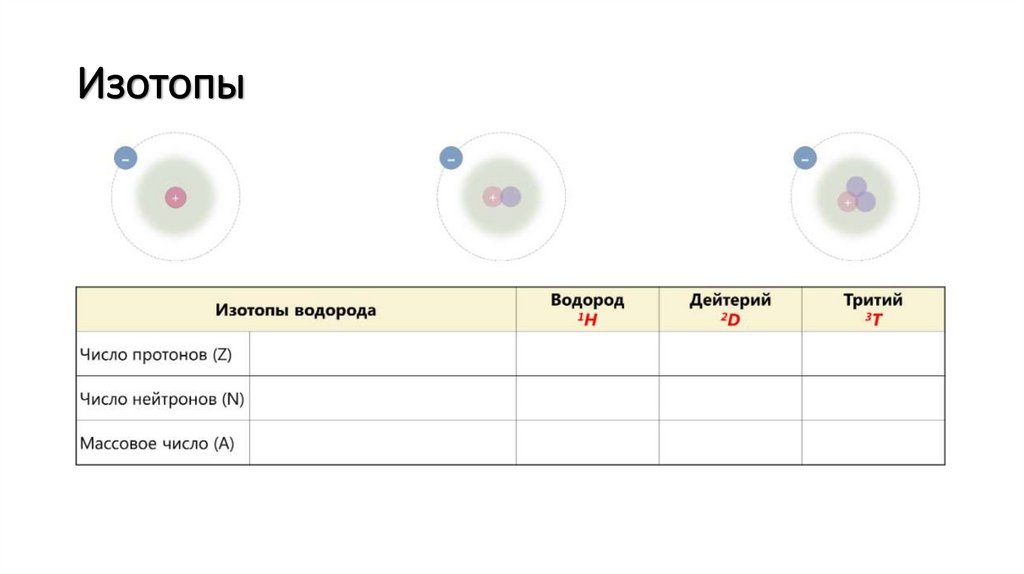
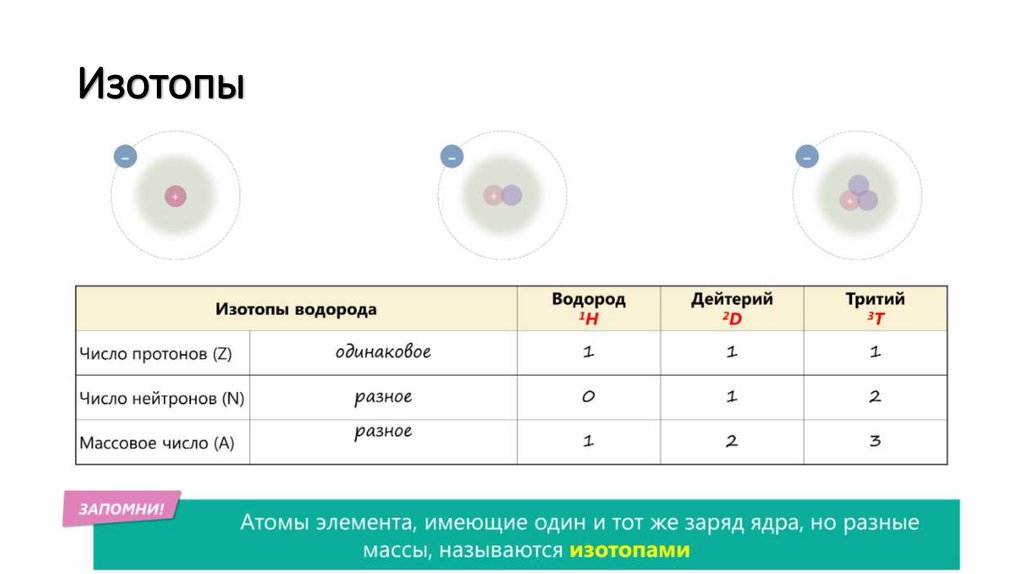
Изотопы7.
Изотопы8.
9.
Квантовая теория10.
Корпускулярно-волновой дуализм11.
Принцип неопределённости12.
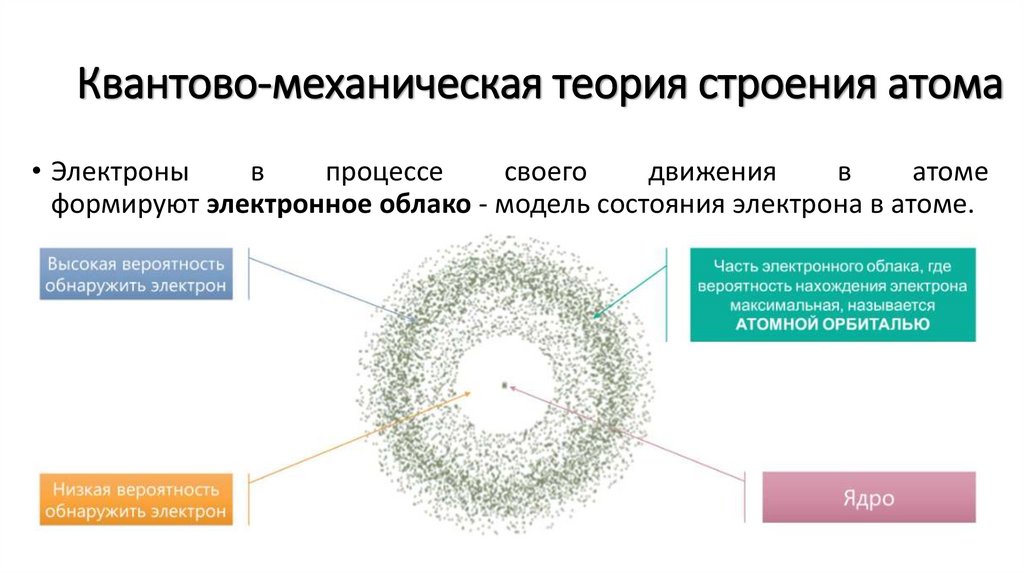
Квантово-механическая теория строения атома• Электроны
в
процессе
своего
движения
в
атоме
формируют электронное облако - модель состояния электрона в атоме.
13.
Квантово-механическая теория строения атома• Энергетическое состояние электрона в атоме описывают квантовыми
числами.
• Главное квантовое число n принимает значения целых чисел от 1 до ∞:
n = 1,2,3,4,5,6,7… ∞
• Совокупность орбиталей, которые имеют одинаковое значение
главного квантового числа, - это энергетический уровень.
• Совокупность
электронов,
которые
находятся
на
одном
энергетическом уровне, - это электронный слой.
• На одном энергетическом уровне могут находиться орбитали, которые
имеют различные геометрические формы.
14.
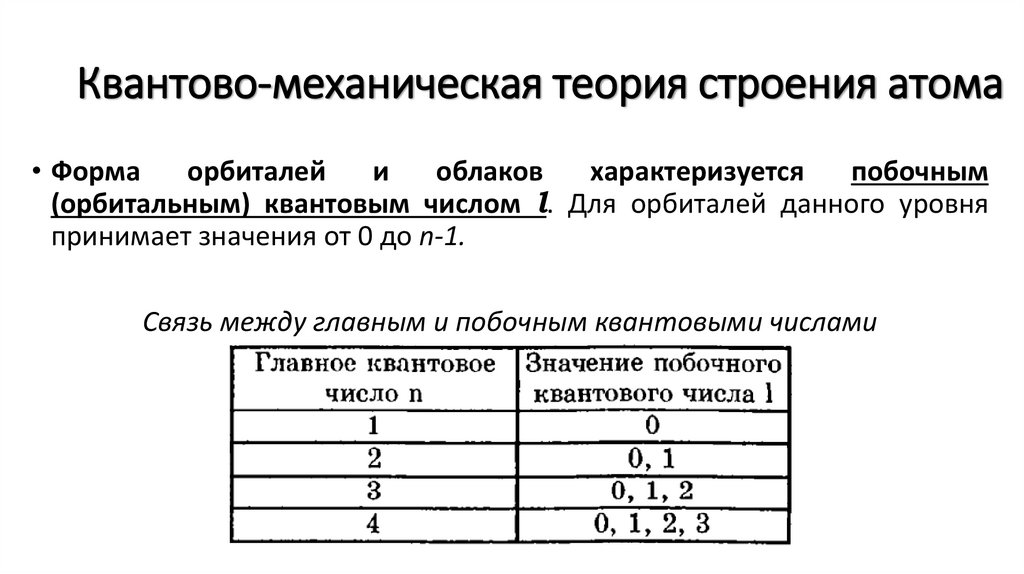
Квантово-механическая теория строения атома• Форма
орбиталей
и
облаков
характеризуется
побочным
(орбитальным) квантовым числом l. Для орбиталей данного уровня
принимает значения от 0 до n-1.
Связь между главным и побочным квантовыми числами
15.
Квантово-механическая теория строения атома• l=0 – форма шара (сферы).
s-орбитали имеются на всех энергетических
уровнях.
• l=1 – форма гантели (объёмной восьмёрки).
p-орбитали имеются на всех энергетических
уровнях, кроме первого.
• l=2 – d-орбитали. Уровни?
• l=3 – f-орбитали. Уровни?
16.
Квантово-механическая теория строения атома• Энергия орбиталей (Е), которые находятся на одном энергетическом
уровне, но имеют различную форму, неодинакова:
• Поэтому уровни состоят из энергетических подуровней
(совокупность
орбиталей,
которые
находятся
на
одном
энергетическом уровне и имеют одинаковую форму).
• Орбитали одного подуровня имеют одинаковые значения главного
квантового числа (n) и одинаковые значения побочного квантового
числа (l).
1s-подуровень (n=1, l=0).
4d-подуровень (n=4, l=2).
• Т.о., число подуровней на уровне тоже равно главному квантовому
числу.
17.
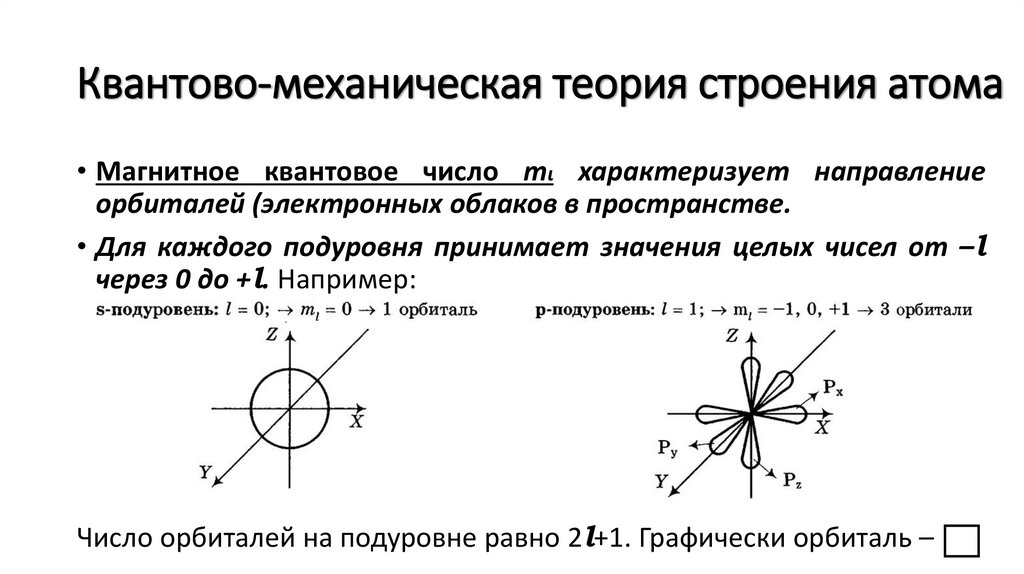
Квантово-механическая теория строения атома• Магнитное квантовое число mι характеризует направление
орбиталей (электронных облаков в пространстве.
• Для каждого подуровня принимает значения целых чисел от –l
через 0 до +l. Например:
Число орбиталей на подуровне равно 2l+1. Графически орбиталь –
18.
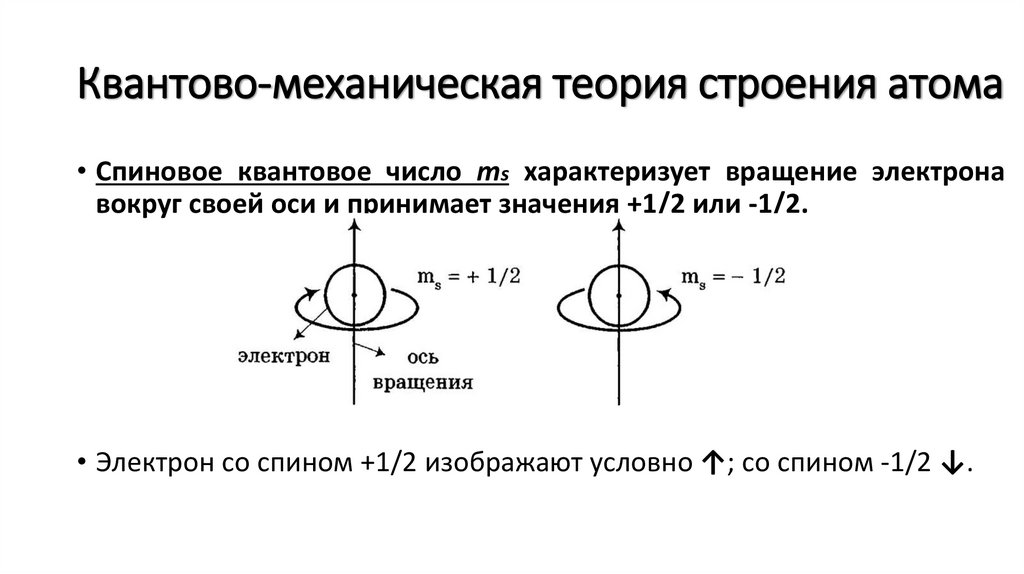
Квантово-механическая теория строения атома• Спиновое квантовое число ms характеризует вращение электрона
вокруг своей оси и принимает значения +1/2 или -1/2.
• Электрон со спином +1/2 изображают условно ↑; со спином -1/2 ↓.
19.
Принцип Паули• В атоме не может быть двух электронов с одинаковым набором
всех четырёх квантовых чисел.
• Следовательно, на одной орбитали не может быть больше двух
электронов (n, l , mι будут одинаковыми, но ms должно
отличаться ↑↓ .
• Спаренные электроны – электроны с противоположными
спинами.
• Общее число электронов на энергетическом уровне
20.
Закрепление1. На каком энергетическом уровне нет р-подуровня? Почему?
2. На каких энергетических уровнях нет d-подуровней? Почему?
3. Продолжите таблицу для 3 (M) и 4 (N) энергетического уровней.
21.
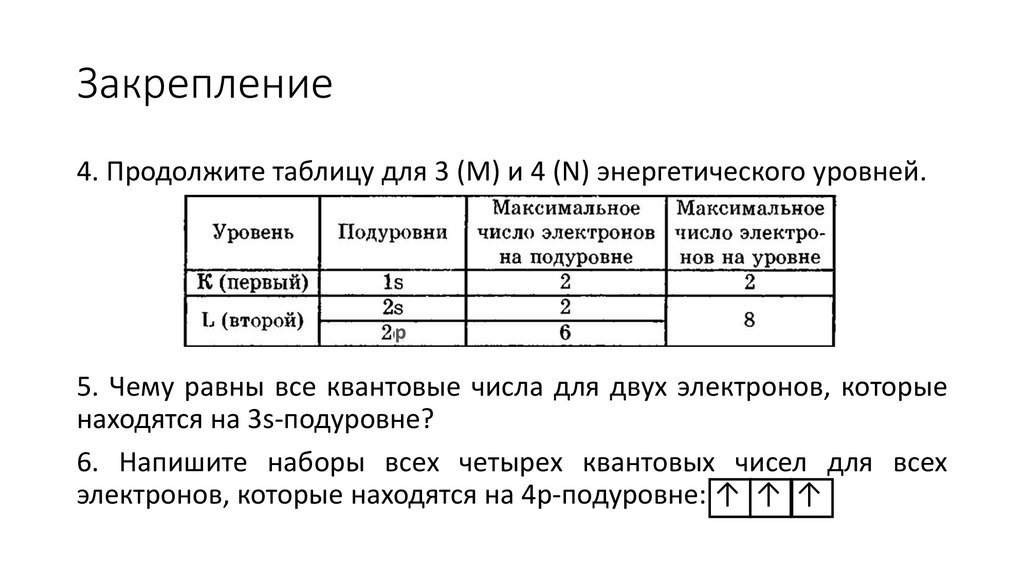
Закрепление4. Продолжите таблицу для 3 (M) и 4 (N) энергетического уровней.
р
5. Чему равны все квантовые числа для двух электронов, которые
находятся на 3s-подуровне?
6. Напишите наборы всех четырех квантовых чисел для всех
электронов, которые находятся на 4р-подуровне: ↑ ↑ ↑
22.
Закрепление7. На каком энергетическом уровне и на каком энергетическом
подуровне находится электрон, для которого n=4 и l=1? Какую
форму имеет облако этого электрона?
8. Какие значения имеют главное квантовое число и побочное
квантовое число для следующих подуровней: 1s, 2s, 2p, 3s, 3p, 3d,
4s, 4p, 4d, 4f?
9. Чем отличается электронное облако, которое характеризуется
n=4, l=0, mι=0 от электронного облака, которое характеризуется
n=3, l=0, mι=0?











 chemistry
chemistry








