Similar presentations:
Рак желудка. Эпидемиология
1. Рак желудка
2. Эпидемиология
Рак желудка является второй по частоте причиной смерти отзлокачественных новообразований в мире.
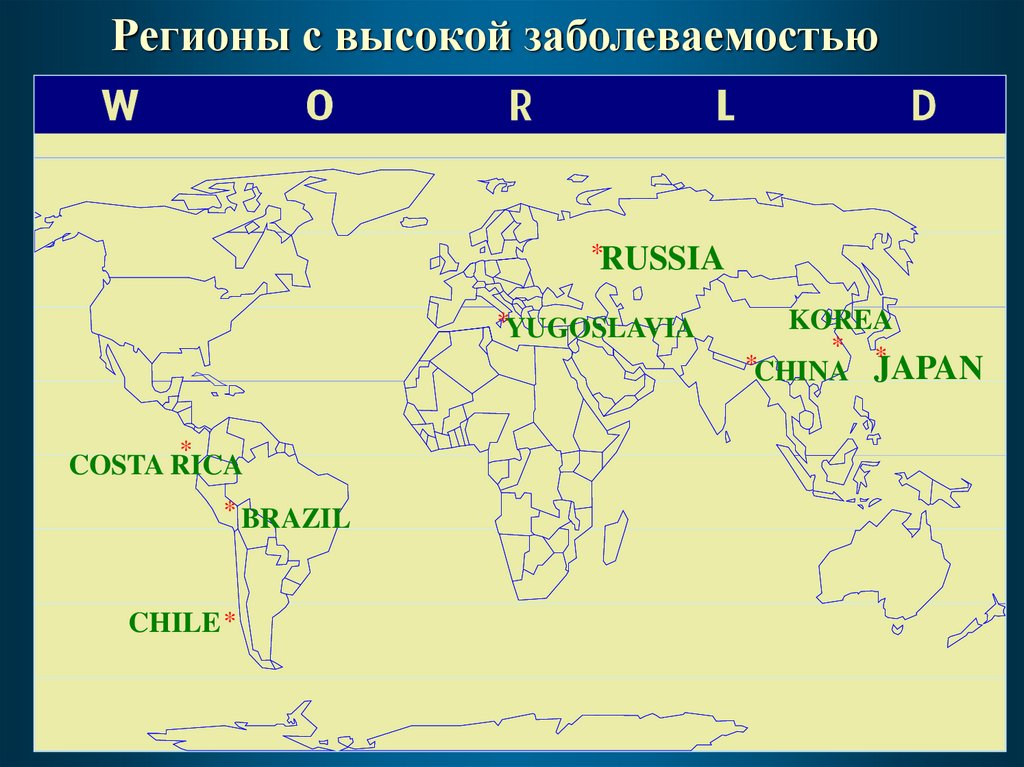
Наиболее высокая заболеваемость отмечается в Японии (78/100
тыс.), некоторых странах Центральной Европы, Скандинавии,
Южной и Центральной Америки, бывшем СССР, а также в Китае и
Корее.
В РФ ежегодно регистрируют около 45 тыс. первичных больных
раком желудка, 41 тыс. умирает. Заболеваемость составляет 32 на
100 тыс. населения.
Средний возраст больных составляет 65,5 лет, мужчины
заболевают в 2 раза чаще женщин.
Начиная с середины XX века, во всем мире отмечается снижение
заболеваемости раком желудка за счет больных раком дистальных
отделов желудка, в то время как удельный вес рака кардии растет,
причем наиболее быстро – среди лиц моложе 40 лет.
3.
Регионы с высокой заболеваемостью*RUSSIA
*YUGOSLAVIA
*
COSTA RICA
* BRAZIL
CHILE *
KOREA
* *
*CHINA JAPAN
4. ЭТИОЛОГИЯ
А. Пищевые факторы рискаИзбыточное потребление поваренной соли и нитратов
Недостаток витаминов А и С
Потребление копченых, маринованных и вяленых продуктов
Сохранение пищи без использования холодильника
Качество питьевой воды
Б. Факторы внешней среды и образа жизни
Профессиональные вредности (производство резины, угля)
Курение табака
Ионизирующее излучение
Резекция желудка в анамнезе
Ожирение
В. Инфекционные факторы
Helicobacter pylori
Epstein-Barr virus
5. ЭТИОЛОГИЯ
Г. Генетические факторыГруппа крови А (II)
Пернициозная анемия
Семейный рак желудка
Синдром наследственного рака желудка диффузного типа (HDGC).
Наследственный неполипозный колоректальный рак
синдром Li Fraumeni (синдром наследственного рака)
Наследственные синдромы, сопровождающиеся полипозом желудочнокишечного тракта: семейный аденоматозный полипоз толстой кишки,
синдром Gardner, синдром Peutz-Jeghers, семейный ювенильный полипоз
Д. Предраковые заболевания желудка
Аденоматозные полипы желудка
Хронический атрофический гастрит
Болезнь Менетрие (гиперпластический гастрит)
Пищевод Барретта, гастро-эзофагеальная рефлюксная болезнь
Дисплазия желудочного эпителия
Кишечная метаплазия
6.
Международная гистологическаяклассификация рака желудка
Папиллярная аденокарцинома
Тубулярная аденокарцинома
высокодифференцированная
умереннодифференцированная
Низкодифференцированная аденокарцинома
Муцинозная аденокарцинома
Перстневидноклеточная аденокарцинома
Аденоплоскоклеточный рак
Плоскоклеточный рак
Карциноидная опухоль
Недифференцированный рак
Другие формы рака
7.
Гистологическая классификация по LaurenКишечный тип: опухоль имеет строение, схожее с
аденокарциномой кишечного типа и характеризуется
отчетливыми железистыми структурами, состоящими из
хорошо дифференцированного цилиндрического
эпителия с развитой щеточной каемкой.
Диффузный тип: опухоль представлена слабо
организованными группами или одиночными клетками
с большим содержанием муцина (перстневидные) и
характеризуется диффузным инфильтративным ростом.
8.
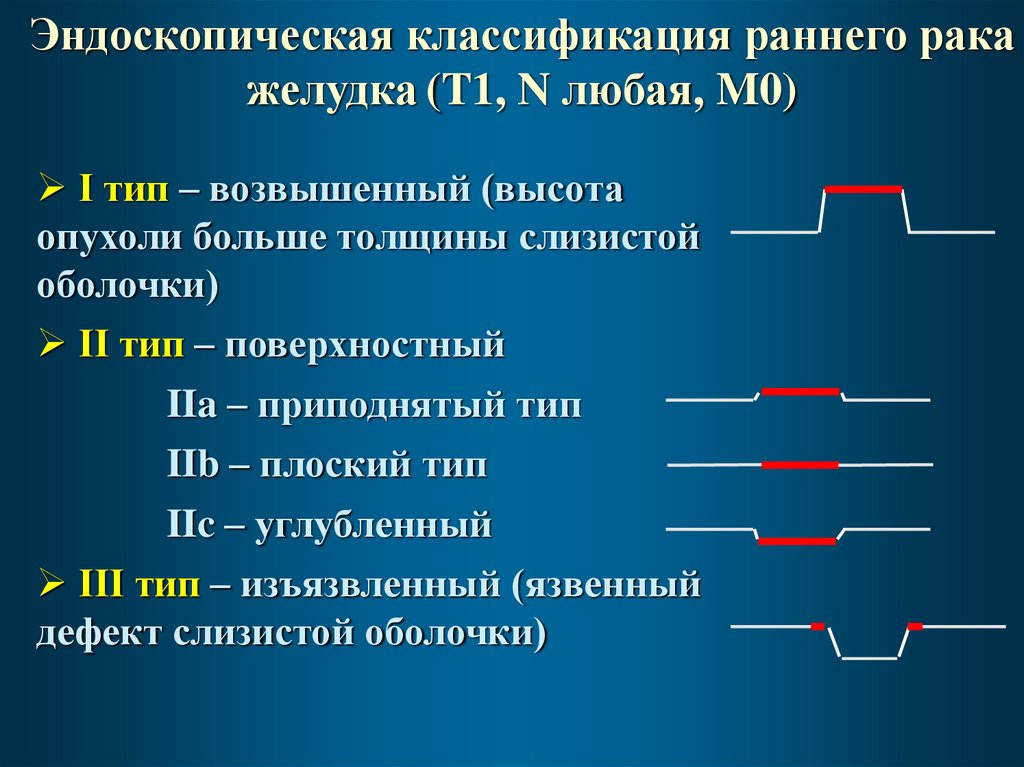
Эндоскопическая классификация раннего ракажелудка (T1, N любая, M0)
I тип – возвышенный (высота
опухоли больше толщины слизистой
оболочки)
II тип – поверхностный
IIa – приподнятый тип
IIb – плоский тип
IIc – углубленный
III тип – изъязвленный (язвенный
дефект слизистой оболочки)
9.
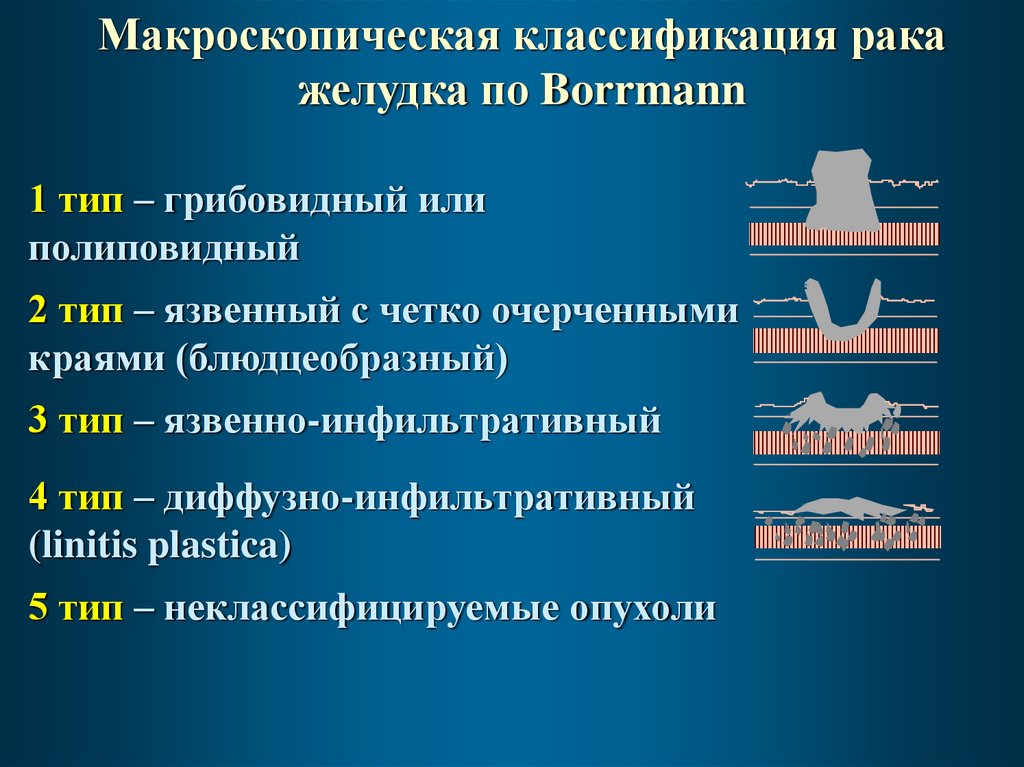
Макроскопическая классификация ракажелудка по Borrmann
1 тип – грибовидный или
полиповидный
2 тип – язвенный с четко очерченными
краями (блюдцеобразный)
3 тип – язвенно-инфильтративный
4 тип – диффузно-инфильтративный
(linitis plastica)
5 тип – неклассифицируемые опухоли
10.
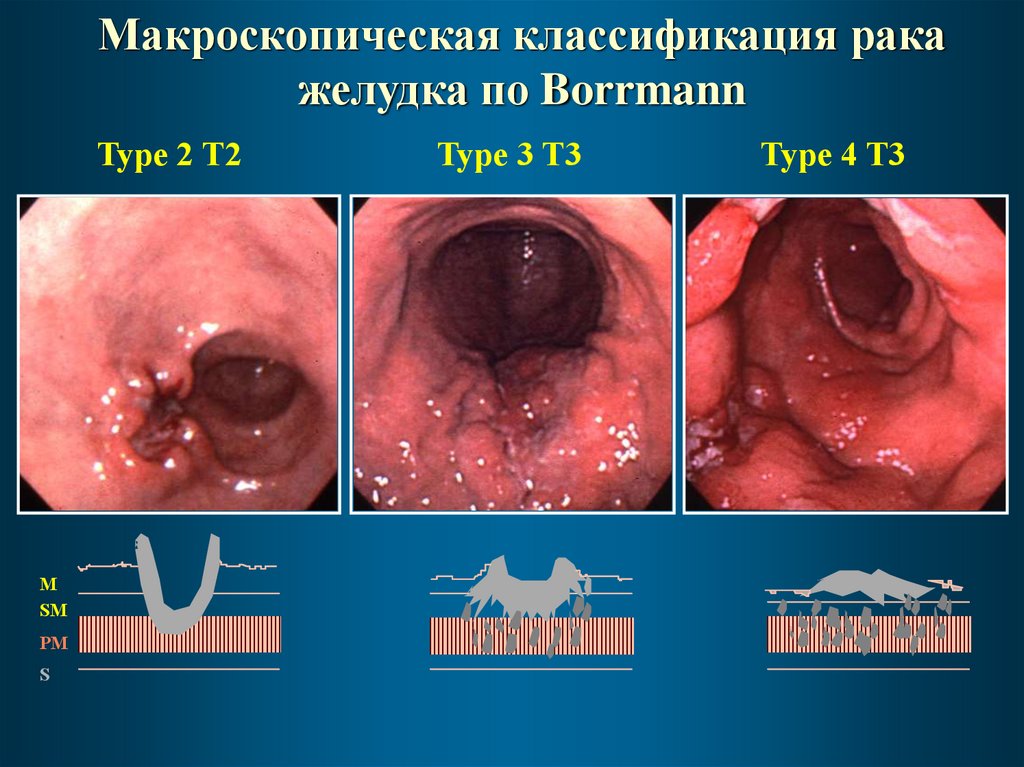
Макроскопическая классификация ракажелудка по Borrmann
Type 2 T2
M
SM
PM
S
Type 3 T3
Type 4 T3
11.
Клинические симптомыдискомфорт или боль в эпигастральной области (60-90%)
анорексия
потеря веса (50%)
рвота кофейной гущей, мелена при раке, осложненном
желудочным кровотечением (10-15%)
тошнота, рвота (40%)
прогрессирующая дисфагия, наблюдаемая при раке
кардии и кардиоэзофагеального перехода
быстрое насыщение, тяжесть после еды может
свидетельствовать о диффузной инфильтративной опухоли
общая слабость, утомляемость
отрыжка с неприятным запахом, повторная рвота ранее
съеденной пищей, что свидетельствует о стенозе
привратника
12.
Первичная диагностика рака желудкаКлиническое обследование (сбор анамнеза,
осмотр, пальпация живота, периферических
лимфоузлов, ректальное, вагинальное
исследование и т.п.)
Эзофагогастродуоденоскопия с
множественной биопсией.
Гистологическое исследование биоптатов
13.
Уточняющая диагностикаА. Базовый комплекс
Полипозиционное рентгенологическое исследование
в условиях двойного контрастирования (бариевой
взвесью и воздухом)
Эзофагогастродуоденоскопия с биопсией из
неизмененных участков слизистой желудка и по линии
предполагаемой резекции (фон)
Трансабдоминальное ультразвуковое исследование
органов брюшной полости, забрюшинного
пространства, малого таза (ТРУЗИ, ТВУЗИ) и
надключичных зон
Рентгенография грудной клетки в 2 проекциях.
14.
Уточняющая диагностикаВ. Дополнительные методы
Компьютерная или магнитно-резонансная
томография
Диагностическая лапароскопия,
лапароскопическое ультразвуковое исследование
Эндосонография
Флуоресцентная диагностика
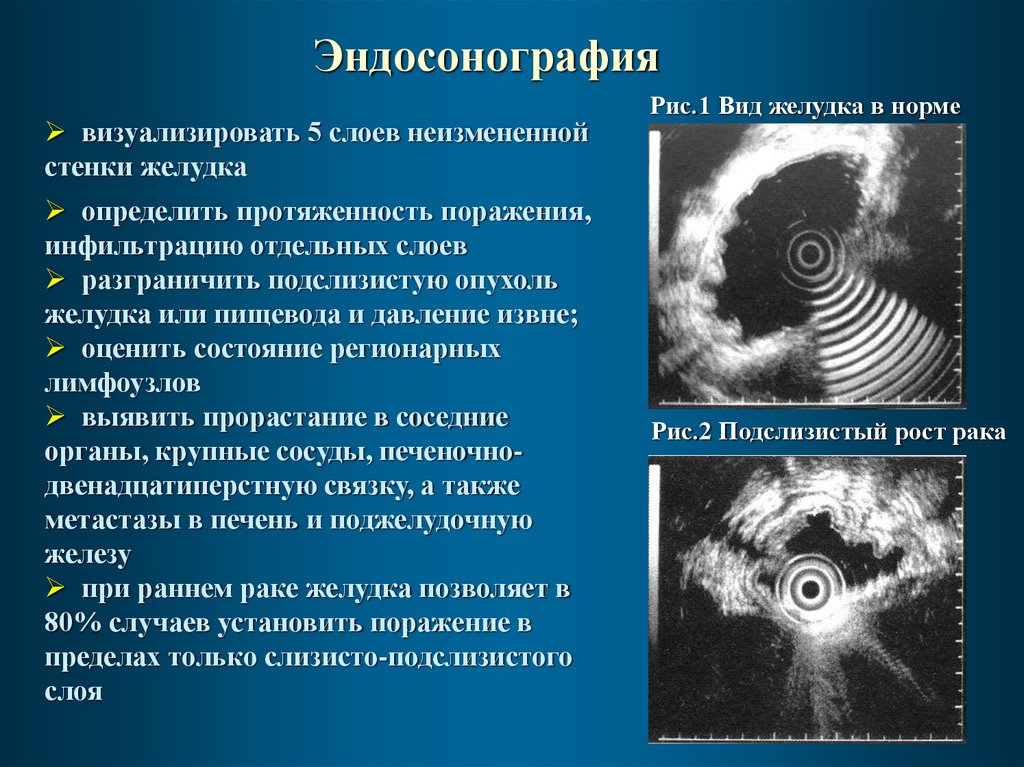
15.
Эндосонографиявизуализировать 5 слоев неизмененной
стенки желудка
определить протяженность поражения,
инфильтрацию отдельных слоев
разграничить подслизистую опухоль
желудка или пищевода и давление извне;
оценить состояние регионарных
лимфоузлов
выявить прорастание в соседние
органы, крупные сосуды, печеночнодвенадцатиперстную связку, а также
метастазы в печень и поджелудочную
железу
при раннем раке желудка позволяет в
80% случаев установить поражение в
пределах только слизисто-подслизистого
слоя
Рис.1 Вид желудка в норме
Рис.2 Подслизистый рост рака
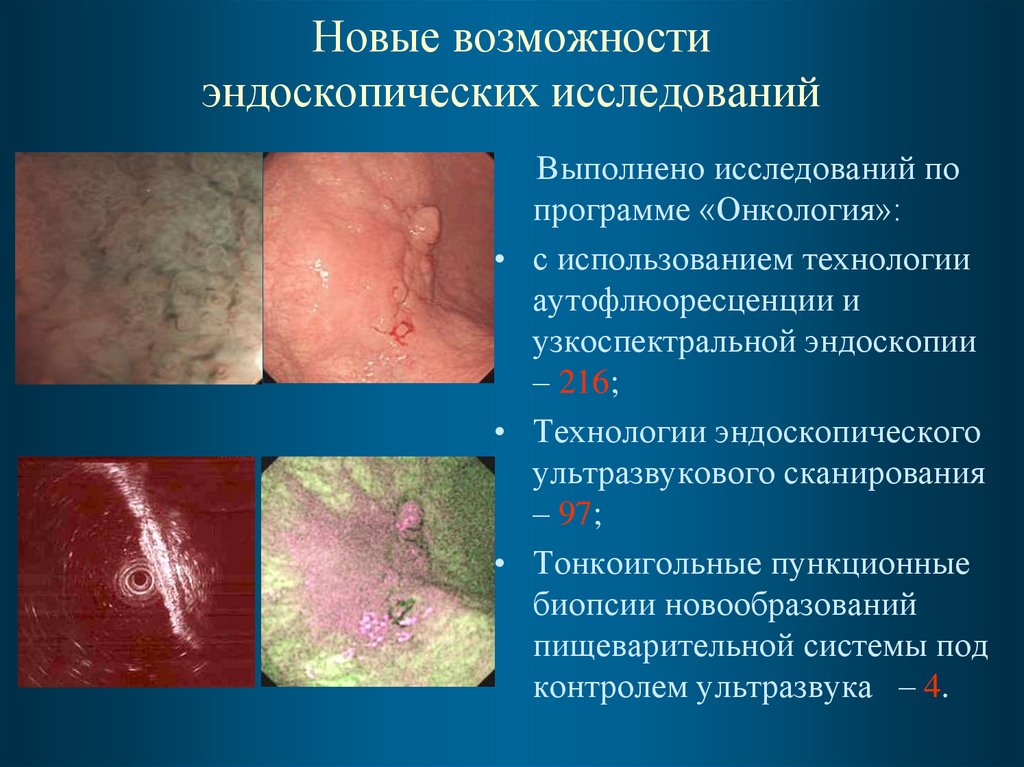
16. Новые возможности эндоскопических исследований
Выполнено исследований попрограмме «Онкология»:
• с использованием технологии
аутофлюоресценции и
узкоспектральной эндоскопии
– 216;
• Технологии эндоскопического
ультразвукового сканирования
– 97;
• Тонкоигольные пункционные
биопсии новообразований
пищеварительной системы под
контролем ультразвука – 4.
17.
Уточняющая диагностикаПоказания к диагностической лапароскопии:
субтотальное / тотальное поражение
выход на серозу по данным УЗИ/КТ
наличие множественных увеличенных регионарных лимфоузлов
по данным УЗИ/КТ
начальные проявления асцита
визуализируемые при УЗИ/КТ изменения брюшины (подозрение
на диссеминацию)
подозрение на метастазы в печени
Противопоказания:
осложненный рак желудка, требующий ургентного вмешательства
(стеноз, кровотечение, перфорация)
выраженный спаечный процесс в брюшной полости после ранее
перенесенных операций
18.
Лапароскопическая флуоресцентнаядиагностика
Из 60 больных раком желудка
диссеминация по брюшине
выявлена у 38 (63,3%).
У 10 (16,7%) больных диссеминация
определялась только в режиме
флуоресценции.
Чувствительность метода при раке
желудка составила 72,3%,
специфичность – 64%, общая
точность метода – 69%.
19.
Лапароскопическая флуоресцентнаядиагностика
Изменение лечебной тактики в результате ФЛД
только
лапароскопия
n=6
II-III
n=38
IV
n=3
n=29
энтеростомия,
обх. анастомоз
циторедуктивная
операция + ФДТ
20.
Уточняющая диагностикаПоказания к КТ/МРТ:
значительное несоответствие результатов
рентгенологического, эндоскопического и
ультразвукового исследований в оценке
распространенности опухолевого процесса;
планирование комбинированного лечения.
21.
Интраоперационное УЗИГруппы больных
Солитарные метастазы в печени (по
данным трансабдоминального УЗИ)
Без метастазов в печень
(по данным трансабдоминального УЗИ
и интраоперационной ревизии)
Число больных с дополнительно
выявленными при интраоперационном
УЗИ метастазами в печень
5 из 12 (41,7%)
9 из 63 (14,3%)
Проведение интраоперационной ультрасонографии
позволяет изменить стадию заболевания с предполагаемой II
или III на IV у 15% больных за счет обнаружения метастазов
в печени.
22.
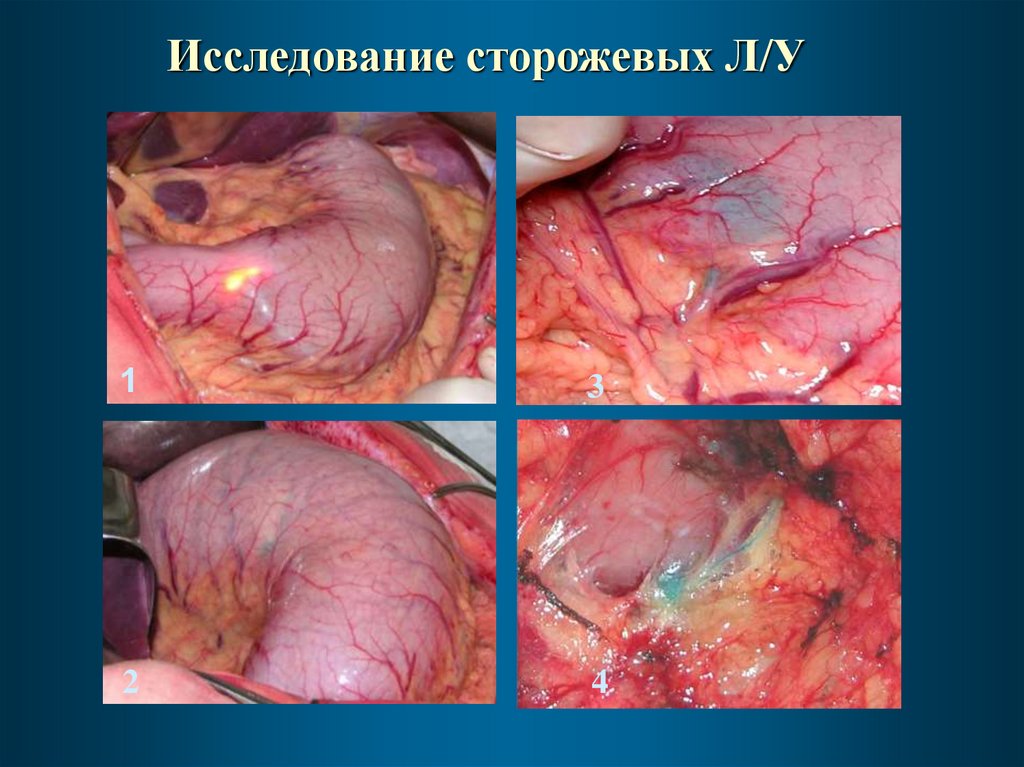
Исследование сторожевых Л/У1
3
2
4
23.
Исследование сторожевых Л/УВ МНИОИ разработана и внедрена методика изучения
сторожевых лимфатических узлов при помощи красителя
Patent-Blue-V.
При раннем раке данная методика применена у 15
больных.
Сторожевые лимфатические узлы определены у 12
больных, из них у 3-х выявлены метастазы в сторожевых
лимфоузлах, в т.ч. у двух – микрометастазы.
Ложноотрицательных результатов не было.
Чувствительность метода при РРЖ составила 100%,
специфичность – 100%.
24.
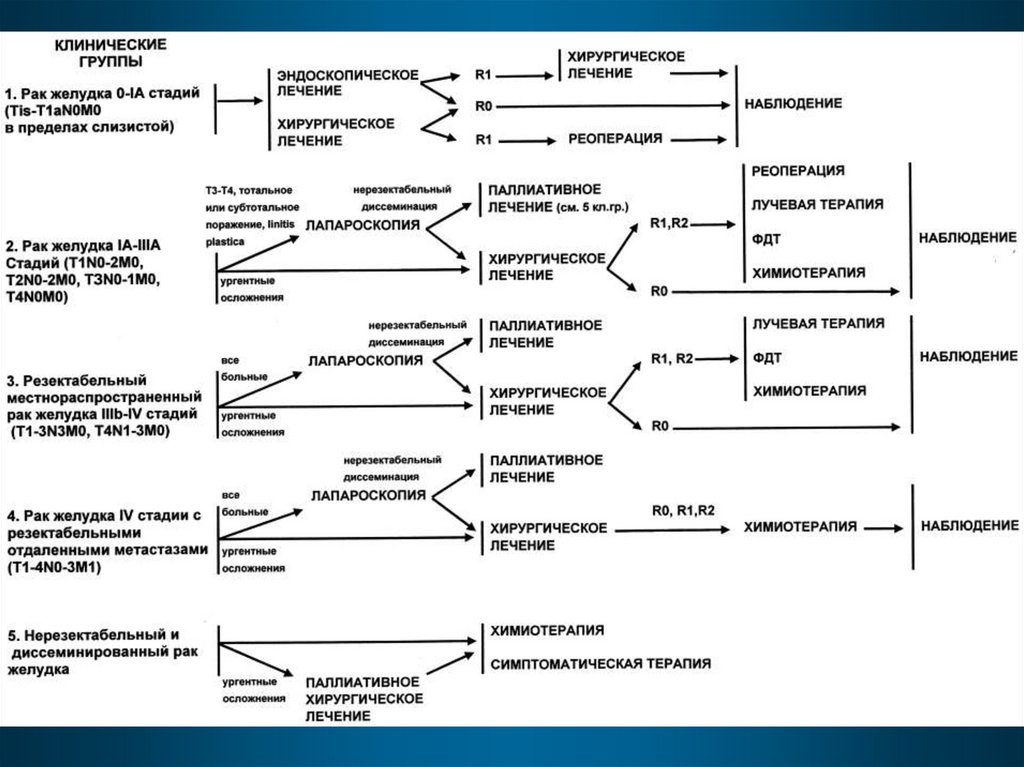
Лечение рака желудкаРанний рак желудка (Tis-T1N0M0).
Резектабельный рак желудка: 1) рак желудка IIII стадий; 2) резектабельный местнораспространенный рак желудка IV стадии без
отдаленных гематогенных метастазов и
перитонеальной диссеминации.
Нерезектабельный и генерализованный рак
желудка: 1) рак желудка IV стадии (отдаленные
метастазы, диссеминация); 2) нерезектабельный
местно-распространенный рак желудка; 3) рак
желудка на фоне тяжелой сопутствующей
патологии (функционально неоперабельный).
25.
Эндоскопическое лечение раннегорака желудка
Показания:
1) рак желудка строения папиллярной или тубулярной
аденокарциномы;
2) I-IIа-b тип опухоли размерами до 2 см или IIс тип
без изъязвления размером до 1 см.
При соблюдении вышеуказанных критериев частота
лимфогенного метастазирования близка к 0%.
Общая
5-тилетняя
выживаемость
после
эндоскопических резекций слизистой составляет 86%,
частота местных рецидивов не превышает 5%, причем
повторные резекции позволяют повысить процент
излеченности до 90-100%.
26.
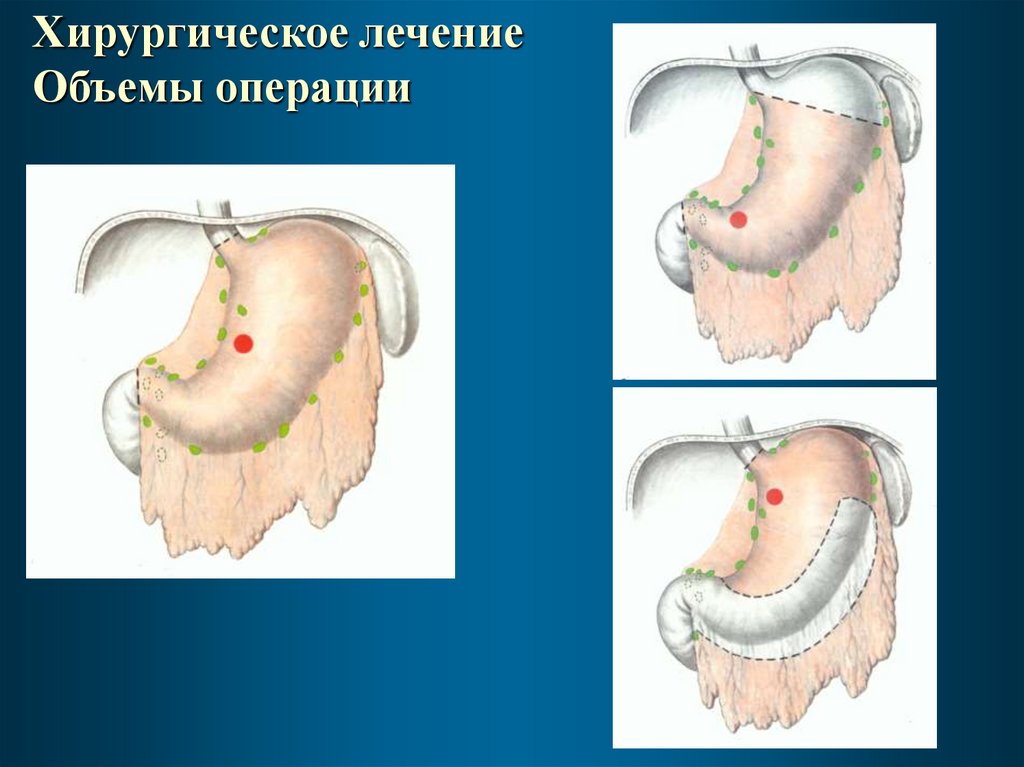
Хирургическое лечениеОбъемы операции
27.
Выбор объема операцииДистальная субтотальная резекция желудка (ДСРЖ)
показана при опухолях экзофитной или смешанной
формы роста, расположенных ниже условной линии,
соединяющей точку, расположенную на 5 см ниже кардии
по малой кривизне, и промежуток между правой и левой
желудочно-сальниковыми артериями по большой
кривизне.
Проксимальную субтотальную резекцию желудка
(ПСРЖ) выполняют при раке кардии и
кардиоэзофагеального перехода. При раке верхней трети
желудка возможно выполнение как проксимальной
субтотальной резекции, так и гастрэктомии.
Во всех остальных случаях показана гастрэктомия (ГЭ)
28.
Выбор объема операцииПри распространении на пищевод при опухолях экзофитной и
смешанной форм роста допустимым является отступление на
5-8 см от края опухоли в проксимальном направлении с
обязательным срочным морфологическим исследованием края
резекции.
При опухолях эндофитной формы роста
распространение раковых клеток в проксимальном
направлении может достигать 10-12 см от видимого
края опухоли, что обусловливает необходимость более
высокой резекции.
При вовлечении ретроперикардиального сегмента
пищевода целесообразно выполнять субтотальную
резекцию пищевода.
29.
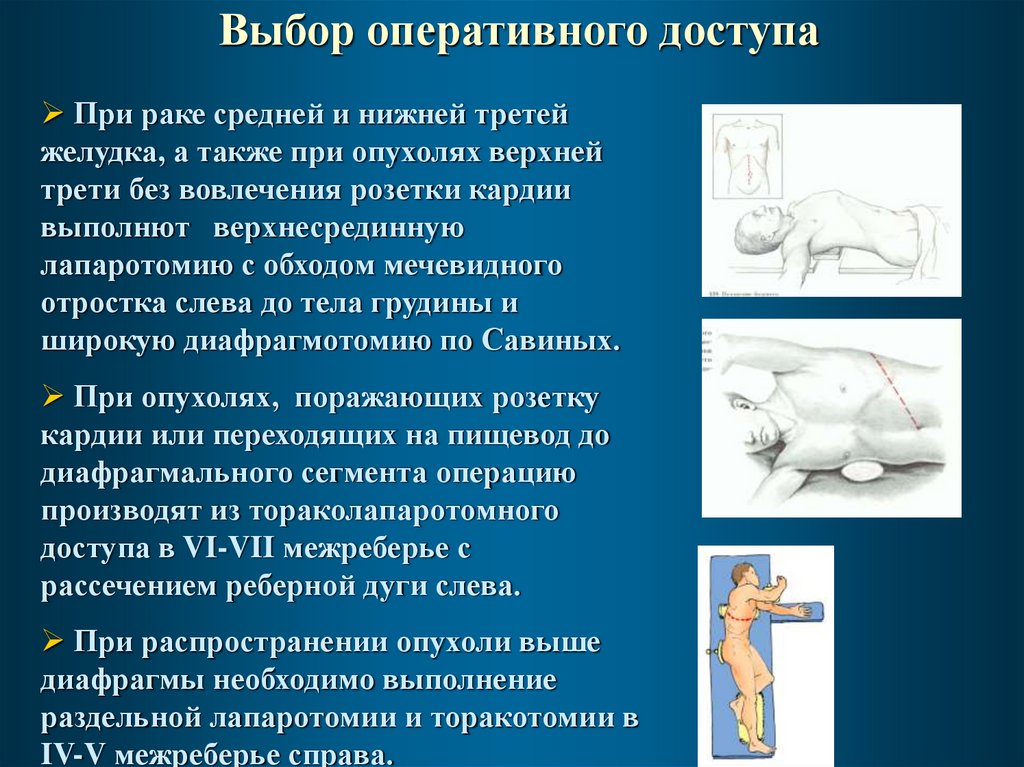
Выбор оперативного доступаПри раке средней и нижней третей
желудка, а также при опухолях верхней
трети без вовлечения розетки кардии
выполнют верхнесрединную
лапаротомию с обходом мечевидного
отростка слева до тела грудины и
широкую диафрагмотомию по Савиных.
При опухолях, поражающих розетку
кардии или переходящих на пищевод до
диафрагмального сегмента операцию
производят из тораколапаротомного
доступа в VI-VII межреберье с
рассечением реберной дуги слева.
При распространении опухоли выше
диафрагмы необходимо выполнение
раздельной лапаротомии и торакотомии в
IV-V межреберье справа.
30.
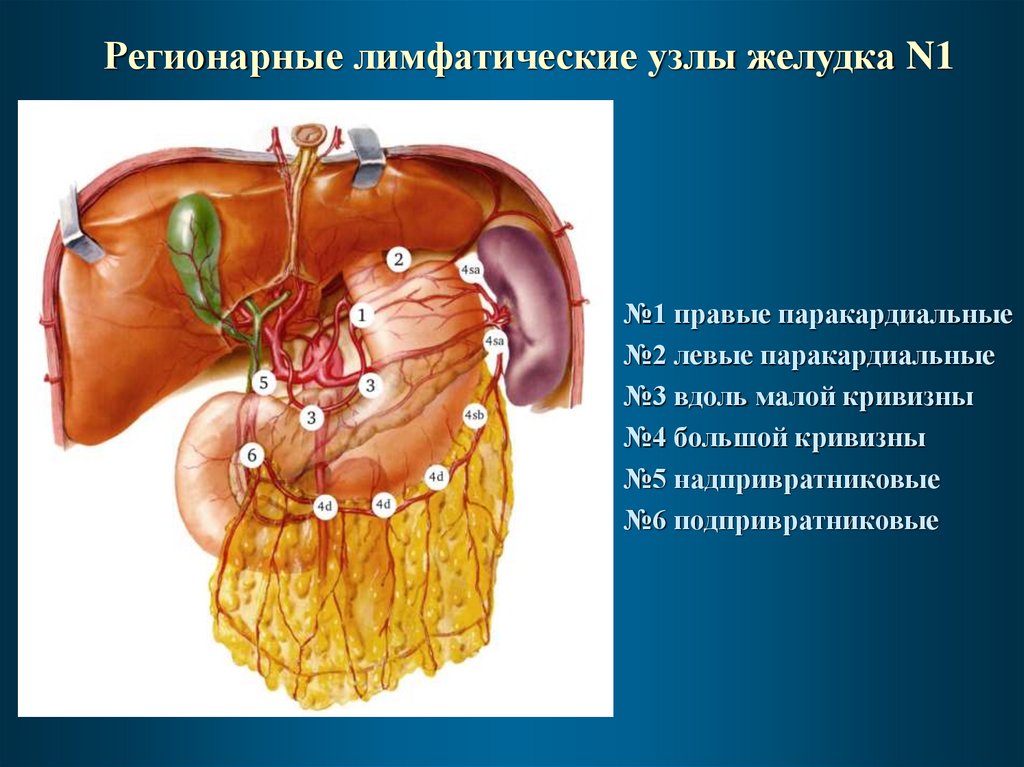
Регионарные лимфатические узлы желудка N1№1 правые паракардиальные
№2 левые паракардиальные
№3 вдоль малой кривизны
№4 большой кривизны
№5 надпривратниковые
№6 подпривратниковые
31.
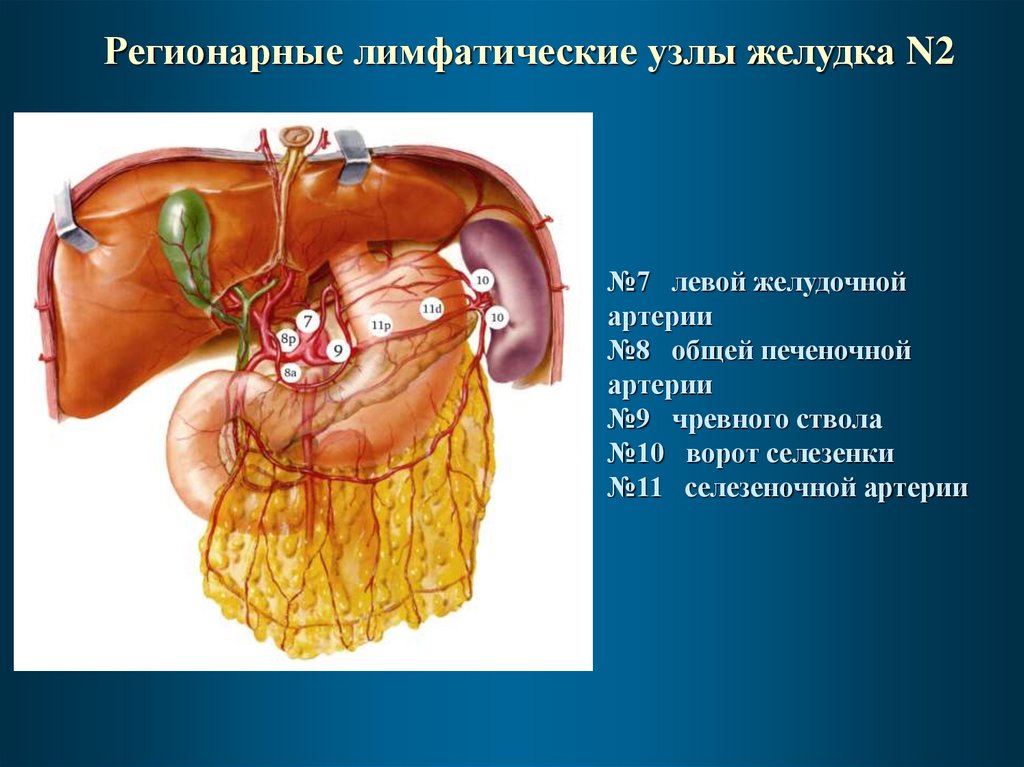
Регионарные лимфатические узлы желудка N2№7 левой желудочной
артерии
№8 общей печеночной
артерии
№9 чревного ствола
№10 ворот селезенки
№11 селезеночной артерии
32.
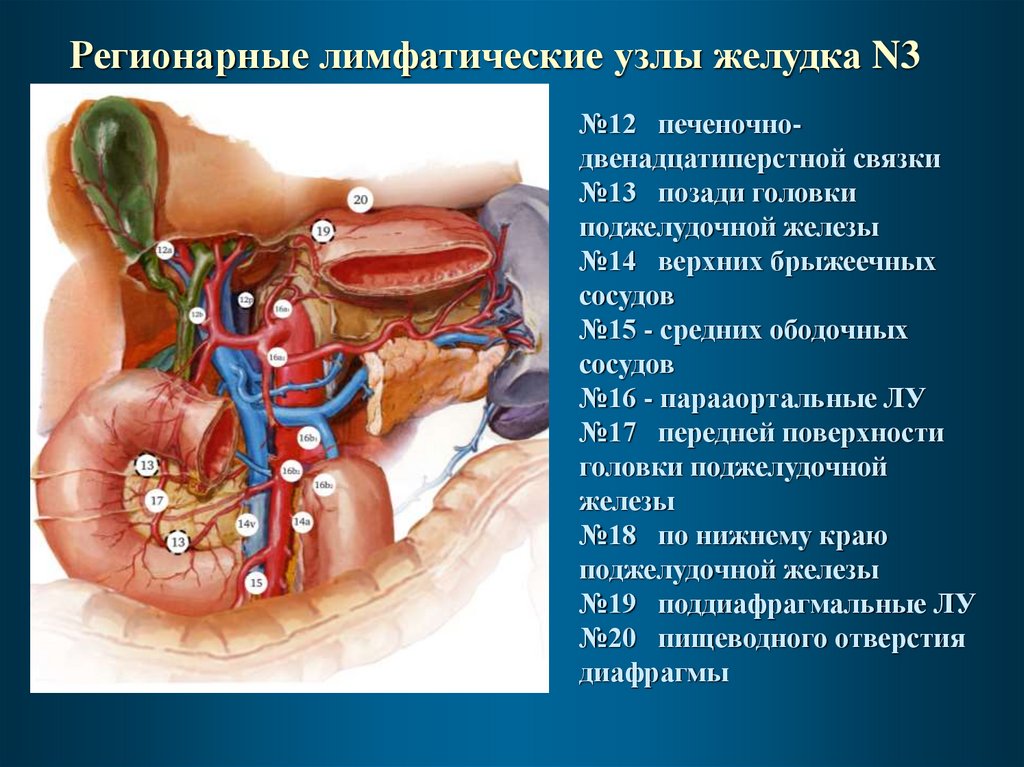
Регионарные лимфатические узлы желудка N3№12 печеночнодвенадцатиперстной связки
№13 позади головки
поджелудочной железы
№14 верхних брыжеечных
сосудов
№15 - средних ободочных
сосудов
№16 - парааортальные ЛУ
№17 передней поверхности
головки поджелудочной
железы
№18 по нижнему краю
поджелудочной железы
№19 поддиафрагмальные ЛУ
№20 пищеводного отверстия
диафрагмы
33.
Регионарные лимфатические узлы желудка(парааортальные ЛУ)
№110 нижние параэзофагеальные
№111 наддиафрагмальные
№112 заднего средостения
34.
Объемы лимфаденэктомии№1 правые паракардиальные
№2 левые паракардиальные
№3 вдоль малой кривизны
D1
№4 большой кривизны
№5 надпривратниковые
№6 подпривратниковые
№7 вдоль левой желудочной артерии
№8 вдоль общей печеночной артерии
№9 вокруг чревного ствола
D2
№10 ворот селезенки
№11 вдоль селезеночной артерии
№12 печеночно-двенадцатиперстной связки
№19 поддиафрагмальные
№20 пищеводного отверстия диафрагмы
при переходе на
№110 нижние параэзофагеальные
пищевод
№111 наддиафрагмальные
№112 лимфатические узлы заднего средостения
№13 позади головки поджелудочной железы
№14 вдоль верхних брыжеечных сосудов
№15 вдоль средних ободочных сосудов
№16 парааортальные
№17 на передней поверхности головки поджелудочной железы
№18 по нижнему краю поджелудочной железы
D3
35.
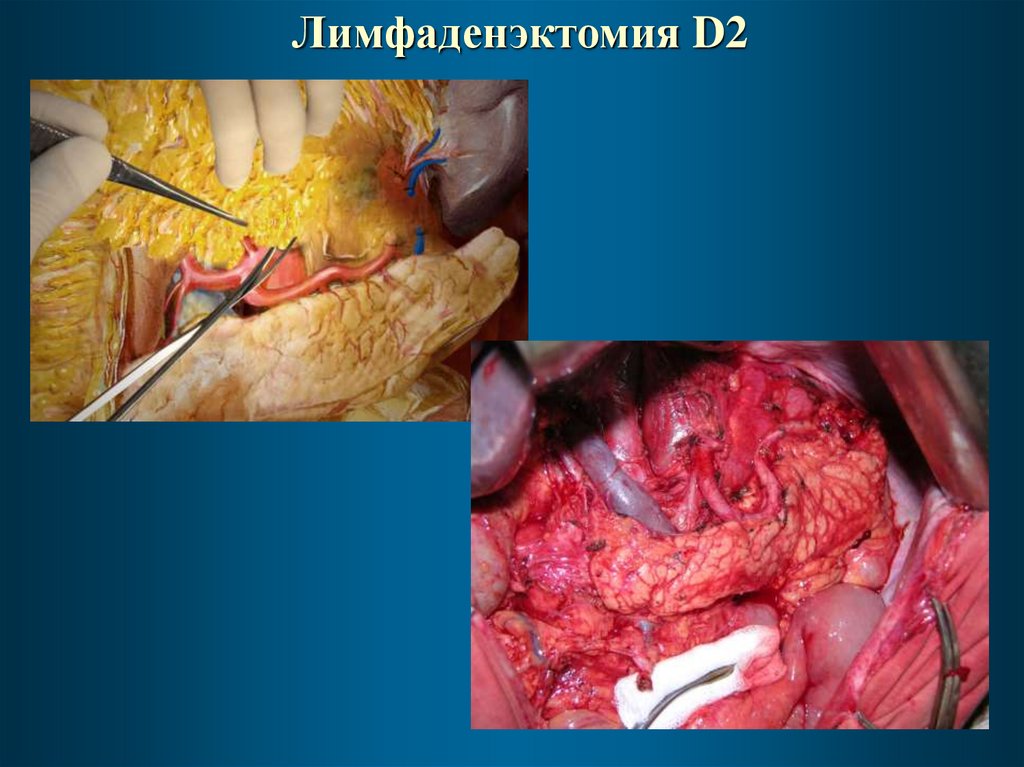
Лимфаденэктомия D236.
Расширенные лимфаденэктомиив группе больных с «интактными»
лимфатическими узлами плановое
гистологическое исследование дало заключение
о наличии метастазов в 48% наблюдений.
метастазы в лимфоузлах N2 группы, не
удаляемых при стандартных вмешательствах,
были выявлены у каждого третьего пациента
среднее количество удаленных в ходе
расширенных операций лимфоузлов почти в 3
раза превышало число лимфоузлов,
иссеченных при стандартных операциях
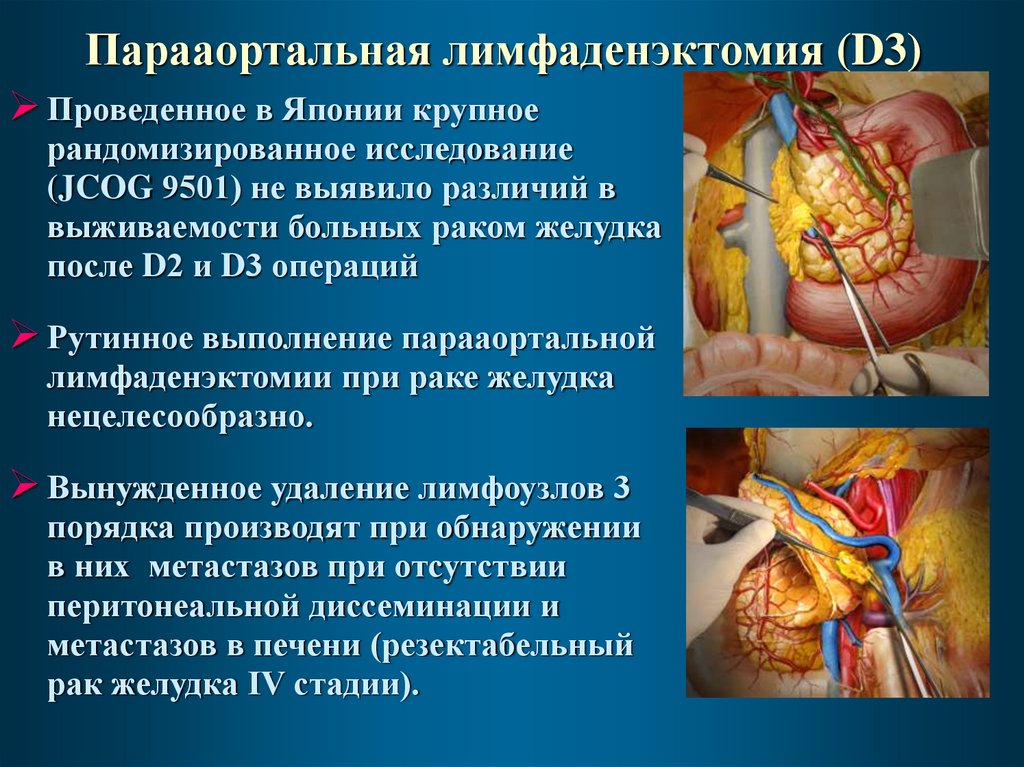
37. Парааортальная лимфаденэктомия (D3)
Проведенное в Японии крупноерандомизированное исследование
(JCOG 9501) не выявило различий в
выживаемости больных раком желудка
после D2 и D3 операций
Рутинное выполнение парааортальной
лимфаденэктомии при раке желудка
нецелесообразно.
Вынужденное удаление лимфоузлов 3
порядка производят при обнаружении
в них метастазов при отсутствии
перитонеальной диссеминации и
метастазов в печени (резектабельный
рак желудка IV стадии).
38.
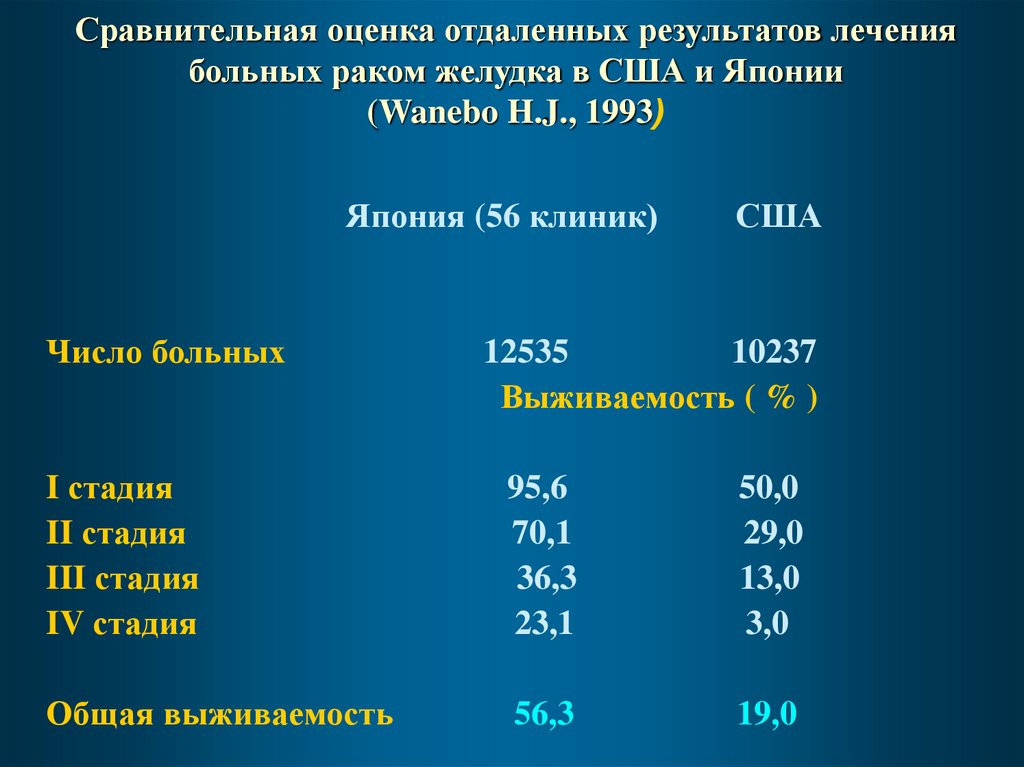
Сравнительная оценка отдаленных результатов лечениябольных раком желудка в США и Японии
(Wanebo H.J., 1993)
Япония (56 клиник)
Число больных
США
12535
10237
Выживаемость ( % )
I стадия
II стадия
III стадия
IV стадия
95,6
70,1
36,3
23,1
50,0
29,0
13,0
3,0
Общая выживаемость
56,3
19,0
39. Выполнение расширенных операций при раке желудка позволяет
максимально объективизироватьраспространенность опухолевого процесса;
снизить частоту местных рецидивов почти в
4 раза;
улучшить отдаленные результаты лечения
на 12-30%;
указанные преимущества достигаются без
значительного увеличения числа
послеоперационных осложнений и
летальности.
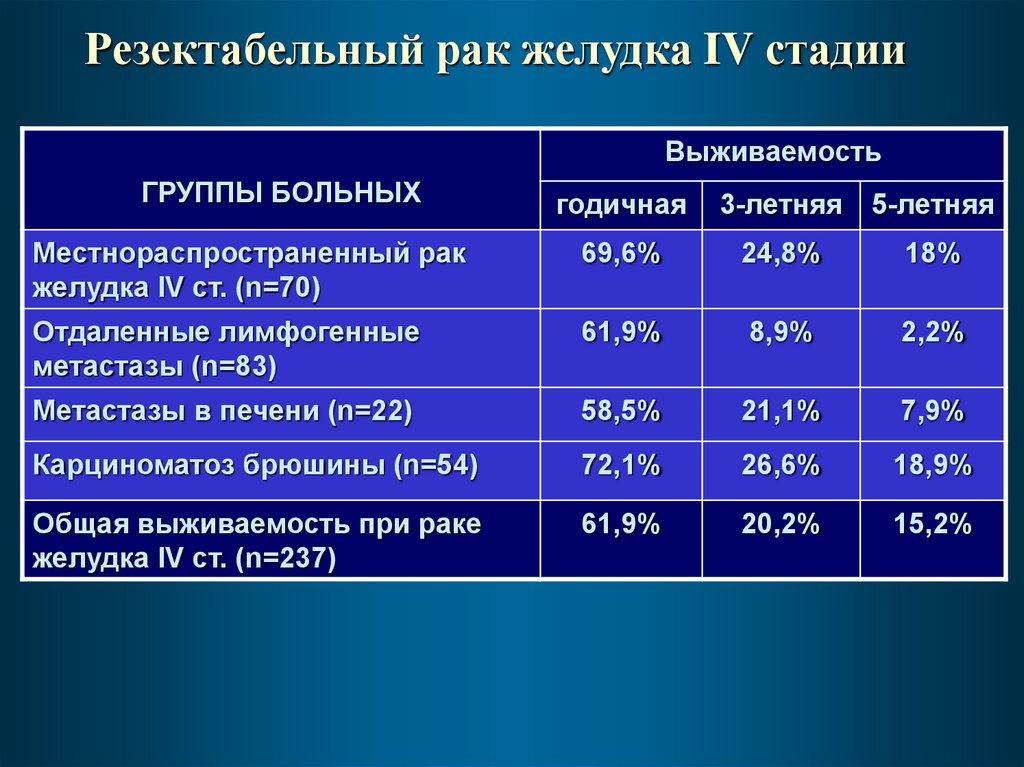
40.
Резектабельный рак желудка IV стадииВыживаемость
ГРУППЫ БОЛЬНЫХ
годичная
3-летняя 5-летняя
Местнораспространенный рак
желудка IV ст. (n=70)
69,6%
24,8%
18%
Отдаленные лимфогенные
метастазы (n=83)
61,9%
8,9%
2,2%
Метастазы в печени (n=22)
58,5%
21,1%
7,9%
Карциноматоз брюшины (n=54)
72,1%
26,6%
18,9%
Общая выживаемость при раке
желудка IV ст. (n=237)
61,9%
20,2%
15,2%
41.
Резектабельный рак желудка IV стадии1. Циторедуктивные операции показаны:
при местнораспространенном раке желудка IV стадии,
солитарном и единичных изолированных метастазах в печени
ограниченной диссеминации P1 при возможности выполнения
полной циторедукции R0.
2. После операции целесообразно проведение
полихимиотерапии.
3. При массивном карциноматозе, множественных отдаленных
метастазах, невозможности полной циторедукции R0 результаты
хирургического лечения неудовлетворительные. Операции
целесообразны только с паллиативной целью у больных с
осложненным течением рака.
42.
Адъювантная терапияРезультаты хирургического лечения
остаются малоудовлетворительными
Адъювантная лучевая терапия, снижая
частоту местных рецидивов, не улучшает
выживаемость
Адъювантная химиотерапия после
радикальных операций лишь незначительно
улучшает отдаленные результаты, что
подтверждено многочисленными
исследованиями
• Hermans et al, 1993, 11 исследований, n=2096
• Earle and Maroun, 1999, 13 исследований, n=1990
43.
Адъювантная терапияВ 2007 году опубликованы результаты Японского
рандомизированного исследования, изучавшего
эффективность адъювантной монохимиотерапии
новым пероральным химиопрепаратом из группы
фторпиримидинов – S-1
Препарат назначали перорально по 80 мг/кв.м в
день в течение года после радикальной операции при
раке желудка II-III стадий. Длительность одного
курса составляла 4 недели с 2 недельным перерывом.
Анализ отдаленных результатов показал
достоверное увеличение 3-летней выживаемости
больных, получавших адъювантную химиотерапию
препаратом S-1, с 70,1% до 80,1%.99
44. Периоперационная химиотерапия
Рандомизированное исследование MAGICЛечение включало в себя 3 курса неоадъювантной
химиотерапии по схеме ECF (эпирубицин, цисплатин,
5-ФУ) с последующей операцией и еще тремя курсами
химиотерапии по аналогичной схеме.
Исследование продемонстрировало достоверное
повышение 5-летней выживаемости с 23 до 36% в
группе комбинированного лечения.
D2 операции были произведены лишь у 40% больных,
а выживаемость даже в группе комбинированного
лечения была ниже, чем в исследованиях Dutch 1 и 2.
Cunningham D, Allum WH, Stenning SP, et al.
Perioperative chemotherapy versus surgery
alone for resectable gastroesophageal cancer.
N Engl J Med 2006;355:11-20
45.
Адъювантная химиолучевая терапияМежгрупповое рандомизированное исследование
(0116). 603 пациента с резектабельным раком
желудка
хирургия +адъвантная терапия
либо
только хирургия
Режим адъювантной терапии:
• 1 курс 5-ФУ 425 мг/м2 + лейковорин 20 мг/м2 х 5 дней из
28 дней
• лучевая терапия 45 Гр (1,8 Гр х 25 дней) +
5ФУ/лейковорин 400/20 мг/м2 в 1, 4, 23 и 25 дни облучения
• 2 курса химиотерапии 5-ФУ 425 мг/м2 + лейковорин 20
мг/м2 х 5 дней каждые 28 дней
46.
Адъювантная химиолучевая терапияЭффективность:
• безрецидивная 3-летняя выживаемость 49% против 32%
• 3-летняя выживаемость 52% против 41%
• медиана выживаемости 35 против 28 месяцев
Критический анализ исследования INT-0166 показал, что объем
хирургического лечения был неадекватным у большинства больных. Так
расширенная лимфаденэктомия D2 была выполнена лишь у 10%
больных, стандартная лимфаденэктомия D1 – 36%, а у 54% больных
объем лимфодиссекции характеризовался как D0.
На этом фоне частота местных рецидивов в группе только
хирургического лечения достигала 64%, что значительно хуже
результатов лечения рака желудка в Европе и Японии.
В группе больных, которым была выполнена лимфаденэктомия D2, не
было отмечено достоверного увеличения выживаемости в результате
комплексного лечения.
47. Адъювантная химиолучевая терапия
В исследование включено 990 больных.
Основная группа (544) – D2 операция + ХЛТ (схема
аналогична INT 0116), контроль – только D2 операция (446)
Результаты:
Показатель
операция + ХЛТ
операция
р
Общая выживаемость
57%
51%
0,02
II
76,2%
66,0%
0,04
IIIA
57,4%
42,3%
0,001
IIIB
39,6%
17,5%
0,004
IV (M0)
26,3%
11,3%
0,015
14,9%
21%
0,005
Местные рецидивы
Kim S., Lim DH., Lee J., et al. Int J
Radiat Oncol Biol Phys. 2005 Dec
1;63(5):1279-85
48.
Нерезектабельный местно-распространенныйрак желудка
В случае нерезектабельного рака желудка
или наличии явной остаточной опухоли
(нерадикальная резекция) наибольшую
эффективность имеет химиолучевое лечение
• Mayo Clinic Study: ЛТ/5-ФУ либо только ЛТ
• медиана выживаемости 12 против 5,9 месяцев
• GITSG, 1982: ЛТ/5-ФУ/Митомицин С либо
только 5ФУ/Митомицин С
• 4-летняя выживаемость 18% против 7%
Режим: 45Гр (1,8Гр 25 дней) + 5-FU/LCV 400/20мг/м2 1,4,23 и 25 день.
49.
Препараты, применяемые при лечении ракажелудка
5-фторурацил
митомицин С
Этопозид
Доксорубицин
Цисплатин
Новые препараты
Оксалиплатин
Иринотекан
Капецитабин
S1
Таксаны
50.
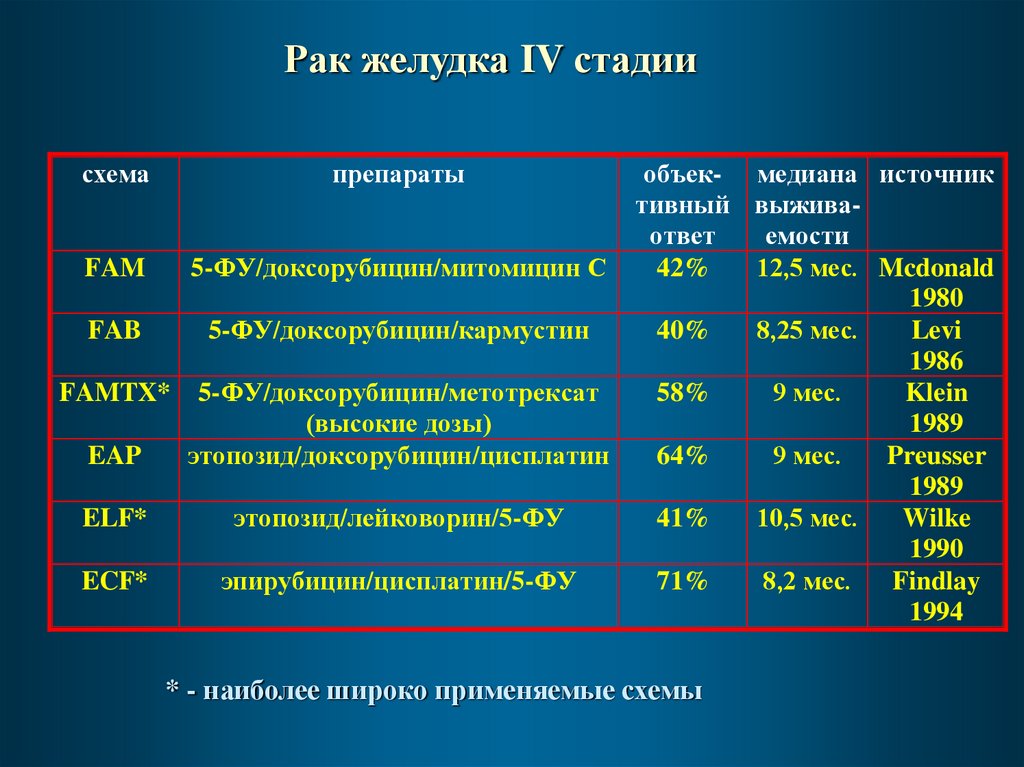
Рак желудка IV стадиисхема
препараты
объек- медиана источник
тивный выживаответ
емости
FAM
5-ФУ/доксорубицин/митомицин С
42%
12,5 мес. Mcdonald
1980
FAB
5-ФУ/доксорубицин/кармустин
40%
8,25 мес.
Levi
1986
FAMTX* 5-ФУ/доксорубицин/метотрексат
58%
9 мес.
Klein
(высокие дозы)
1989
EAP
этопозид/доксорубицин/цисплатин
64%
9 мес.
Preusser
1989
ELF*
этопозид/лейковорин/5-ФУ
41%
10,5 мес.
Wilke
1990
ECF*
эпирубицин/цисплатин/5-ФУ
71%
8,2 мес.
Findlay
1994
* - наиболее широко применяемые схемы
51.
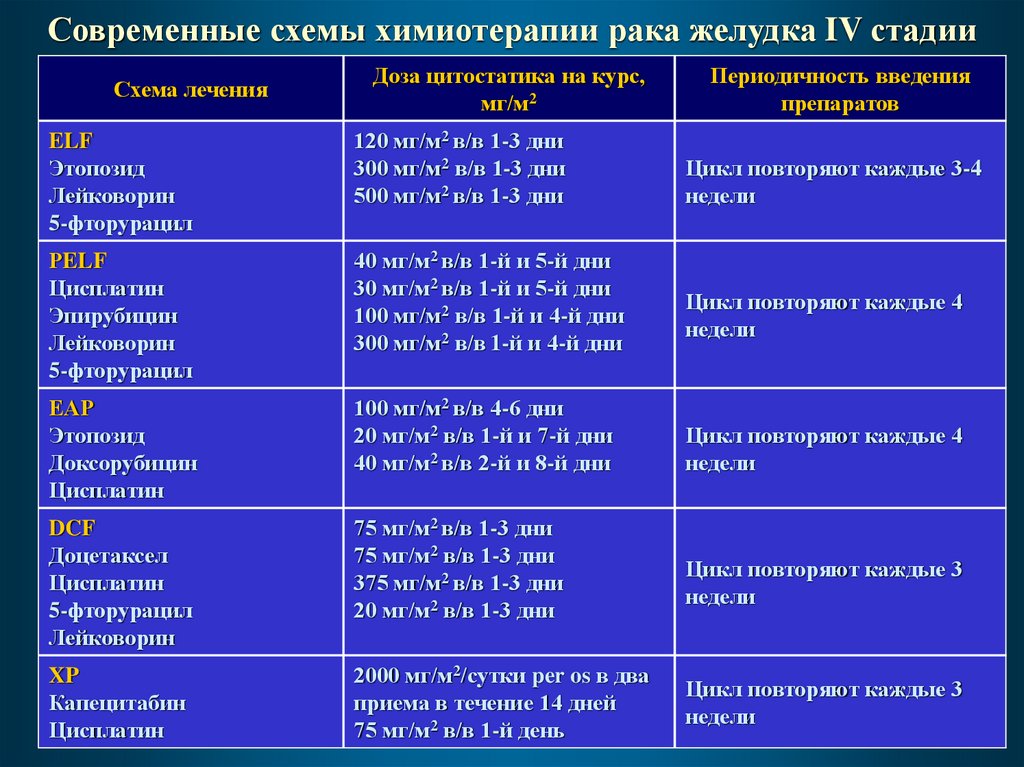
Современные схемы химиотерапии рака желудка IV стадииСхема лечения
Доза цитостатика на курс,
мг/м2
ELF
Этопозид
Лейковорин
5-фторурацил
120 мг/м2 в/в 1-3 дни
300 мг/м2 в/в 1-3 дни
500 мг/м2 в/в 1-3 дни
РELF
Цисплатин
Эпирубицин
Лейковорин
5-фторурацил
40 мг/м2 в/в 1-й и 5-й дни
30 мг/м2 в/в 1-й и 5-й дни
100 мг/м2 в/в 1-й и 4-й дни
300 мг/м2 в/в 1-й и 4-й дни
ЕАР
Этопозид
Доксорубицин
Цисплатин
100 мг/м2 в/в 4-6 дни
20 мг/м2 в/в 1-й и 7-й дни
40 мг/м2 в/в 2-й и 8-й дни
DCF
Доцетаксел
Цисплатин
5-фторурацил
Лейковорин
75 мг/м2 в/в 1-3 дни
75 мг/м2 в/в 1-3 дни
375 мг/м2 в/в 1-3 дни
20 мг/м2 в/в 1-3 дни
XP
Капецитабин
Цисплатин
2000 мг/м2/сутки per os в два
приема в течение 14 дней
75 мг/м2 в/в 1-й день
Периодичность введения
препаратов
Цикл повторяют каждые 3-4
недели
Цикл повторяют каждые 4
недели
Цикл повторяют каждые 4
недели
Цикл повторяют каждые 3
недели
Цикл повторяют каждые 3
недели


































 medicine
medicine








