Similar presentations:
Основные понятия химии
1. Основные понятия химии
Преподаватель Юридического колледжаВалентина Владимировна Киреева
2.
РЕМОНТХимия – это наука о составе,
строении, свойствах и
превращениях веществ.
Цели химии:
изучение строения соединений;
синтез новых веществ с заданными
свойствами;
анализ химических соединений.
3.
РЕМОНТОсновные
понятия
химии
4.
РЕМОНТЗадачи: закрепить основные
понятия химии, вспомнить
алгоритм
составления
химических формул и решения
задач на количество вещества.
5.
РЕМОНТВещество – один из видов
материи,
который
характеризуется массой покоя.
Это
совокупность
атомов,
ионов или молекул, состоящих
из одного или нескольких
химических элементов.
6.
РЕМОНТДемокрит:
Ничего не существует, кроме
атомов и пустоты.
Атомы представляют собой
абсолютно
плотные,
неделимые, обладающие весом,
формой и величиной частицы.
7.
РЕМОНТДж. Дальтон:
Все вещества состоят из очень
маленьких частиц — атомов.
В процессе химических
превращений атомы
не разрушаются и не возникают
вновь, а только переходят из
одних веществ в другие
8.
РЕМОНТАтомы – это
мельчайшие,
химически
неделимые
частицы, электронейтральные,
состоящие из положительно
заряженного
ядра
и
отрицательно заряженных
электронов
9.
РЕМОНТ10.
РЕМОНТМассы атомов, выраженные в
кг или г, - абсолютные атомные
массы (m0).
Они очень малы.
Абсолютная атомная масса
водорода:
m0 (Н) = 1,67 10 -24 г
11.
РЕМОНТОтносительные атомные массы (Аr):
а.е.м. (атомная единица массы) =
1/12 m0 (С) = 1,66 10 -24 г
Аr = m0 /а.е.м.
Аr (Н) = 1,67 10 -24 г/ 1,66 10 -24 г =1,008
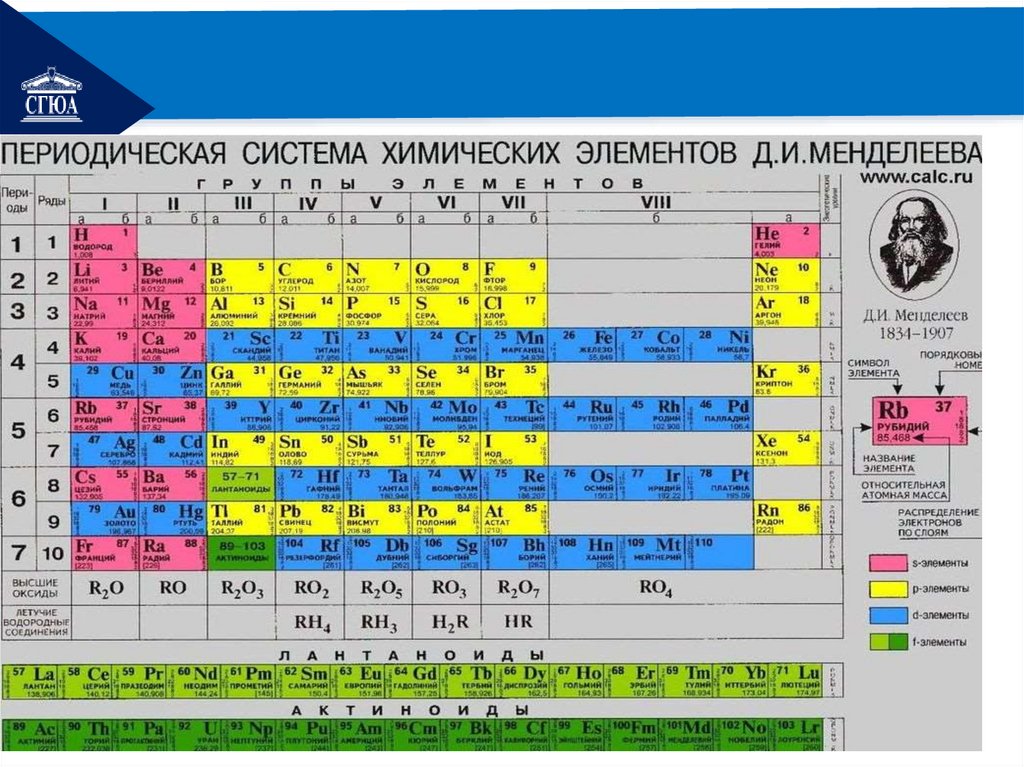
В ПСХЭ указаны относительные атомные массы
химических элементов.
Относительная атомная масса не имеет единиц
измерения, она показывает, во сколько раз масса данного
атома больше а.е.м. .
12.
РЕМОНТВ природе встречаются 3 вида
атомов водорода
1Н
2Н
3Н
+1
+1
+1
Что у них общего и чем они
отличаются?
13.
РЕМОНТХимический элемент – это
определенный вид атомов с
одинаковым зарядом ядра
14.
РЕМОНТ2
15.
РЕМОНТ14А
+7
+6
14В
12С
+7
Определите какие атомы относятся
к одному химическому элементу?
16.
РЕМОНТИзотопы
(от
др.-греч.
«одинаковый»,
«место»)
разновидности
атомов
какоголибо химического элемента, которые
имеют одинаковый заряд ядра, но
разные массовые числа.
17.
РЕМОНТМолекула (маленькая масса) – это
наименьшая частица данного вещества,
обладающая
его
химическими
свойствами.
18.
РЕМОНТСостав любой молекулы можно выразить
химической формулой.
Химическая формула — это условная
запись состава вещества с помощью
химических знаков и индексов.
Качественный состав показывается с
помощью символов химических элементов, а
количественный — с помощью индексов.
19.
РЕМОНТФормулы вещества составляют на
основании валентности.
Валентность – это способность
атомов химических элементов образовывать
определённое число химических связей
(или способность атомов химических
элементов присоединять
определённое
число атомов водорода)
20.
РЕМОНТНекоторые атомы имеют постоянную
валентность.
Валентность водорода - I.
Валентность кислорода - II.
Металлы основной подгруппы первой
группы всегда имеют валентность I,
второй – II, третьей – III.
Валентность пишется над знаком
элемента римскими цифрами.
21.
РЕМОНТ2
22.
РЕМОНТАлгоритм составления формулы
1. Написать символы элементов
2. Определить валентности элементов
3. Найти наименьшее общее кратное численных
значений валентностей
4. Найти число атомов элементов путем деления
найденного наименьшего кратного на
соответствующие валентности элементов
5. Записать индексы при символах элементов
23.
РЕМОНТНапример, составим формулу оксида натрия:
I
II
NaхOу
Находим наименьшее общее кратное численных
значений валентностей:
2*1 = 2.
Определяем
число
атомов
данного
элемента в формуле (индексы): наименьшее
общее кратное делим на валентность элемента
х=2 :1=2
у=2:2=1
Записываем формулу Na2O
24.
РЕМОНТОксид серы (ΙV)
ΙV II
S O
Наименьшее общее кратное – 4
Число атомов серы 4 :4 = 1
Число атомов кислорода 4 : 2 = 2
Формула SO2
25.
Составьте химическую формулу• оксида хлора (VI)
• оксида алюминия
• Водородного соединения азота (III)
26.
РЕМОНТОтносительная молекулярная
масса ( Мr) – сумма
относительных атомных масс всех
атомов, входящих в состав
вещества с учетом их индексов.
Найдите относительную
молекулярную массу Вa3(PO4)2
27.
РЕМОНТ2
28.
РЕМОНТНаходим в таблице Менделеева
относительные атомные массы
химических элементов, входящих в
состав молекулы:
Вa – 137,
P- 31,
O -16.
Мr(Вa3(PO4)2) = 3 137 + (31+16 4) 2 =
411 +190 = 601
29.
РЕМОНТИон - электрически
заряженная частица вещества,
которая образуется
из атома или молекулы, когда они
отдают или
присоединяют
один или несколько
электронов.
30.
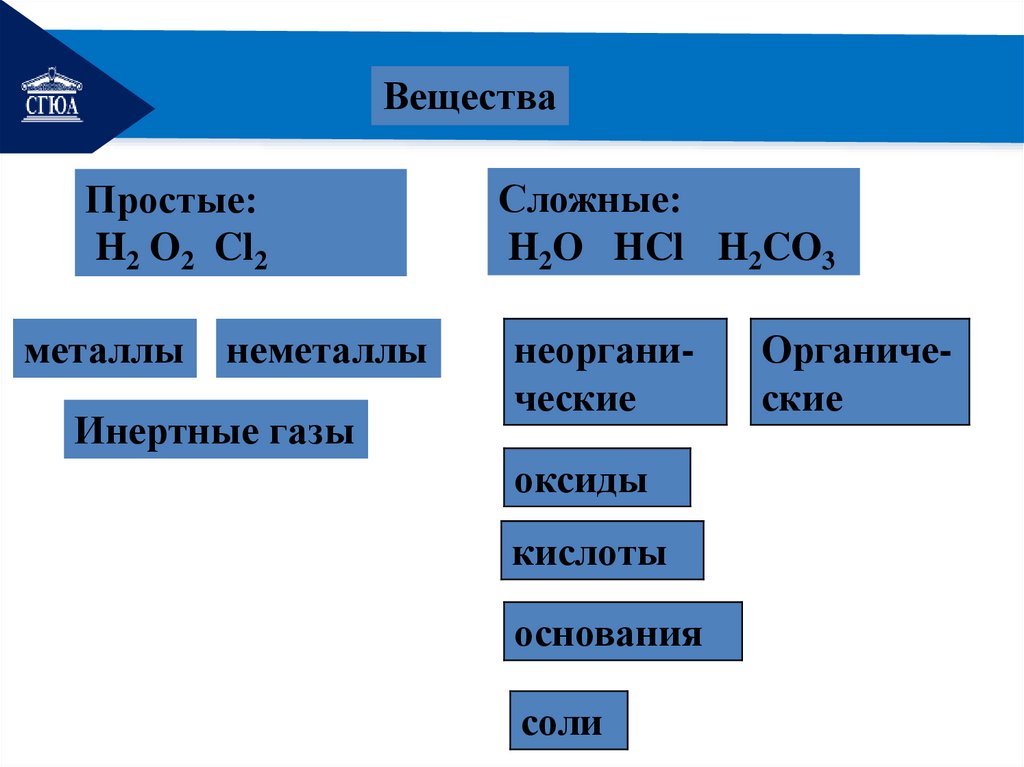
РЕМОНТКлассификация веществ
31.
РЕМОНТВещества
Простые:
H2 O2 Cl2
металлы
неметаллы
Инертные газы
Сложные:
H2O HCl H2CO3
неорганические
оксиды
кислоты
основания
соли
Органические
32.
РЕМОНТХимические реакции – это процессы,
в результате которых из одних
веществ (реагентов) образуются
другие (продукты реакции),
отличающиеся от исходных по
составу или строению.
33.
РЕМОНТКоличество вещества (n) - число
частиц вещества (атомов, молекул, ионов).
Единица
измерения
количества
вещества – моль.
Моль - такое его химическое
количество вещества, которая содержит
столько же структурных единиц, сколько
атомов содержится в углероде массой
0,012 кг.
34.
РЕМОНТ1 моль любого вещества содержит
6,02 1023
атомов или молекул
(число Авогадро Na)
Na = 6,02 1023 моль-1
35.
РЕМОНТМолярная масса (М)- физическая
величина, которая показывает
массу одного моля вещества.
М = т/n (г/моль)
Численно равна его
относительной молекулярной
массе (М = Мr).
36.
РЕМОНТДля расчёта количества вещества
n= m / М
n =N / Na
M – молярная масса
m – масса вещества
N – общее число молекул
Na – число Авогадро
37.
РЕМОНТЗная количество вещества,
можно найти:
массу вещества –
m=nМ
общее число молекул вещества –
N = n Na
38.
РЕМОНТЗадание
1. Найдите количество Ca(OH)2 в
1,48 г. Найдите число молекул в
этой массе Ca(OH)2
39.
Алгоритм решения задач:1. записать условие задачи: определить,
что известно, что нужно найти;
2. записать необходимые для решения
задачи формулы;
3. найти молярную массу вещества;
4. решить задачу, подставляя данные в
соответствующие формулы;
5. записать ответ.
40.
РЕМОНТ1. Записываем условие задачи:
m(Ca(OH)2 ) = 1,48 г
n - ? N-?
41.
РЕМОНТРешение
1. Записываем
необходимые
формулы:
n = m / М – для нахождения
количества вещества
N = n Na – для нахождения числа
молекул вещества.
42.
РЕМОНТ1. Находим молярную массу
гидроксида кальция:
М((Ca(OH)2) = 40+(16+1) 2 =
74г/моль
43.
РЕМОНТ2. Находим количество вещества:
n = 1,48 г : 74 г/моль= 0,02 моль
44.
РЕМОНТ3. Находим число молекул по
формуле:
N = 0,02 моль 6 1023 =0,12 1023
молекул
Ответ: n = 0,02 моль
N =0,12 1023 молекул
45.
РЕМОНТЗадание
Масса порции простого вещества,
содержащей 2,4 • 1024 молекул, равна 8
г. Определите молярную массу
данного вещества и назовите его.
46.
РЕМОНТ1. Записываем условие задачи:
m(Х2 ) = 8 г
N = 2,4 • 1024 молекул
M(Х2 ) =?
47.
РЕМОНТРешение
1. Записываем
необходимые
формулы:
М = m / n – для нахождения молярной
массы
n = N / Na - для нахождения
количества вещества
48.
РЕМОНТ1. Находим количество вещества:
n = 2,4 • 1024 молекул : 6 • 1023 = 4 моль
2. Находим молярную массу вещества:
М(Х2) = 8г : 4 моль = 2 г/моль
3. Относительная молекулярная масса
численно равна молярной:
Мr(Х2) = 2.
4. Находим относительную атомную массу:
А r(Х) = 2 : 2 = 1.
Такую массу имеет атом водорода.
Ответ: М(Н2) = 2 г/моль
49.
РЕМОНТЗадание
1. Найдите количество Na2 CO3 в
21,2 г.
2. Найдите число молекул в этой
массе Na2 CO3 .
50.
СПАСИБО ЗАВНИМАНИЕ!














































 chemistry
chemistry








