Similar presentations:
Технология рекомбинантных ДНК. (Лекция 1)
1.
Лекция 1.Технология
рекомбинантных
ДНК.
2.
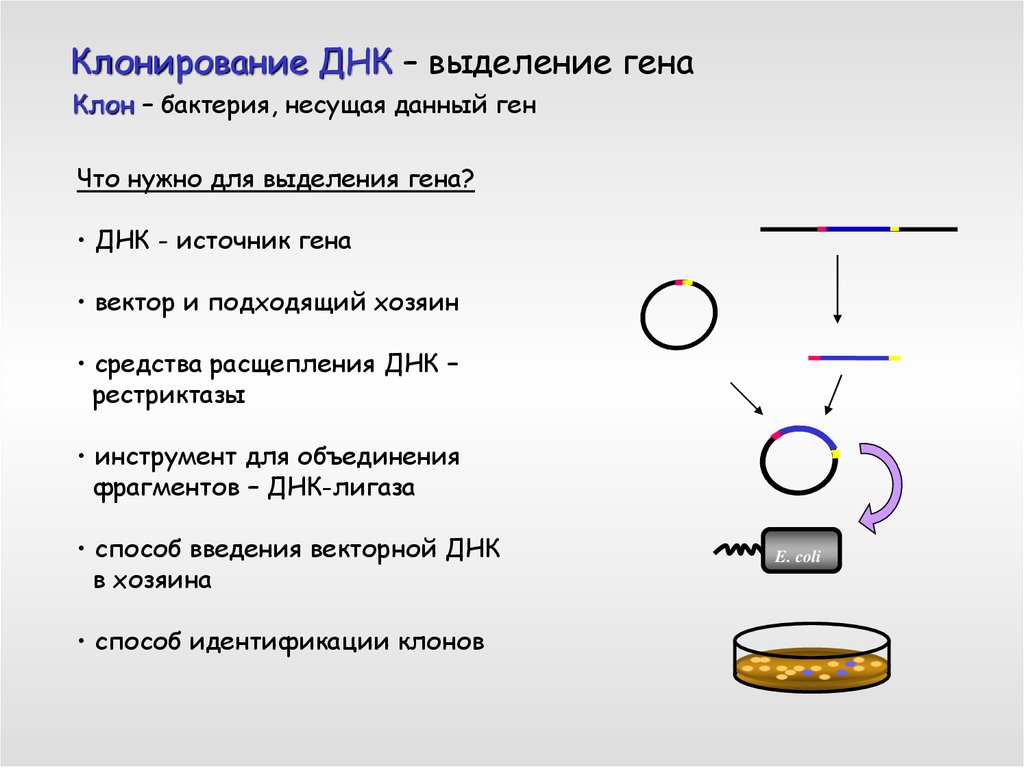
Клонирование ДНК – выделение генаКлон – бактерия, несущая данный ген
Что нужно для выделения гена?
• ДНК - источник гена
• вектор и подходящий хозяин
• средства расщепления ДНК –
рестриктазы
• инструмент для объединения
фрагментов – ДНК-лигаза
• способ введения векторной ДНК
в хозяина
• способ идентификации клонов
E. coli
3.
4.
Рестриктазы – специфические эндонуклеазы(более 900 ферментов изолировано из 230 штаммов бактерий)
Сайты расщепления двуспиральной ДНК
тремя разными рестриктазами второго типа:
«липкие» концы,
5’-overhang
(5’-конец длиннее)
«липкие» концы,
3’-overhang
(3’-конец длиннее)
невозможно пометить
«тупые» концы
Защита бактериального генома; метилирование; клонирование
5.
Электрофорез ДНК: 1. разделение молекул по размеруподвижность молекул ДНК зависит
от плотности агарозного геля
концентрация агарозы
В геле присутствует бромистый этидий,
который интеркалирует в ДНК; комплекс
флюоресцирует при 590 нм.
6.
Бромистый этидий (3,8-Диамино5-этил-6-фенилфенантридиум бромид, EtBr,Ethidium bromide)- интеркалирующий агент
Бромид этидия интеркалирует в ДНК,
уменьшая спирализацию ~ на 26°,
разворачивает двойную спираль
7.
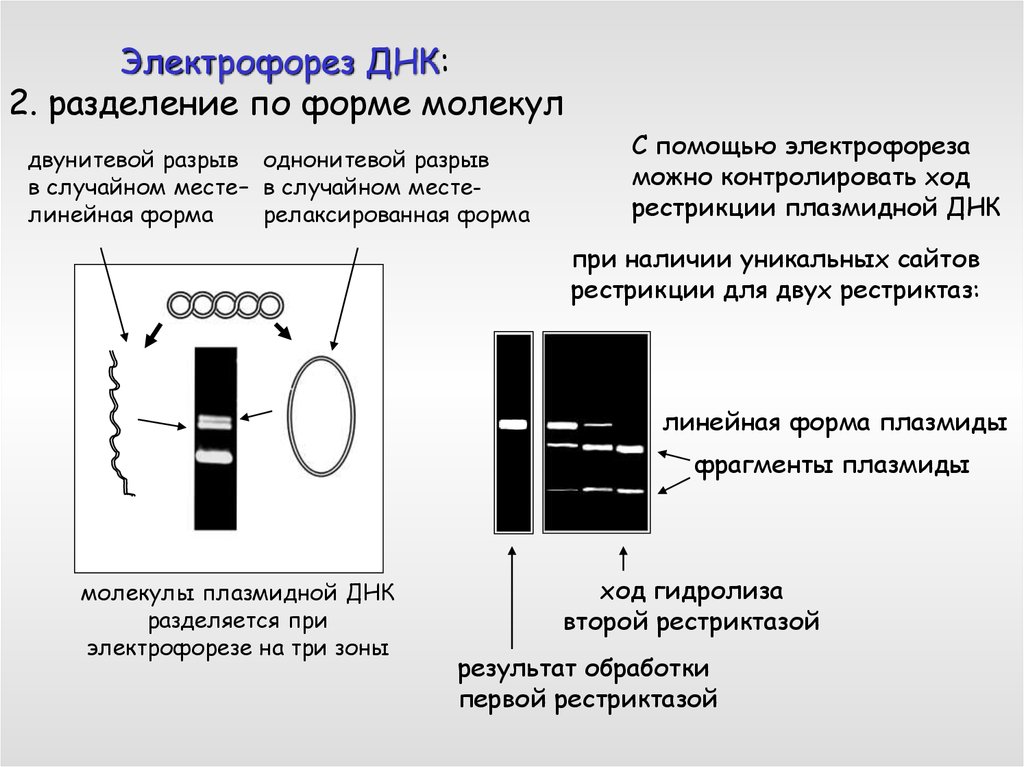
Электрофорез ДНК:2. разделение по форме молекул
двунитевой разрыв однонитевой разрыв
в случайном месте– в случайном местелинейная форма
релаксированная форма
С помощью электрофореза
можно контролировать ход
рестрикции плазмидной ДНК
при наличии уникальных сайтов
рестрикции для двух рестриктаз:
линейная форма плазмиды
фрагменты плазмиды
молекулы плазмидной ДНК
разделяется при
электрофорезе на три зоны
ход гидролиза
второй рестриктазой
результат обработки
первой рестриктазой
8.
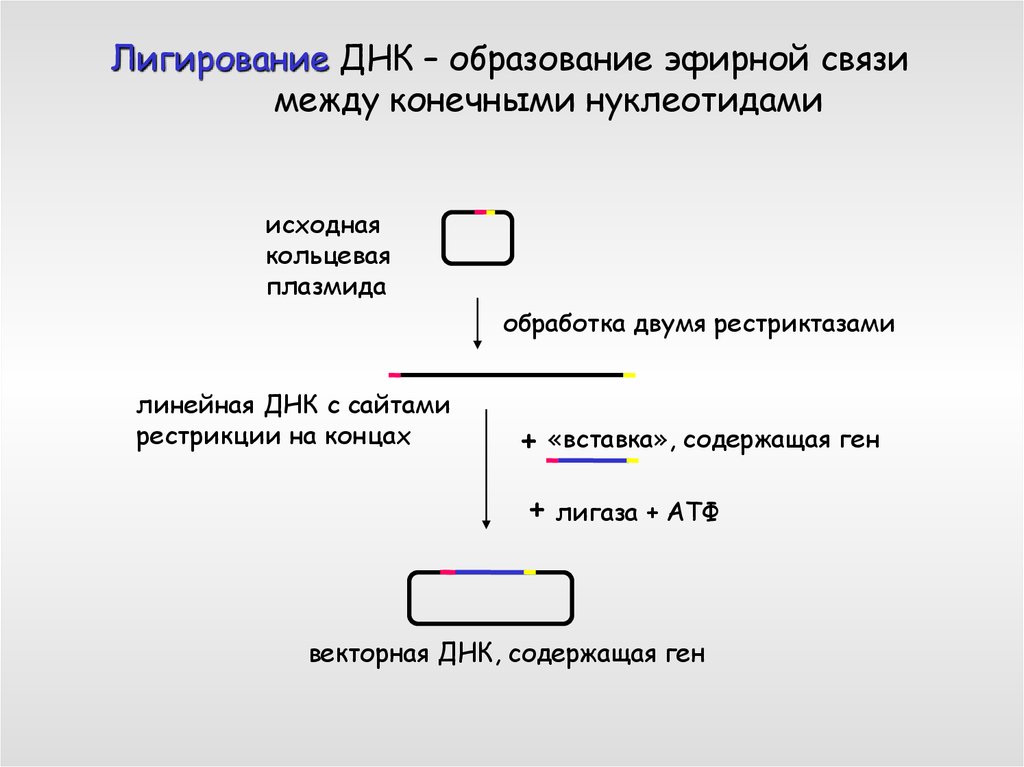
Лигирование ДНК – образование эфирной связимежду конечными нуклеотидами
исходная
кольцевая
плазмида
обработка двумя рестриктазами
линейная ДНК с сайтами
рестрикции на концах
+
«вставка», содержащая ген
+ лигаза + АТФ
векторная ДНК, содержащая ген
9.
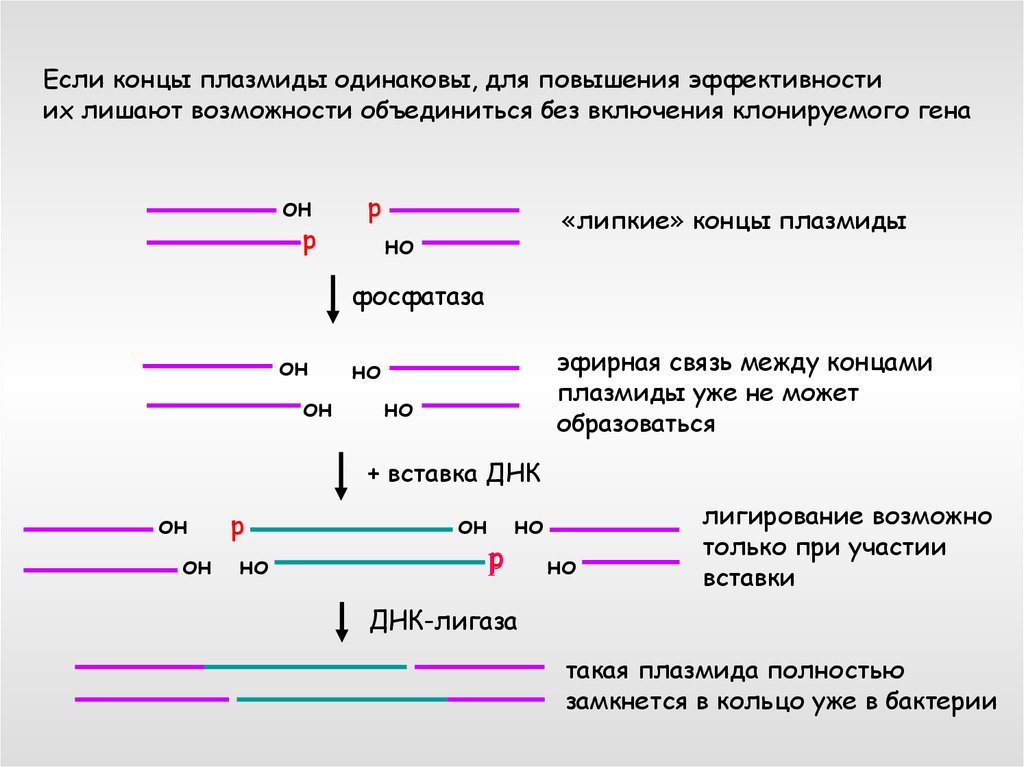
Если концы плазмиды одинаковы, для повышения эффективностиих лишают возможности объединиться без включения клонируемого гена
он
р
р
«липкие» концы плазмиды
но
фосфатаза
он
он
эфирная связь между концами
плазмиды уже не может
образоваться
но
но
+ вставка ДНК
он
он
р
но
он
р
но
но
лигирование возможно
только при участии
вставки
ДНК-лигаза
такая плазмида полностью
замкнется в кольцо уже в бактерии
10.
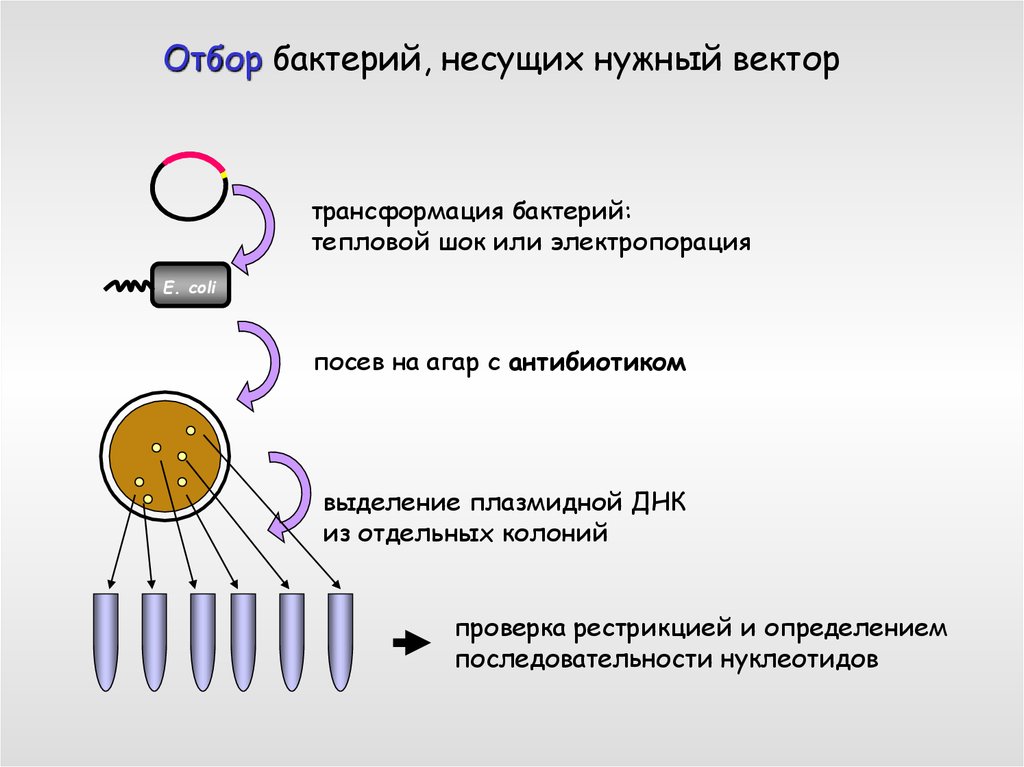
Отбор бактерий, несущих нужный вектортрансформация бактерий:
тепловой шок или электропорация
E. coli
посев на агар с антибиотиком
выделение плазмидной ДНК
из отдельных колоний
проверка рестрикцией и определением
последовательности нуклеотидов
11. Отбор бактерий: ферментная система (бело-голубая селекция)
• MCS плазмиды находится внутрипоследовательности lacZ’, кодирующей
N-концевой пептид β-галактозидазы, но
не мешает образованию фермента после
объединения с С-концевым пептидом.
Растут голубые колонии. Однако
клонирование в MCS нарушает рамку
считывания N-концевого пептида, βгалактозидаза не образуется, растут
белые колонии.
• Индукцию lac-оперона осуществляют с
помощью ИПТГ (изопропил-β-D-1тиогалактопиранозид), аналога
аллолактозы, метаболита лактозы.
12.
13.
X-gal5-бромо-4-хлоро-3индолил-β-Dгалактопиранозид
β- галактозидаза
5-бромо-4-хлорогидроксииндол
галактоза
окисление
5,5’-дибромо-4,4’-дихлоро-индиго - нерастворимое соединение голубого цвета
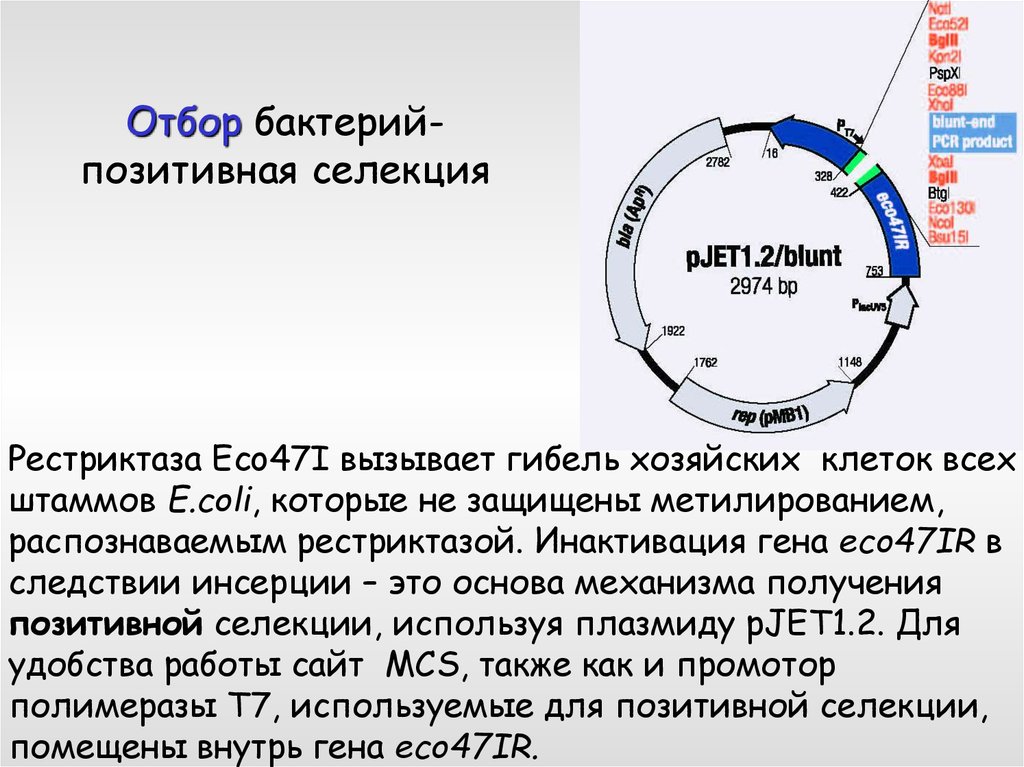
14. Отбор бактерий- позитивная селекция
Отбор бактерийпозитивная селекцияРестриктаза Eco47I вызывает гибель хозяйских клеток всех
штаммов E.coli, которые не защищены метилированием,
распознаваемым рестриктазой. Инактивация гена еco47IR в
следствии инсерции – это основа механизма получения
позитивной селекции, используя плазмиду pJET1.2. Для
удобства работы сайт MCS, также как и промотор
полимеразы Т7, используемые для позитивной селекции,
помещены внутрь гена еco47IR.
15.
Векторная ДНК:• автономная репликация в бактериях или дрожжах
• устойчивость к антибиотику
• удобные сайты рестрикции (MCS)
Размер вставки, которую могут переносить:
- плазмиды - до 10 тыс. пар оснований (п.о.)
- вирусы (фаги) - до 25 тыс. п.о.
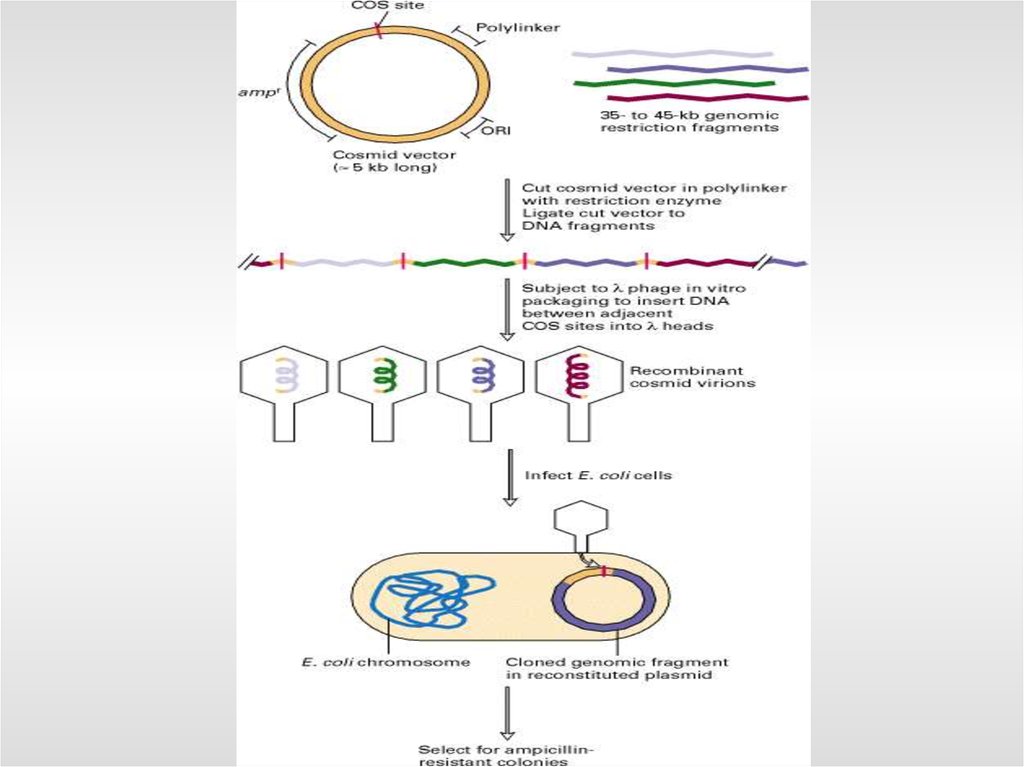
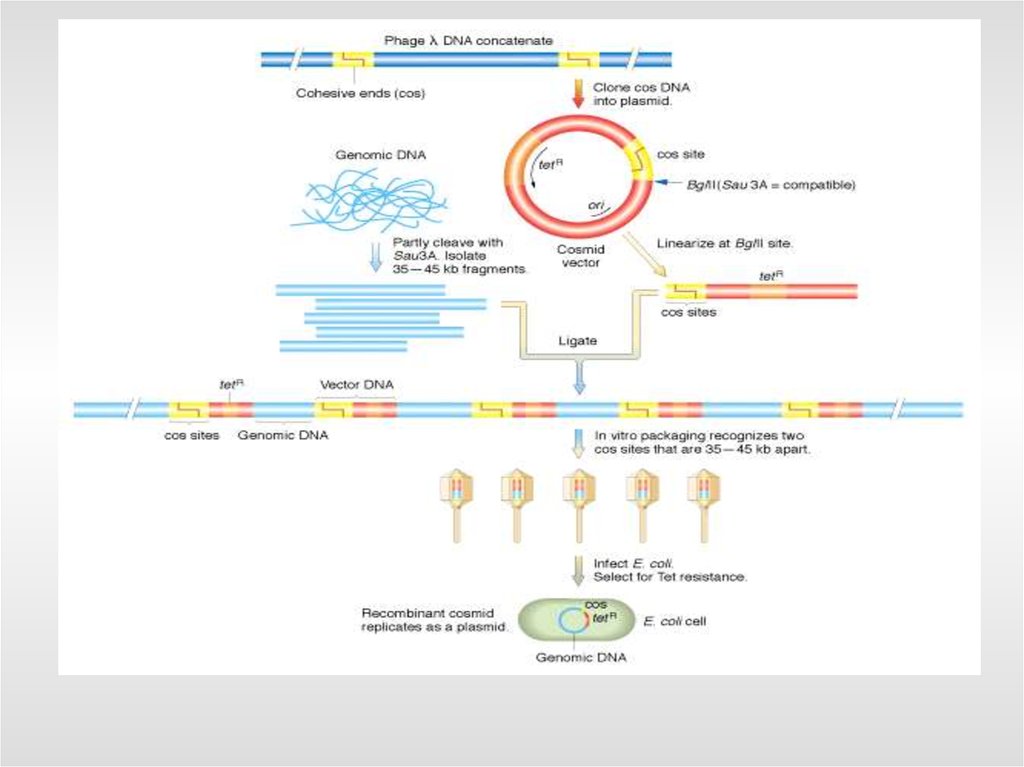
- космиды - в среднем 45 тыс. п.о.
- бактериальные искусственные хромосомы – до 300 тыс.п.о.
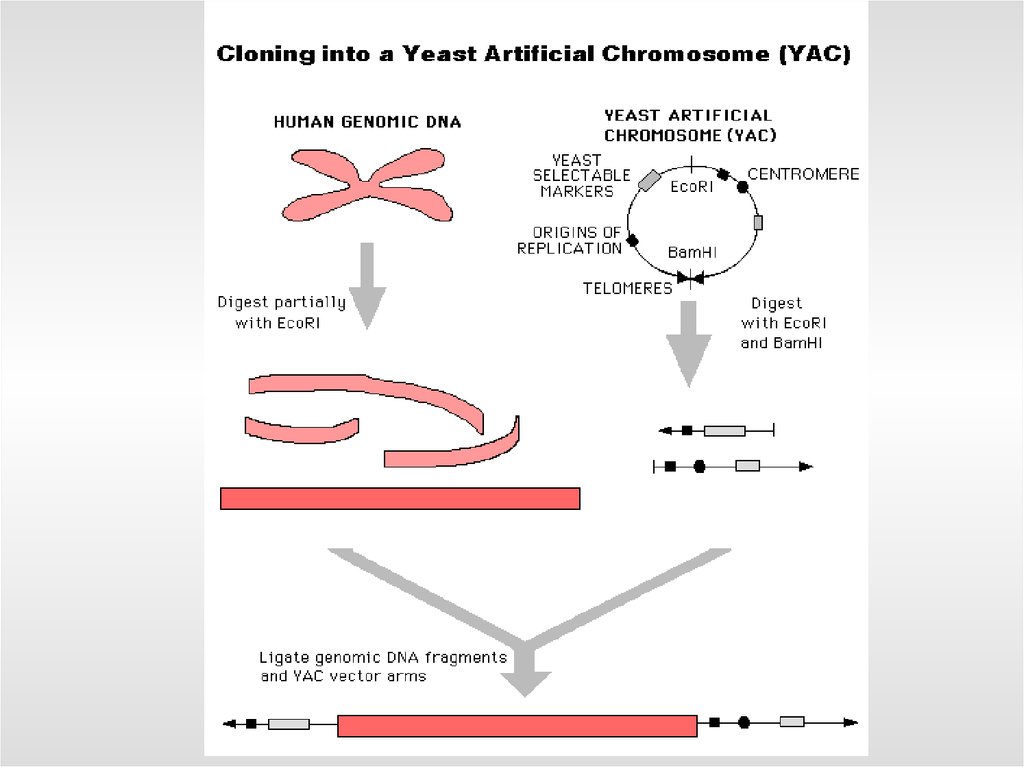
- дрожжевые искусственные хромосомы - до 1 млн. п.о.
16.
17.
18.
Получение геномной библиотекиген 1
ген 3
ген 2
рестриктазы
встраивание в разрезанный вектор
трансформация
бактерий
смесь
клонов
ген 1
ген 2
ген 3
19.
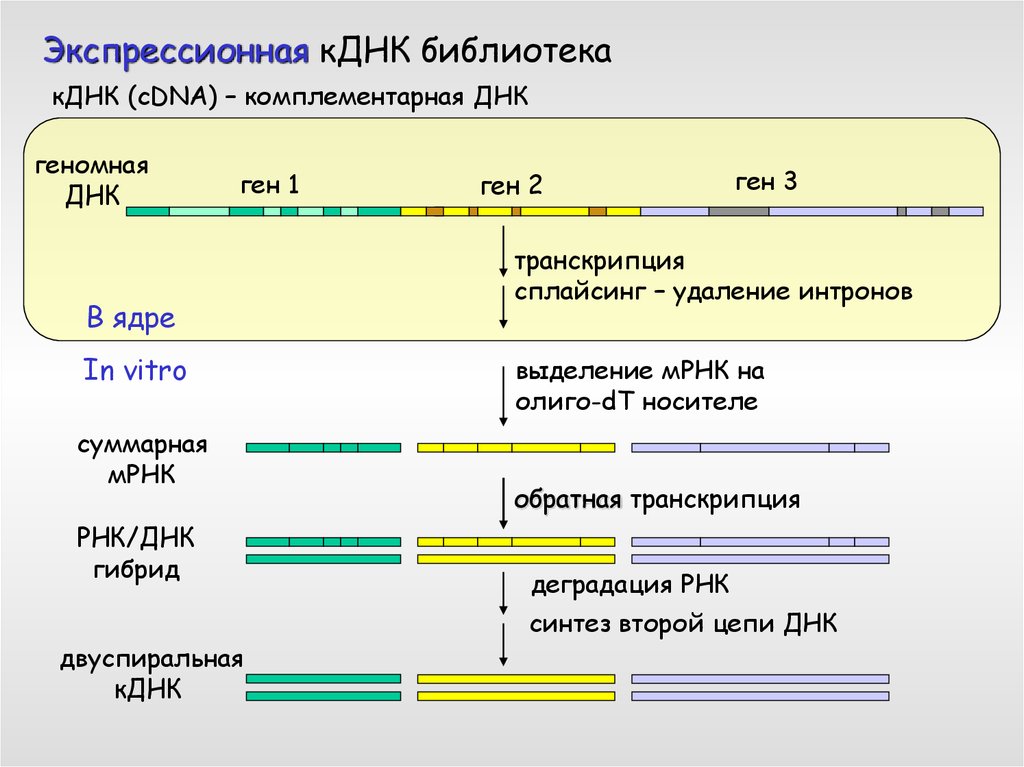
Экспрессионная кДНК библиотекакДНК (cDNA) – комплементарная ДНК
геномная
ДНК
ген 1
В ядре
In vitro
суммарная
мРНК
РНК/ДНК
гибрид
двуспиральная
кДНК
ген 2
ген 3
транскрипция
сплайсинг – удаление интронов
выделение мРНК на
олиго-dT носителе
обратная транскрипция
деградация РНК
синтез второй цепи ДНК
20.
кДНК с «тупыми»концами
присоединение «липких»
концов
кДНК с «липкими»
концами
лигирование в
разрезанный вектор
трансформация
бактерий
смесь
клонов
ген 1
ген 2
ген 3
21.
Сравнение геномной и экспрессионной библиотек:- все равно из какой ткани
выделена ДНК
- не все равно из каких клеток и в
каком состоянии выделена мРНК,
поэтому важно подобрать выгодный
источник и контролировать условия
- представительство данного гена
зависит от числа его копий в
геноме
- представительство данного гена
зависит от уровня его экспрессии
- только малая часть генома
млекопитающих кодирует белки
(1,5% генома человека)
- все молекулы в библиотеке
кодируют белки
- интроны сильно увеличивают
размер вставок: ни бактерии, ни
дрожжи не смогут осуществить
сплайсинг
- выделенная ДНК будет содержать
непрерывную кодирующую
последовательность – открытую рамку
считывания
22.
Дрожжевая дигибридная система –средство поиска белков-партнеров
Метод основан на использовании одного из транскрипционных
факторов дрожжевой клетки:
Транскрипционный фактор
ДНК-связывающий
домен
Активационный
домен
ген-репортер
ДНК
участок
связывания
транскрипция
белок-репортер
Связываясь с ДНК, фактор активирует транскрипцию гена,
кодирующего белок, присутствие которого легко обнаружить
23.
В дрожжевые клетки вводят два вида плазмид:белок-«наживка»,
слитый с ДНКсвязывающим
доменом
белки, кодируемые
клонами кДНК
экспрессионной
библиотеки, слитые
с активационным
доменом
(один белок на клетку)
При наличии специфического взаимодействия в колониях-клонах
обнаруживается белок-репортер:
колонии дрожжей, содержащие
белок-репортер, изолируют для
выделения ДНК и идентификации
партнера
24.
Фаговый дисплей – еще один способ поискабелков-партнеров на основе библиотеки кДНК:
кДНК из экспрессионной библиотеки встраивают
в нитевидный фаг (M13, fd) в область гена,
кодирующего также белок его оболочки
инфекция в бактерии
размножение фагов
секреция фагов из клеток
суспензия фаговых частиц, несущих на
поверхности белки библиотеки, слитые с
белком оболочки (фьюжн-белки)
25.
инкубация фагов симмобилизовананным
белком-«мишенью»
повторный
отбор
инфекция и
амплификация
элюция буфером,
содержащим
белок-«мишень»
размножение фага
с отобранной кДНК
в бактериях
26.
Гибридизация нуклеиновых кислотДНК
плавление при
нагревании
отжиг с ДНК
tº
отжиг при
охлаждении
отжиг с РНК
гибридные молекулы
27.
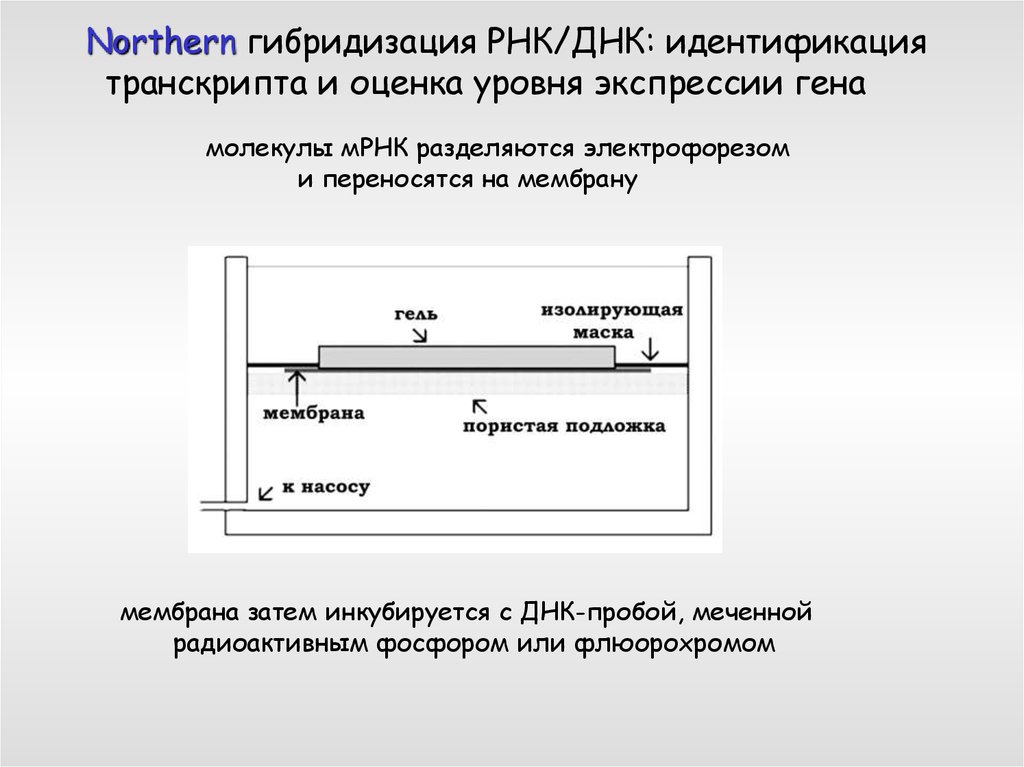
Northern гибридизация РНК/ДНК: идентификациятранскрипта и оценка уровня экспрессии гена
молекулы мРНК разделяются электрофорезом
и переносятся на мембрану
мембрана затем инкубируется с ДНК-пробой, меченной
радиоактивным фосфором или флюорохромом
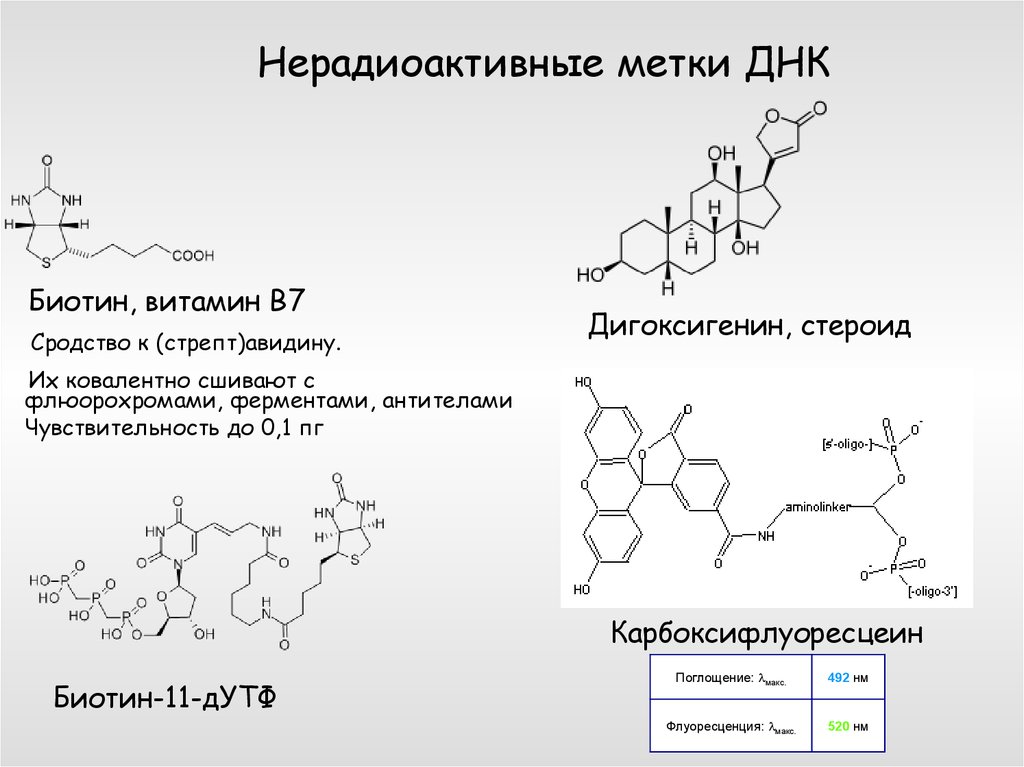
28. Нерадиоактивные метки ДНК
Биотин, витамин В7Сродство к (стрепт)авидину.
Дигоксигенин, стероид
Их ковалентно сшивают с
флюорохромами, ферментами, антителами
Чувствительность до 0,1 пг
Карбоксифлуоресцеин
Биотин-11-дУТФ
Поглощение: lмакс.
492 нм
Флуоресценция: lмакс.
520 нм
29.
Southern гибридизация (гибридизация по Саузерну):детекция специфической ДНК
- в бактериальной колонии:
мембрана
- или в препарате ДНК:
так же, как при Northern
гибридизации
реплика
лизис бактерий, фиксирование и
денатурация ДНК
инкубация с меченой пробой
проявление автографа
30.
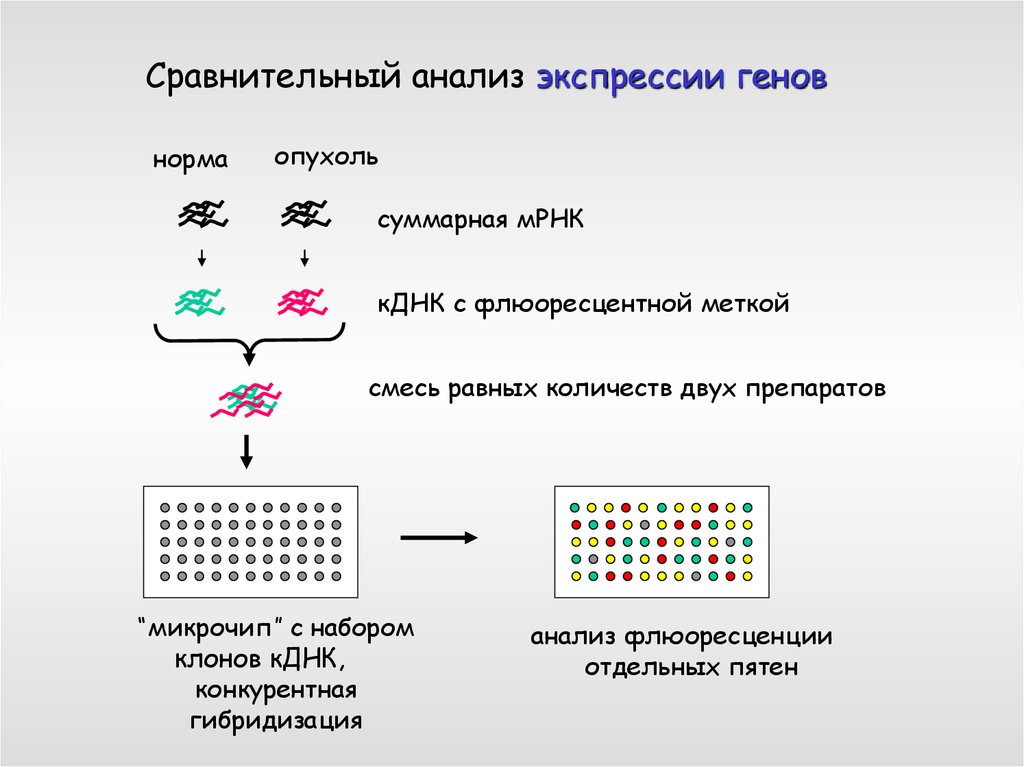
Сравнительный анализ экспрессии геновнорма
опухоль
суммарная мРНК
кДНК с флюоресцентной меткой
смесь равных количеств двух препаратов
“микрочип” с набором
клонов кДНК,
конкурентная
гибридизация
анализ флюоресценции
отдельных пятен
31.
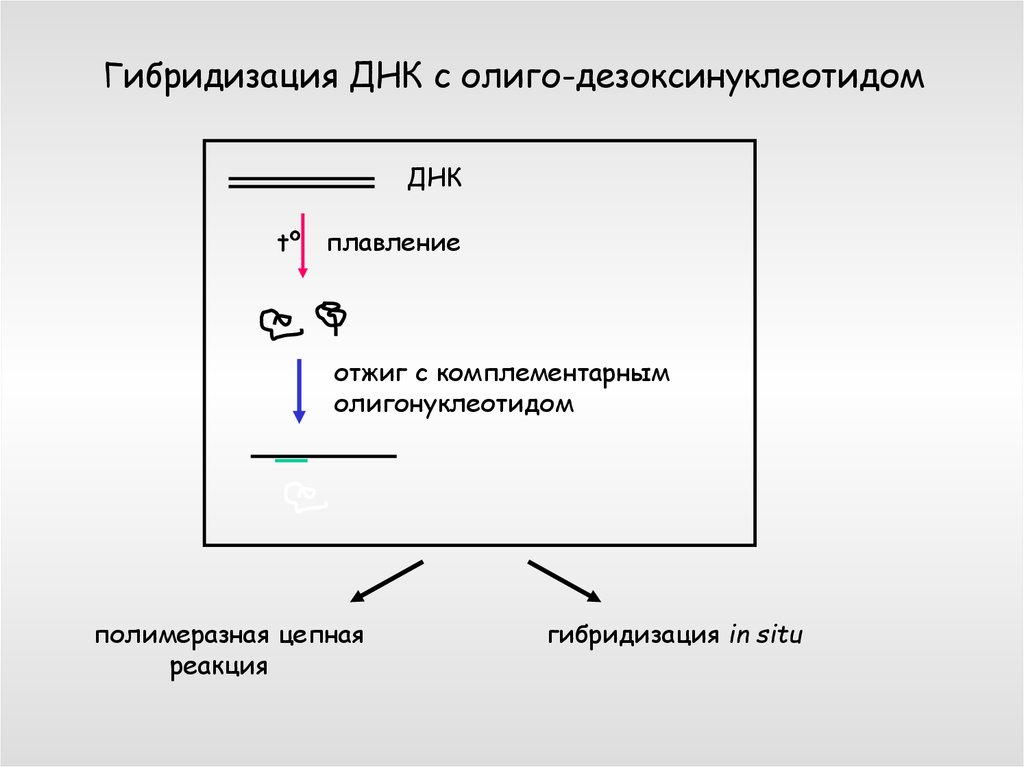
Гибридизация ДНК с олиго-дезоксинуклеотидомДНК
tº плавление
отжиг с комплементарным
олигонуклеотидом
полимеразная цепная
реакция
гибридизация in situ
32.
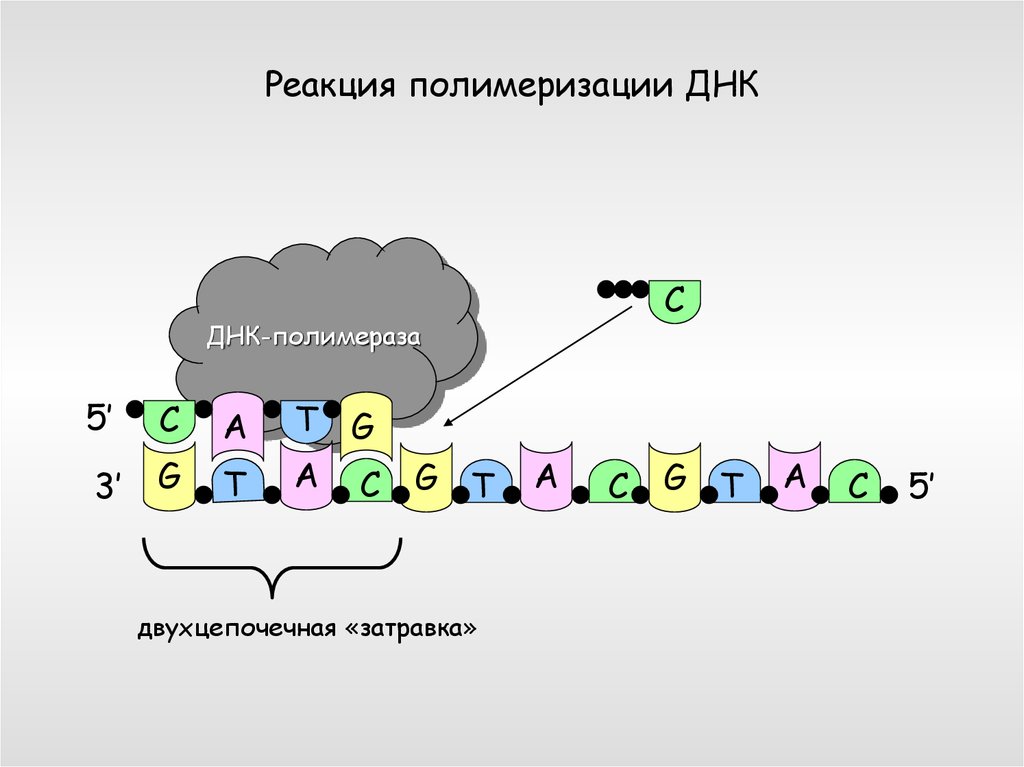
Реакция полимеризации ДНКC
ДНК-полимераза
5’
C
A
3’
G
T
T G
A C
G T
двухцепочечная «затравка»
A
C
G T
A
C
5’
33.
Главный компонент PCR: ДНК-полимеразаДНК-полимераза I из Escherichia coli – деградирует при 37º
Taq-полимераза из Thermus aquaticus – термостабильна, работает быстро,
но не исправляет ошибки при синтезе новой цепи (ок. 28 ошибок/106,
скорость 1000 нуклеотидов/мин). Имеет 5’-3’-экзонуклеазную активность.
Отсутствует 3’-5’-экзонуклеазная активность (редактирующая).
Pfu-полимераза из Pyrococcus furiosus – термостабильна, работает
медленнее, зато исправляет многие ошибки (имеет 3’-5’-экзонуклеазную
активность, ок. 2-4 ошибок/106, скорость 300 нукл./мин)
34.
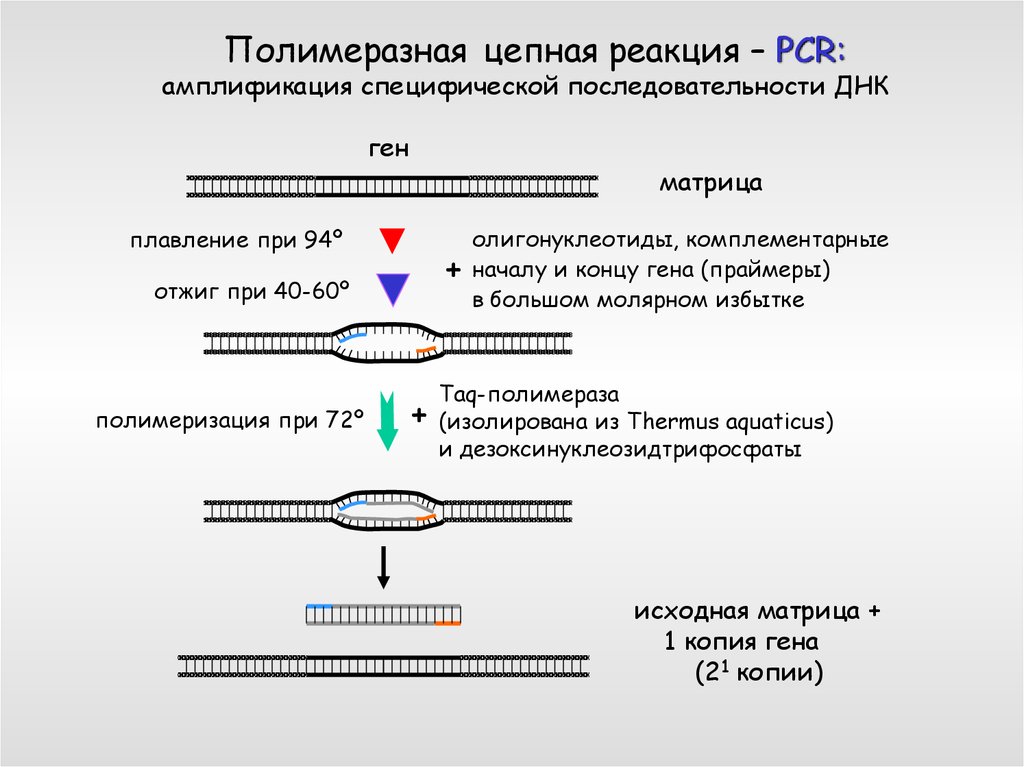
Полимеразная цепная реакция – PCR:амплификация специфической последовательности ДНК
ген
матрица
плавление при 94º
+
отжиг при 40-60º
полимеризация при 72º
+
олигонуклеотиды, комплементарные
началу и концу гена (праймеры)
в большом молярном избытке
Taq-полимераза
(изолирована из Thermus aquaticus)
и дезоксинуклеозидтрифосфаты
исходная матрица +
1 копия гена
(21 копии)
35.
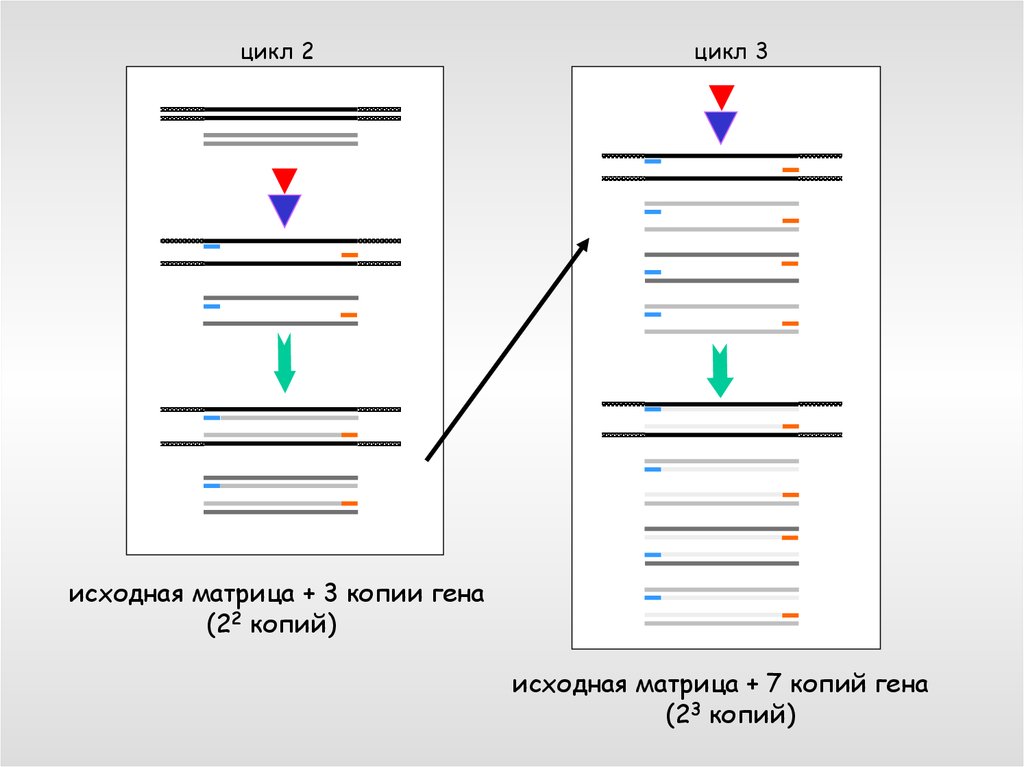
цикл 2цикл 3
исходная матрица + 3 копии гена
(22 копий)
исходная матрица + 7 копий гена
(23 копий)
36.
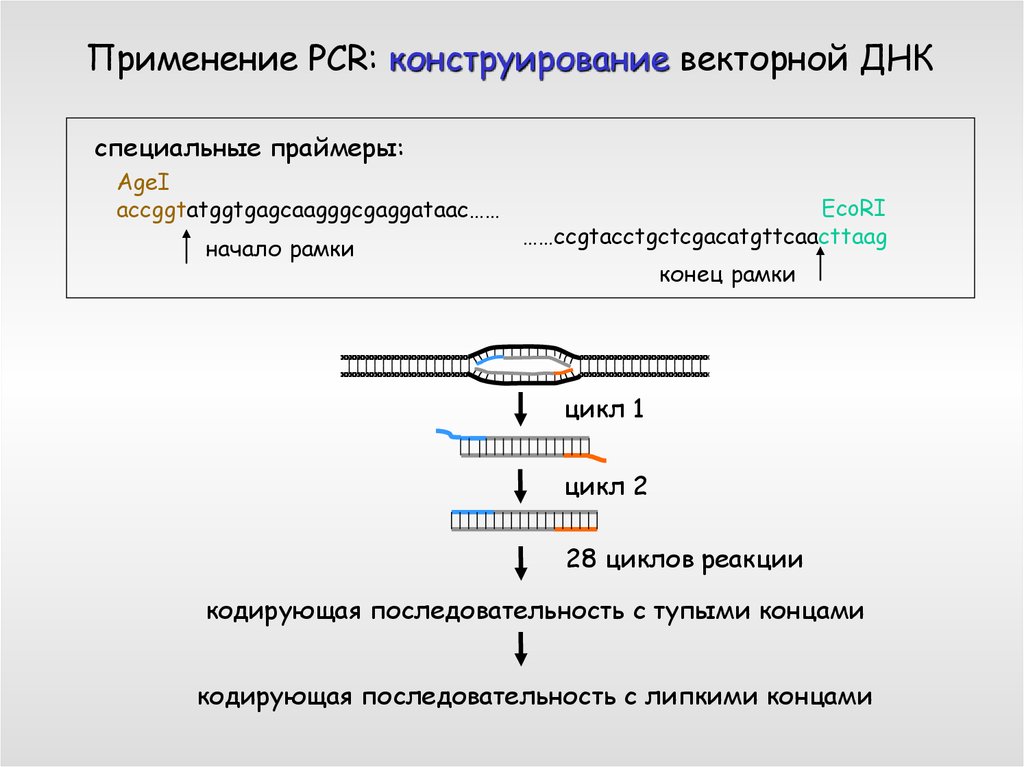
Применение PCR: конструирование векторной ДНКспециальные праймеры:
AgeI
accggtatggtgagcaagggcgaggataac……
начало рамки
EcoRI
……ccgtacctgctcgacatgttcaacttaag
конец рамки
цикл 1
цикл 2
28 циклов реакции
кодирующая последовательность с тупыми концами
кодирующая последовательность с липкими концами
37.
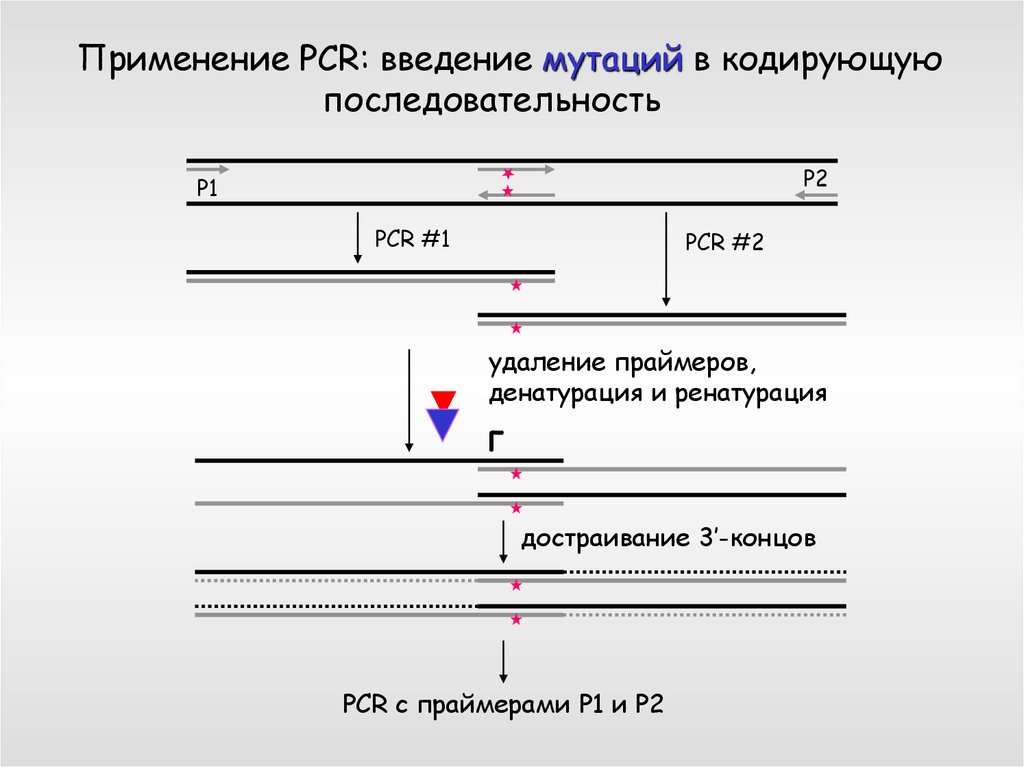
Применение PCR: введение мутаций в кодирующуюпоследовательность
P2
P1
PCR #1
PCR #2
удаление праймеров,
денатурация и ренатурация
г
достраивание 3’-концов
PCR с праймерами P1 и P2
38.
Применение PCR: отбор колоний(Colony PCR)
?
!
бактерии из отдельных колоний
23 цикла реакции
электрофорез
ДНК
Master Mix: нуклеотиды, Taq-полимераза, буфер, праймеры
39.
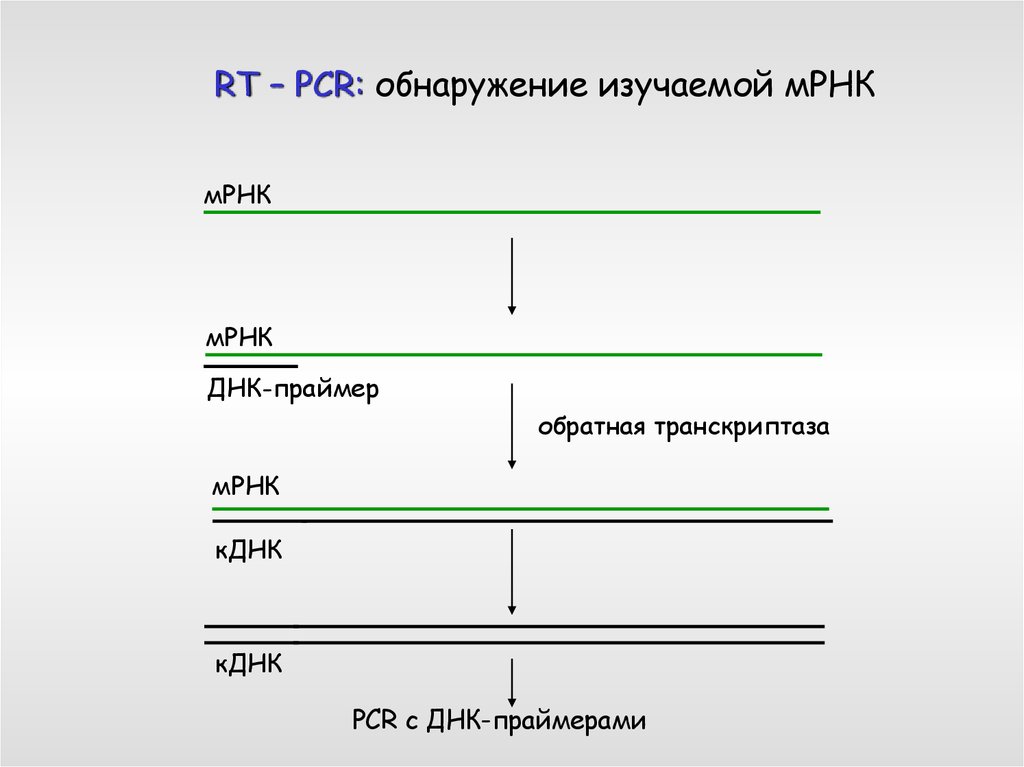
RT – PCR: обнаружение изучаемой мРНКмРНК
мРНК
ДНК-праймер
обратная транскриптаза
мРНК
кДНК
кДНК
PCR с ДНК-праймерами
40.
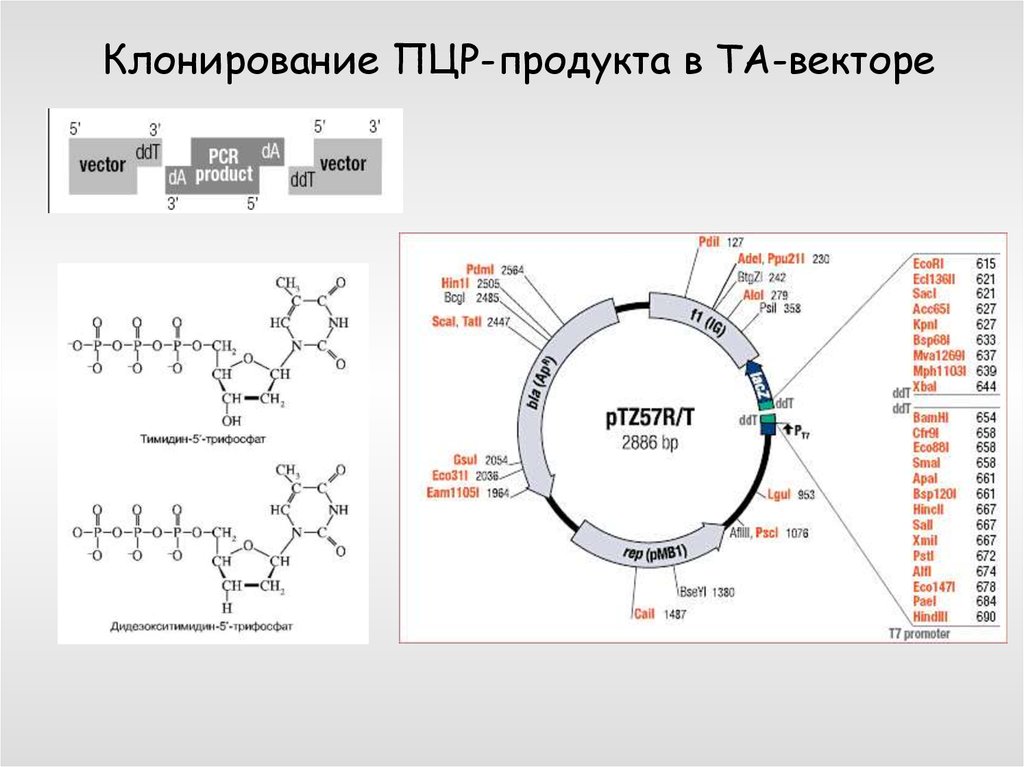
Клонирование ПЦР-продукта в ТА-векторе41.
Real-Time PCR: TaqMan проба42.
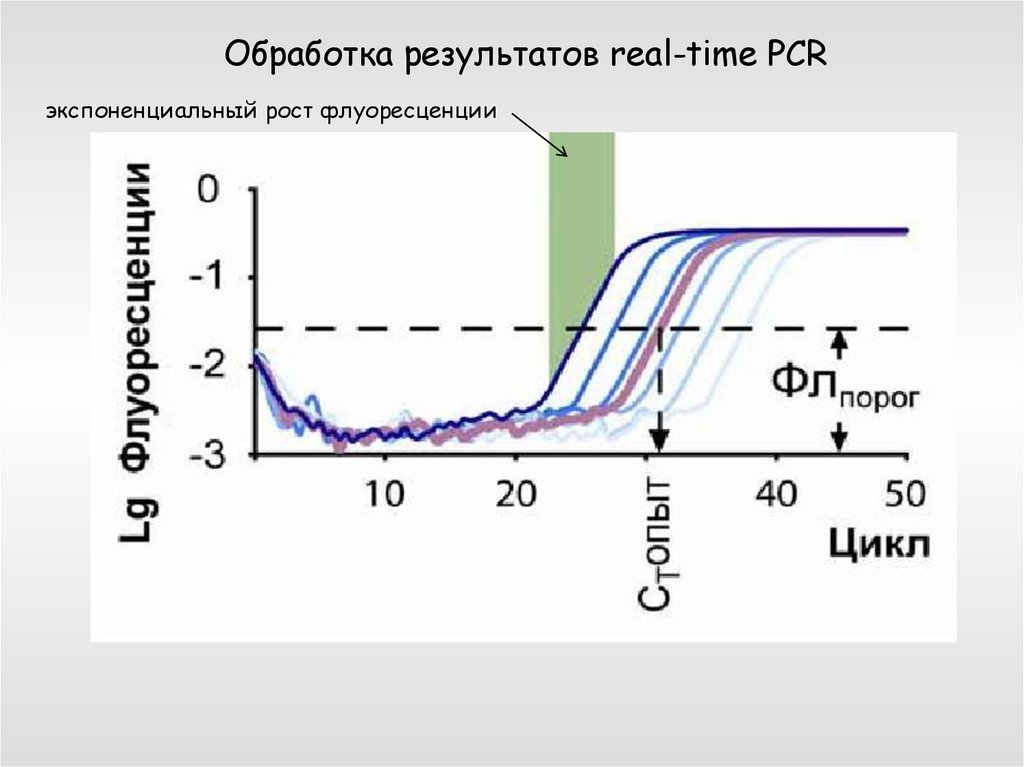
Обработка результатов real-time PCRэкспоненциальный рост флуоресценции
43.
Real-Time PCR: molecular beaconпоследовательность,
присутствующая в
PCR-продукте
флюорохром
гаситель
флюоресценции
обычный цикл PCR
44.
Real-Time PCR: with Sybr green I.Неспецифический интеркалирующий цианиновый краситель:
поглощает синий свет(λ макс = 488 нм),
излучает зеленый свет (λ макс = 522 нм).
45.
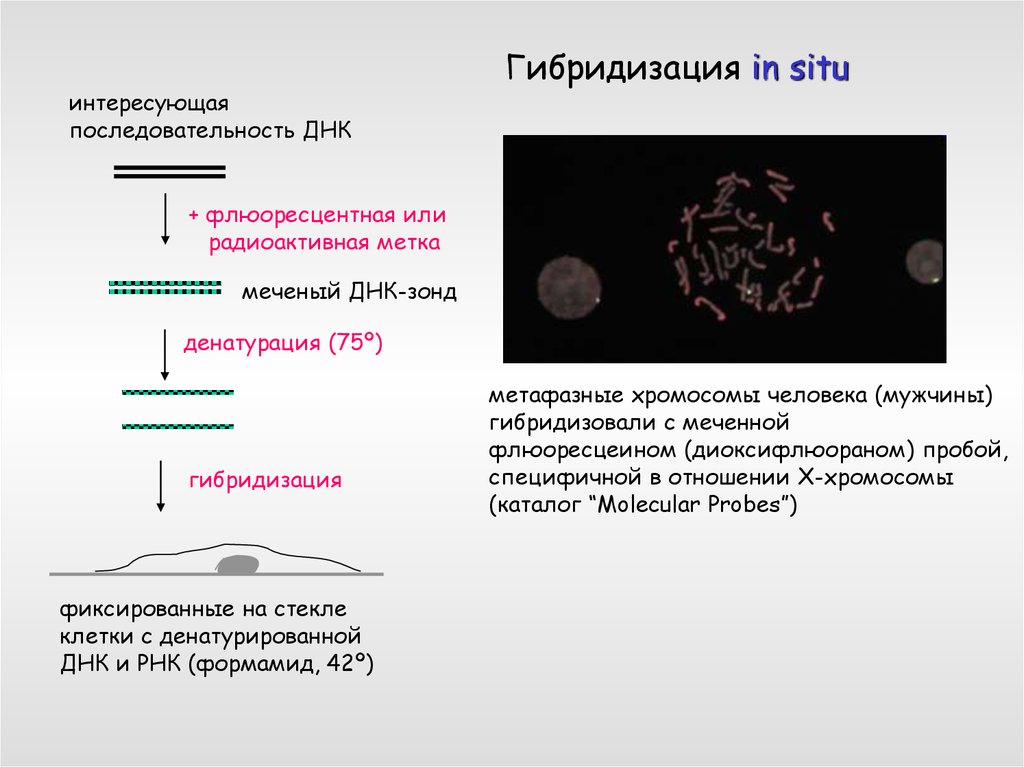
интересующаяпоследовательность ДНК
Гибридизация in situ
+ флюоресцентная или
радиоактивная метка
меченый ДНК-зонд
денатурация (75º)
гибридизация
фиксированные на стекле
клетки с денатурированной
ДНК и РНК (формамид, 42º)
метафазные хромосомы человека (мужчины)
гибридизовали с меченной
флюоресцеином (диоксифлюораном) пробой,
специфичной в отношении Х-хромосомы
(каталог “Molecular Probes”)
46.
Whole mount гибридизация in situс меченой дигоксигенином мРНК транскрипционных факторов в
эмбрионах ксенопуса
(Ermakova et al., 1999)
47.
Определение последовательности ДНКДНК денатурируют и по одной из ее цепей проводят
полимеразную реакцию с нормальными и
модифицированными нуклеозидтрифосфатами
Н
О
О
СН2
ОН
Н
О
СН2
основание
Н
О
нормальный
дезоксирибонуклеотид
основание
дидеоксирибонуклеотидтерминатор полимеризации ДНК
Н
*
Н
48.
AT
G
C
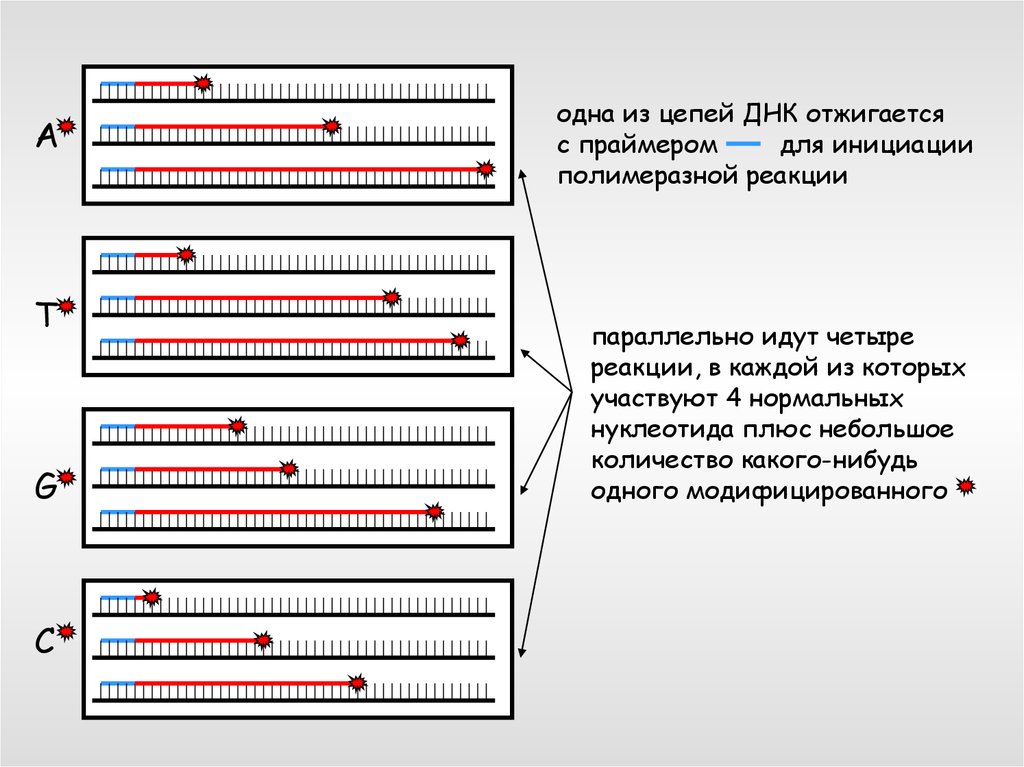
одна из цепей ДНК отжигается
с праймером
для инициации
полимеразной реакции
параллельно идут четыре
реакции, в каждой из которых
участвуют 4 нормальных
нуклеотида плюс небольшое
количество какого-нибудь
одного модифицированного
49.
продукты реакций разделяютсяпо размеру электрофорезом в
полиакриламидном геле:
G
A
C
T
нуклеотиды-терминаторы
чтение четырех дорожек геля снизу
вверх дает последовательность
нуклеотидов
50. Определение последовательности ДНК
Пиросеквенирование. 454 Life ScienceОдноцепочечную матрицу ДНК отжигают с праймером, затем
инкубируют с ферментами ДНК-полимеразой, АТР-сульфурилазой,
люциферазой и апиразой, а также с субстратами: аденозин-5’фосфосульфатом (APS) и люциферином.
Каждый случай включения комплементарного нуклеотида
сопровождается высвобождением пирофосфата (PPi) в
эквимолярном количестве.
51.
О2ATP-сульфурилаза количественно преобразовывает пирофосфат в
ATP в присутствии аденозин- 5’- фосфосульфата. ATP, в свою
очередь, способствует превращению люциферина в оксилюциферин
под действием люциферазы. При этом испускается видимый свет,
интенсивность которого пропорциональна количеству
образовавшегося ATP.
52.
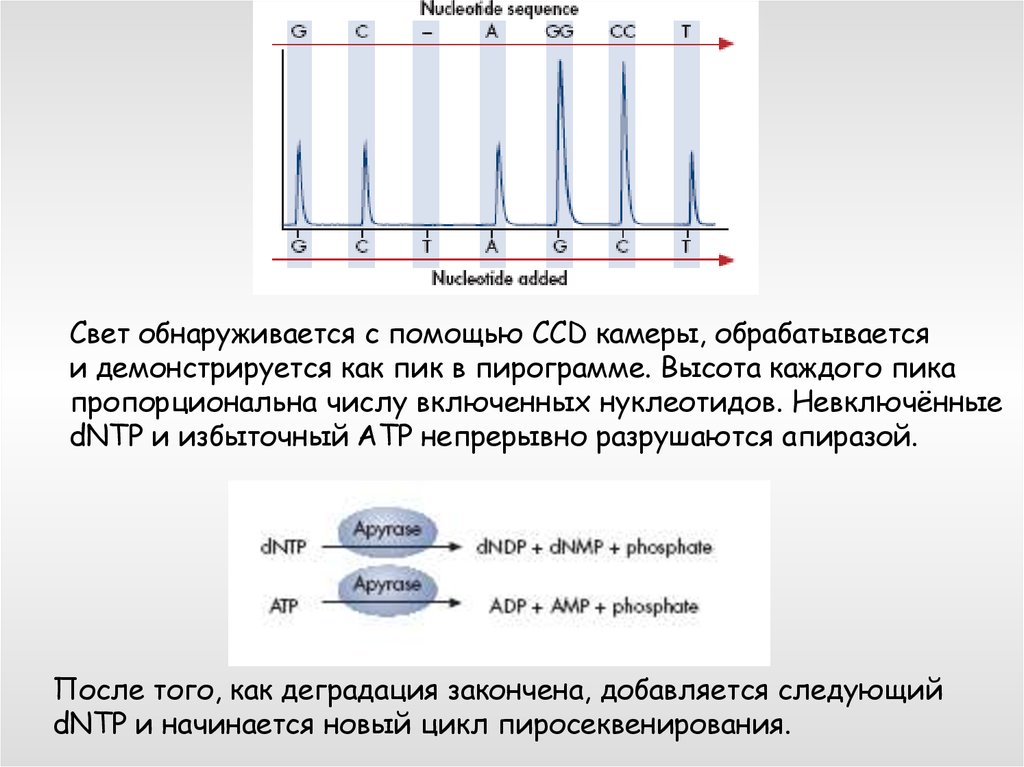
Свет обнаруживается с помощью CCD камеры, обрабатываетсяи демонстрируется как пик в пирограмме. Высота каждого пика
пропорциональна числу включенных нуклеотидов. Невключённые
dNTP и избыточный ATP непрерывно разрушаются апиразой.
После того, как деградация закончена, добавляется следующий
dNTP и начинается новый цикл пиросеквенирования.
53.
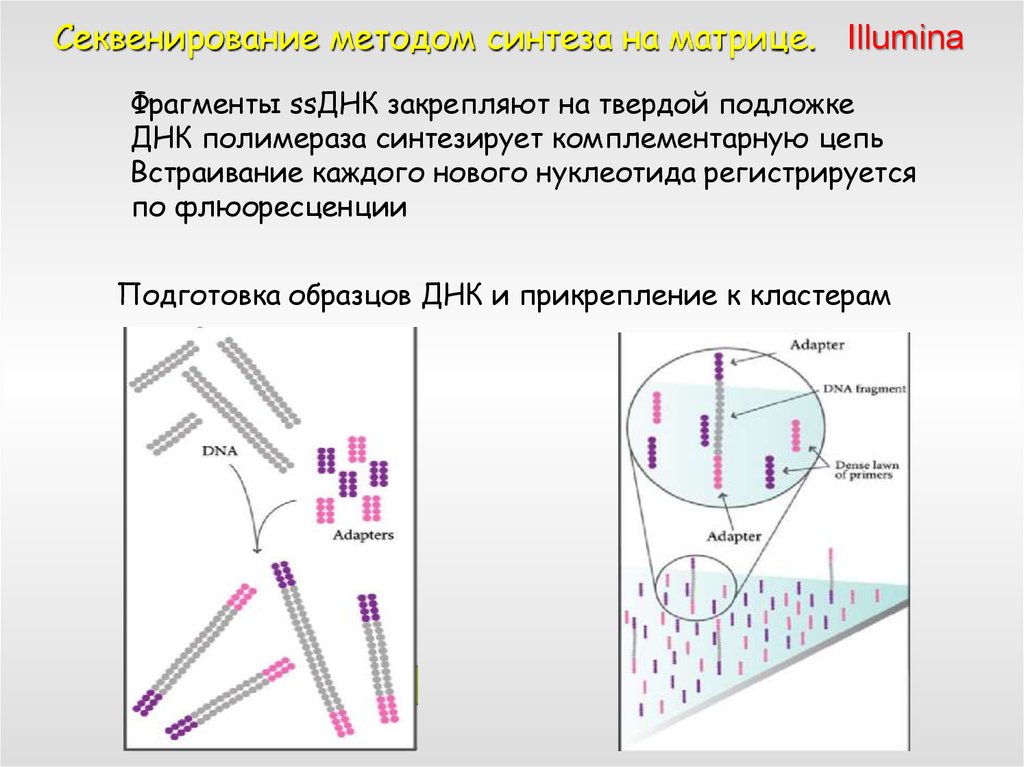
Секвенирование методом синтеза на матрице. IlluminaФрагменты ssДНК закрепляют на твердой подложке
ДНК полимераза синтезирует комплементарную цепь
Встраивание каждого нового нуклеотида регистрируется
по флюоресценции
Подготовка образцов ДНК и прикрепление к кластерам
54.
Секвенирование методом синтеза на матрицеIllumina
1. Фрагментация dsДНК
2. Два адаптера пришиваются ДНК-лигазой
3. Амплификация полученных фрагментов ДНК (ПЦР)
55.
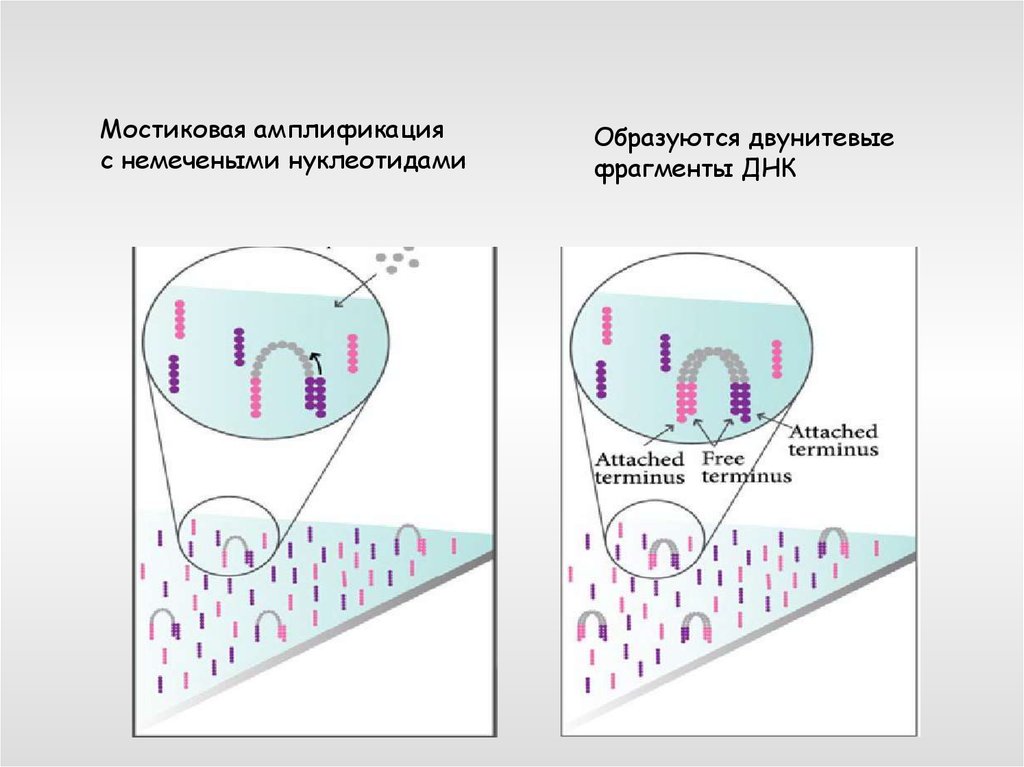
Мостиковая амплификацияс немечеными нуклеотидами
Образуются двунитевые
фрагменты ДНК
56.
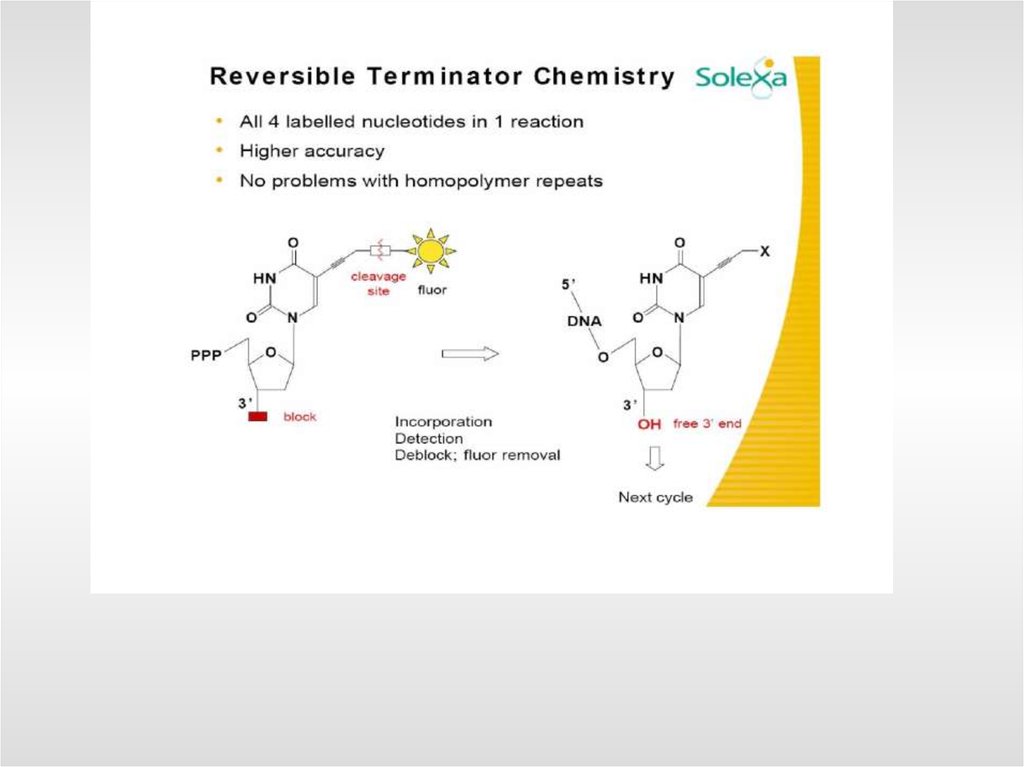
57. Секвенирование методом синтеза
3’ 5’Цикл 1:
Добавка всех 4 нуклеотидов.
Каждый нуклеотид помечен своим
флюорозондом
Включение первого основания
Удаление невключенных оснований
A
T
G
C
C
T
A
G
T
Разблокирование синтеза,
ферментативное удаление метки
C
C
A
Детекция сигнала
G
A
T
T
A
G
A
C
T
G
C
флюоросигнал
C
G
A
флюоросигнал
T
C
C
G
A
T
5’
Цикл 2:
Добавка реакционной смеси и повторение
цикла. Чтение второго нуклеотида
58.
59. С матрицы считывается тип включенного в каждый кластер основания Около 1 миллиона оснований определяется за один цикл синтеза
Секвенирование методом синтезаС матрицы считывается тип включенного в каждый кластер основания
Около 1 миллиона оснований определяется за один цикл синтеза
Последовательность ДНК определяется путем анализа всей
совокупности данных, снятых с матрицы
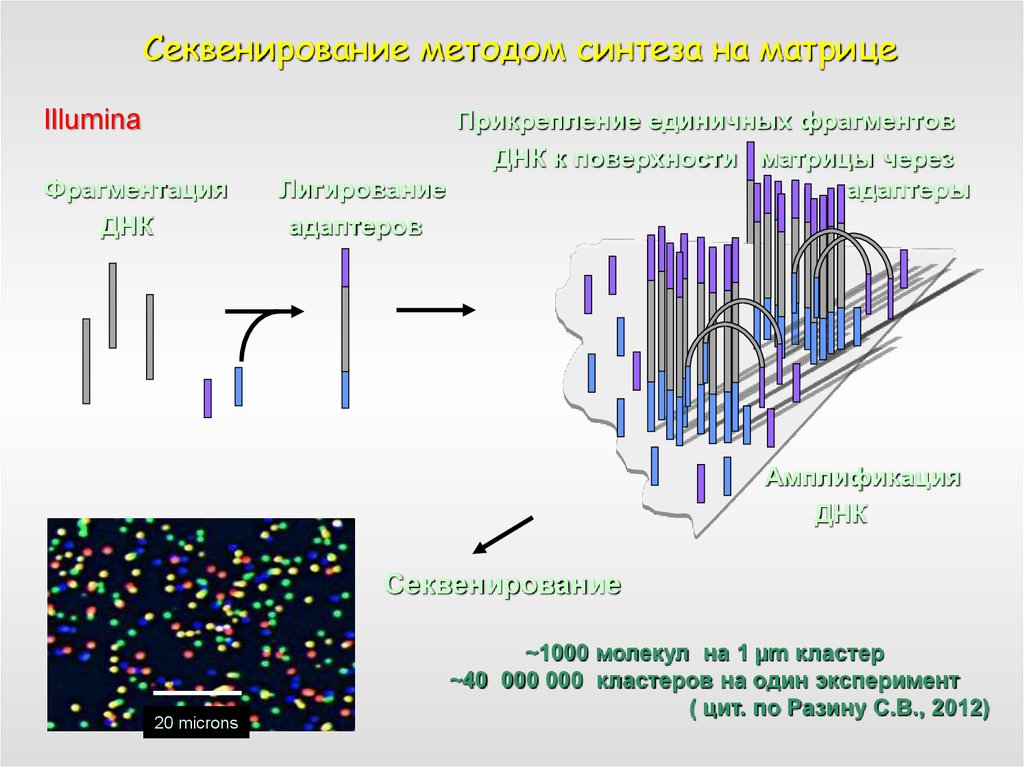
60. Секвенирование методом синтеза на матрице
IlluminaФрагментация
ДНК
Прикрепление единичных фрагментов
ДНК к поверхности матрицы через
Лигирование
адаптеры
адаптеров
Амплификация
ДНК
Секвенирование
20 microns
~1000 молекул на 1 µm кластер
~40 000 000 кластеров на один эксперимент
( цит. по Разину С.В., 2012)
61. Секвенирование методом синтеза на матрице
Illumina секвенировала индивидуальный геномафриканского мужчины за несколько недель, достигнув
скорости прочтения до 3 миллионов оснований за цикл
(февраль 2008)
62.
От последовательности нуклеотидов –к предполагаемой последовательности аминокислот
Поиск открытой рамки считывания:
5‘-atgcccaagctgaatagcgtagaggggttttcatcatttgaggacgatgtataa-3'
1 atg ccc aag ctg aat agc gta gag ggg ttt tca tca ttt gag gac gat gta taa
M P K L N S V E G F S S F E D D V *
2 tgc cca agc tga ata gcg tag agg ggt ttt cat cat ttg agg acg atg tat
C P S * I A * R G F H H L R T M Y
3 gcc caa gct gaa tag cgt aga ggg gtt ttc atc att tga gga cga tgt ata
A Q A E * R R G V F I I * G R C I
В неправильных рамках часто встречаются стоп-кодоны
(отмечены красной звездочкой)
63.
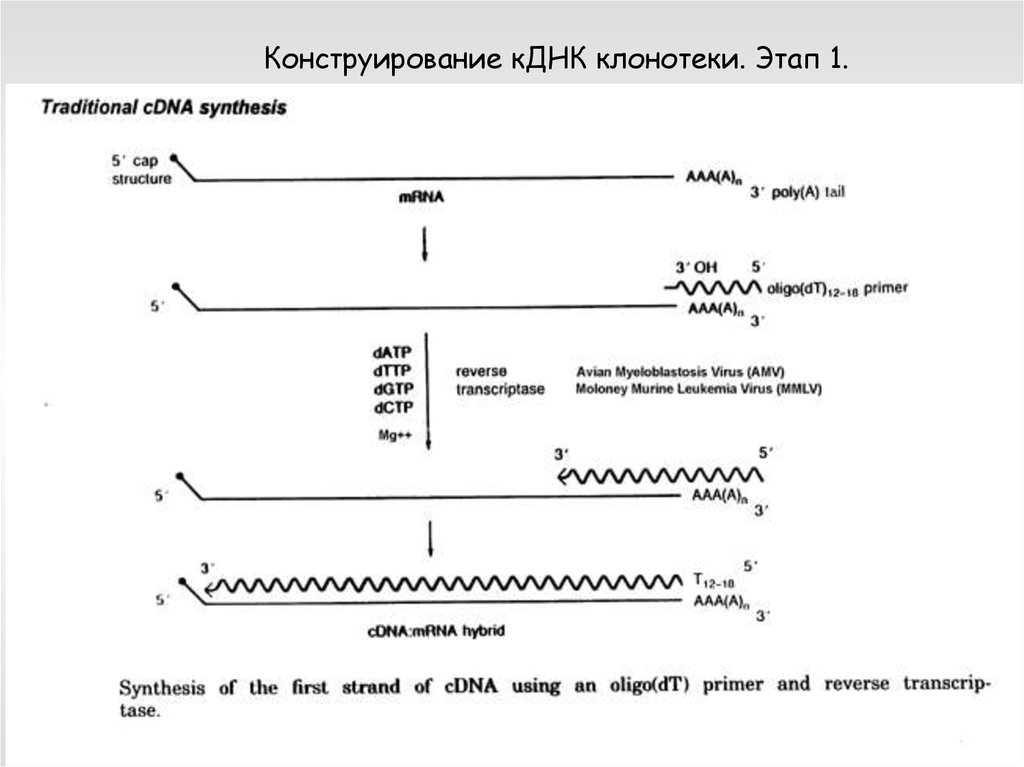
Конструирование кДНК клонотеки. Этап 1.64.
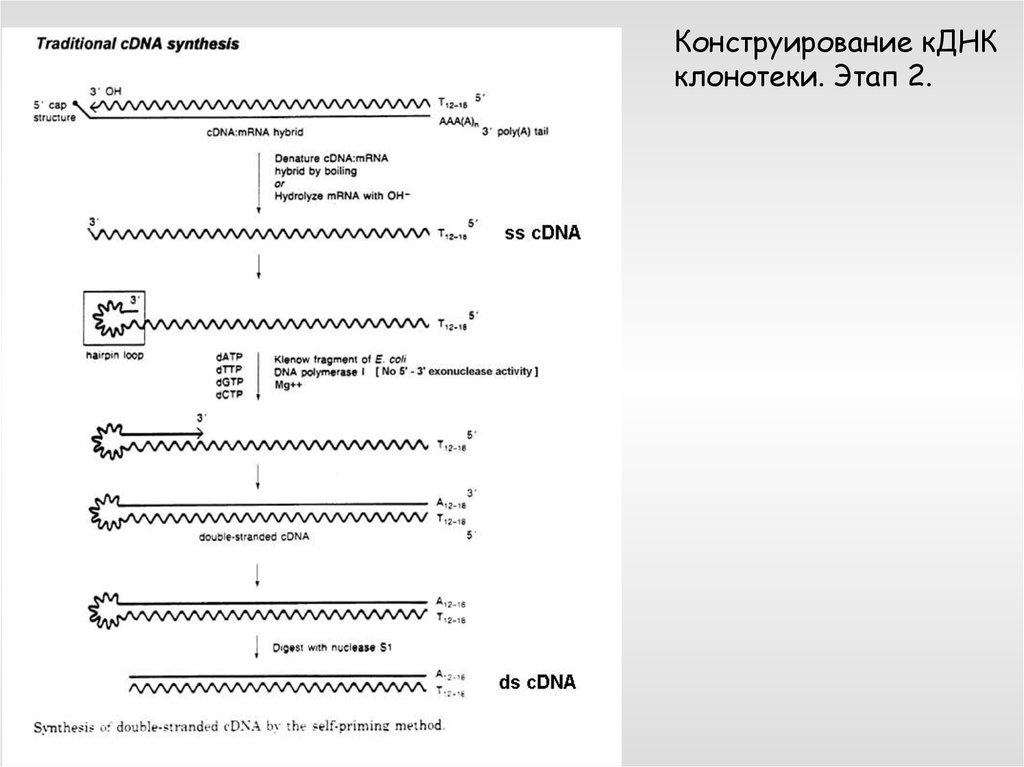
Конструирование кДНКклонотеки. Этап 2.
65.
Этап 3.Hind III линкер
палиндром линкера
фосфорилирование 5’концов
Лигирование
с кДНК
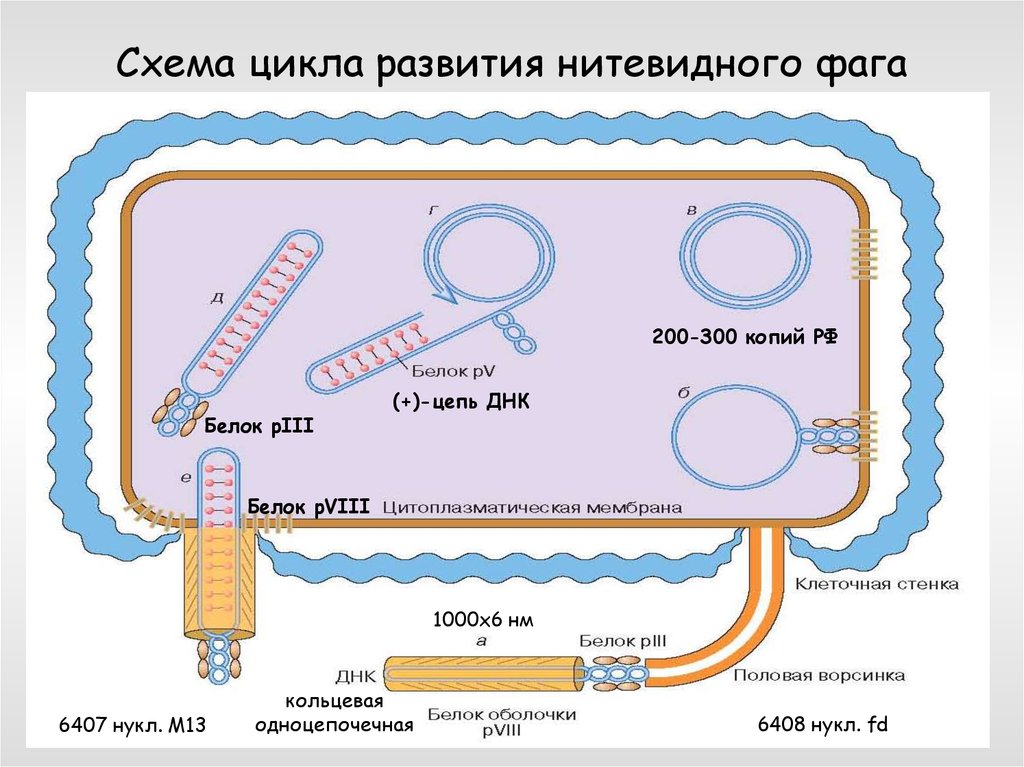
66. Схема цикла развития нитевидного фага
200-300 копий РФБелок рIII
(+)-цепь ДНК
Белок pVIII
1000х6 нм
6407 нукл. М13
кольцевая
одноцепочечная
6408 нукл. fd
67. Сколько копий плазмиды в клетке?
• В зависимости от точки начала репликации(ori) в клетке может содержаться различное
число копий плазмиды:
• - Низкокопийные (1-2 копии на клетку)
• - Высококопийные (10-100 копий на клетку)
68. Литература к курсу «Основы клеточной биологии»
• Патрушев Л.И.Экспрессия генов. – М.: Наука, 2000.
ил. ISBN 5-02-001890-2
• Свердлов Е.Д. Взгляд на жизнь через окно генома. –
М.: Наука, 2009.
• А. Ройт, Дж. Бростофф, Д. Мейл. Иммунология.- М.:
«Мир», 2000.
• И. Сердюк, Н. Заккаи, Дж. Заккаи. Методы в
молекулярной биофизике. Учебное пособие. Том I.М.: КДУ (Книжный Дом Университет), 2009.
• ПЦР «в реальном времени». Под редакцией д.б.н. Д.В.
Ребрикова.- М.:БИНОМ. Лаборатория знаний. 2009.
• Оригинальные статьи.
69.
-А
B
Какой из двух линейных
фрагментов ДНК имеет
большую молекулярную массу?
+
70.
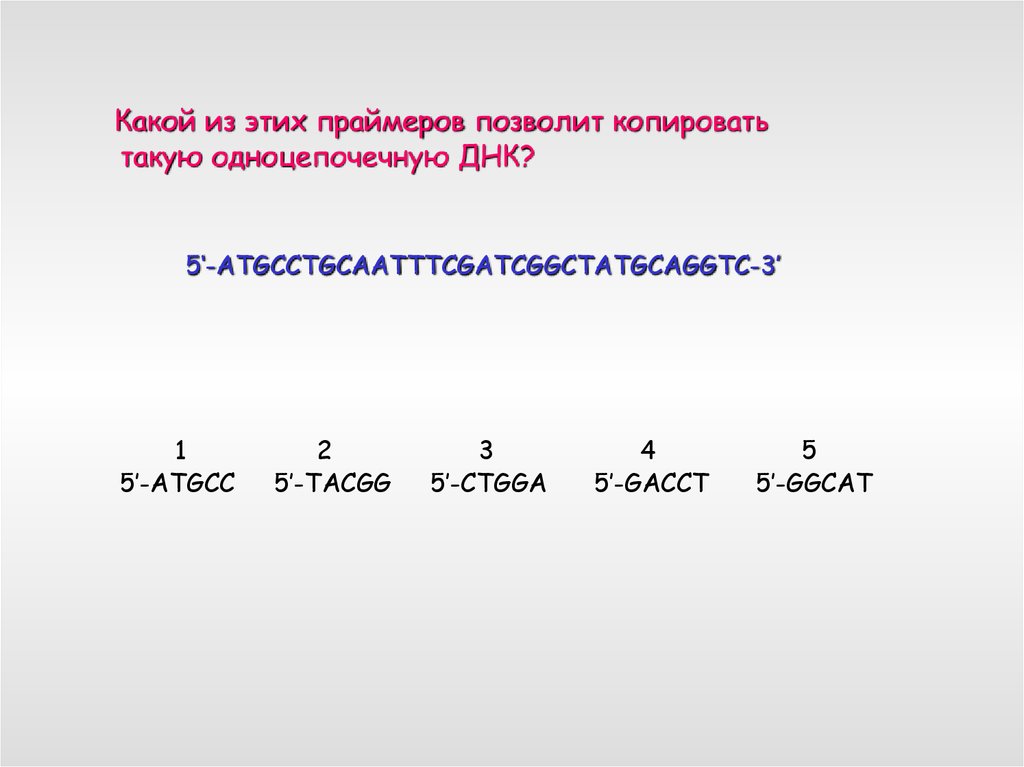
Какой из этих праймеров позволит копироватьтакую одноцепочечную ДНК?
5‘-ATGCCTGCAATTTCGATCGGCTATGCAGGTC-3’
1
5’-ATGCC
2
5’-TACGG
3
5’-CTGGA
4
5’-GACCT
5
5’-GGCAT
71.
Зачем и каким образом используют PCR в:- диагностике?
- генетическом анализе в медицине?
- криминалистике и судебной медицине?
- палеонтологии?







































 biology
biology








