Similar presentations:
Синтез оксалата калия
1.
Синтез оксалата калияРаботу
выполнила:
студент
группы ЕТ-131,
Никифорова Вероника.
Руководитель: ст. преп. кафедры
ТиПХ Малютина Е.М.
2.
Цель и задачиЦель: получить оксалат калия и исследовать его свойства.
Задачи:
1. Ознакомиться с литературой по физическим и химическим свойствам
данного соединения.
2. Проанализировать методы получения и выбрать оптимальный из них.
3. Рассчитать термодинамическую возможность протекания процесса.
4. Провести синтез оксалата калия, а также качественные реакции на ионы,
входящие в состав этого соединения.
5. Рассчитать практический выход продукта.
2
3.
Оксалаты1. Восстановительные свойства:
–
5 C2O42– + 2MnO4 + 16 H + → 10 CO2 + 2 Mn2++ 8 H2O
2. Термическое разложение:
t° Na CO + CO
а. Na2C2O4 →
2
3
t° Cu + 2 CO2
б. CuC2O4 →
3
4.
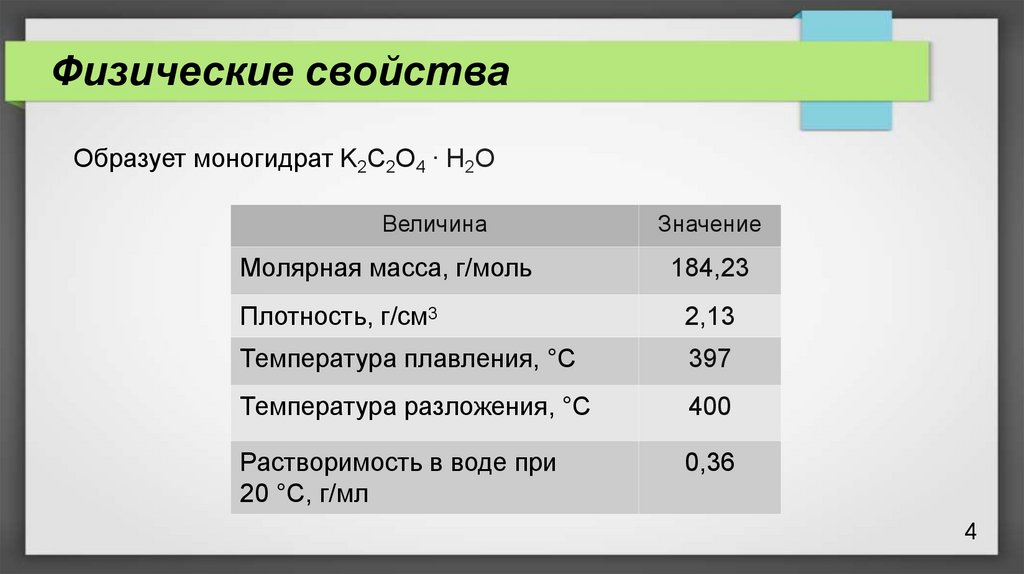
Физические свойстваОбразует моногидрат K2C2O4 ∙ H2O
Величина
Значение
Молярная масса, г/моль
184,23
Плотность, г/см3
2,13
Температура плавления, °С
397
Температура разложения, °С
400
Растворимость в воде при
20 °С, г/мл
0,36
4
5.
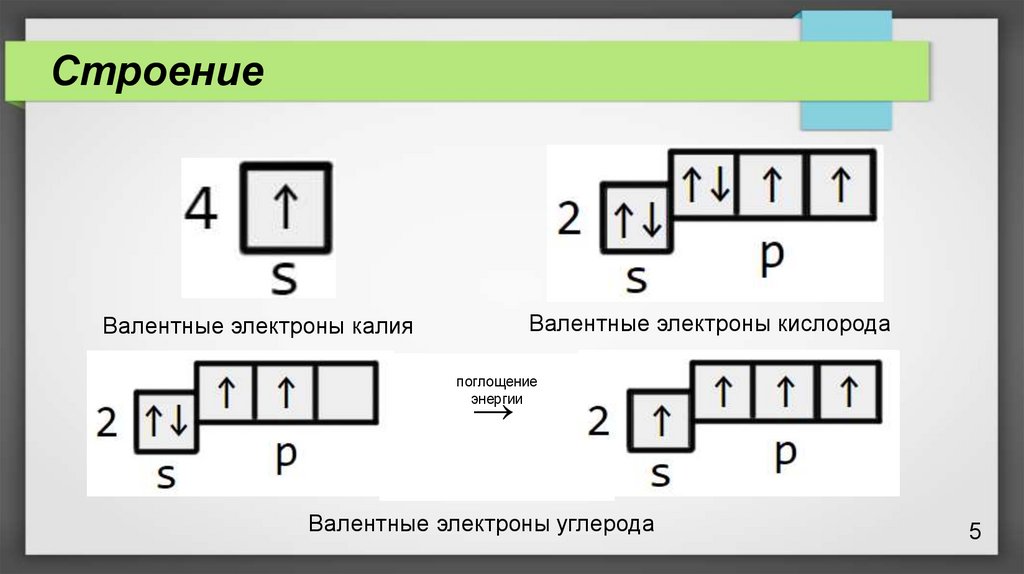
СтроениеВалентные электроны кислорода
Валентные электроны калия
поглощение
энергии
→
Валентные электроны углерода
5
6.
СтроениеАтомы углерода находятся в sp2-гибридизации
Строение оксалат-иона
Строение оксалата калия
6
7.
Химические свойства°С
1. K2C2O4 400
⟶
K2CO3 + CO
2. K2C2O4 + HCl → H2C2O4 + KCl
3. Гидролиз:
I. K2C2O4 + H2O → KHC2O4 + KOH
II. KHC2O4 + H2O → H2C2O4 + KOH
7
8.
Химические свойства° K SO + CO + CO + H O
4. K2C2O4 + H2SO4 (конц.) t→
2
4
2
2
5. FeCl3 + 3 K2C2O4 → K3[Fe(C2O4)3] + 3 KCl
8
9.
Методы синтезаСпособ 1. В растворе щавелевой кислоты при нагревании до 80 °С
растворяют карбонат калия. Полученный раствор фильтруют на
складчатом фильтре и упаривают до образования на поверхности
кристаллической пленки, после чего остужают смесь на воздухе,
фильтруют кристаллы от маточного раствора и сушат их при комнатной
температуре.
Способ 2. Через смесь калия и песка пропускают углекислый газ, после
чего выдерживают смесь во влажной атмосфере 8 дней и растворяют в
воде.
9
10.
ПрименениеАналитическая химия
Медицинские лаборатории
Металлургия
Отбеливатели
Стоматология
10
11.
Термодинамические расчётыK2CO3 + H2C2O4 → K2C2O4 + CO2 + H2O
CO32–+ H2C2O4 → C2O24– + CO2 + H2O.
ΔG = ΔH – TS
ΔH = – 808 – 393 – 268 – (– 677 + 831) = – 1623 кДж
S = 80 + 214 + 70 – (– 57 + 120) = 301 Дж/K
ΔG = – 1623000 – 353 ∙ 301 = –1729,3 кДж
ΔG < 0, значит, реакция протекает самопроизвольно при 80 °С
11
12.
Выбор метода синтеза и расчетколичества исходных веществ
Для синтеза оксалата калия был выбран первый способ.
Чтобы получить 9 г моногидрата оксалата калия по реакции
K2CO3 + H2C2O4 → K2C2O4 + CO2 + H2O,
необходимо взять 6,9 г карбоната калия (K2CO3) и 6,3 г дигидрата
щавелевой кислоты (H2C2O4 ∙ 2H2O)
12
13.
СинтезРастворяем в небольшом количестве воды щавелевую кислоту при
80 °С и смешиваем с карбонатом калия, после чего охлаждаем
Раствор оксалата калия
Кристаллы моногидрата
оксалата калия
13
14.
Качественные реакции на К +2K+ + Na+ + [Co(NO3)6] 3–→ K2Na[Co(NO3)6]↓
желтый
Ионы калия окрашивают пламя в фиолетовый цвет
Осадок
гексанитрокобальтата (III)
натрия-дикалия
Результат
прокаливания
соли калия
14
15.
2–Качественная реакция на C2O4
Ba2+ + C2O42– → BaC2O4↓
белый
Осадок оксалата бария
15
16.
Расчет выхода продуктаВ результате синтеза получено 7,65 г моногидрата оксалата калия
Практический выход составил 83,15%
Моногидрат оксалата
калия
16
17.
ЗаключениеСинтезирован моногидрат оксалата калия с формулой K2C2O4 ∙ H2O
Изучены его строение, физические и химические свойства
Проведен анализ основных методов получения вещества, выбран оптимальный из
них
Рассчитана термодинамическая возможность протекания процесса
Проведены качественные реакции на ионы, входящие в состав соединения
Рассчитан практический выход вещества, который составил 83,15 %
17
18.
Спасибо за внимание!18
















 chemistry
chemistry








