Similar presentations:
Пниктогены (элементы VА-группы)
1. ПНИКТОГЕНЫ (элементы VА -группы)
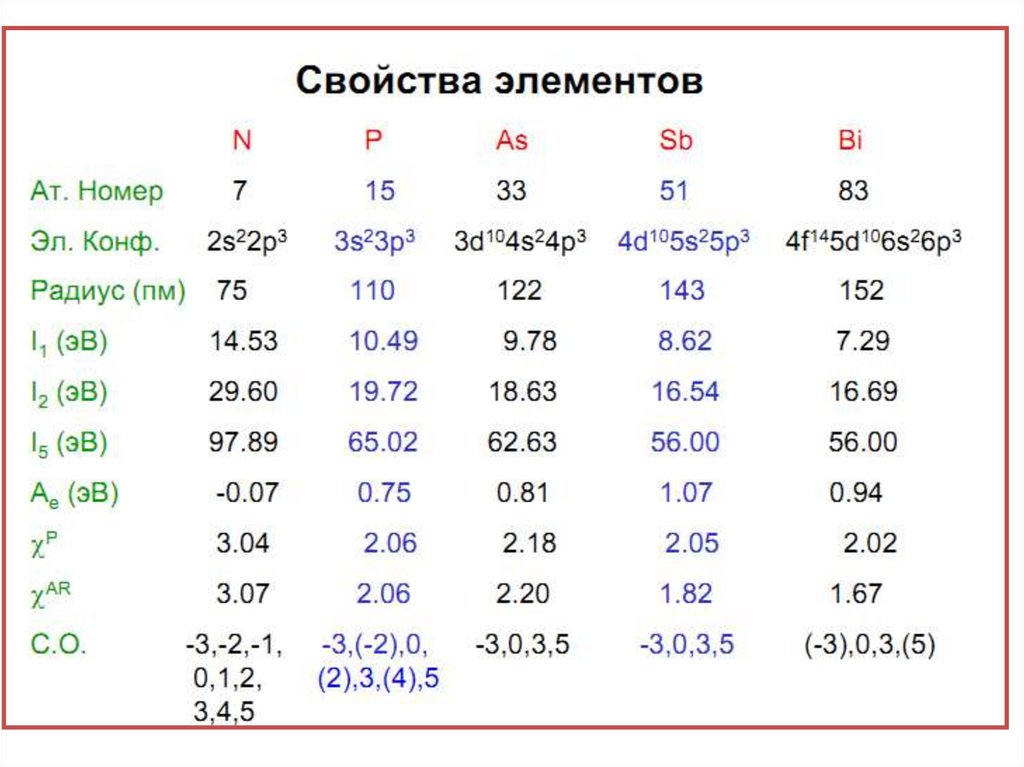
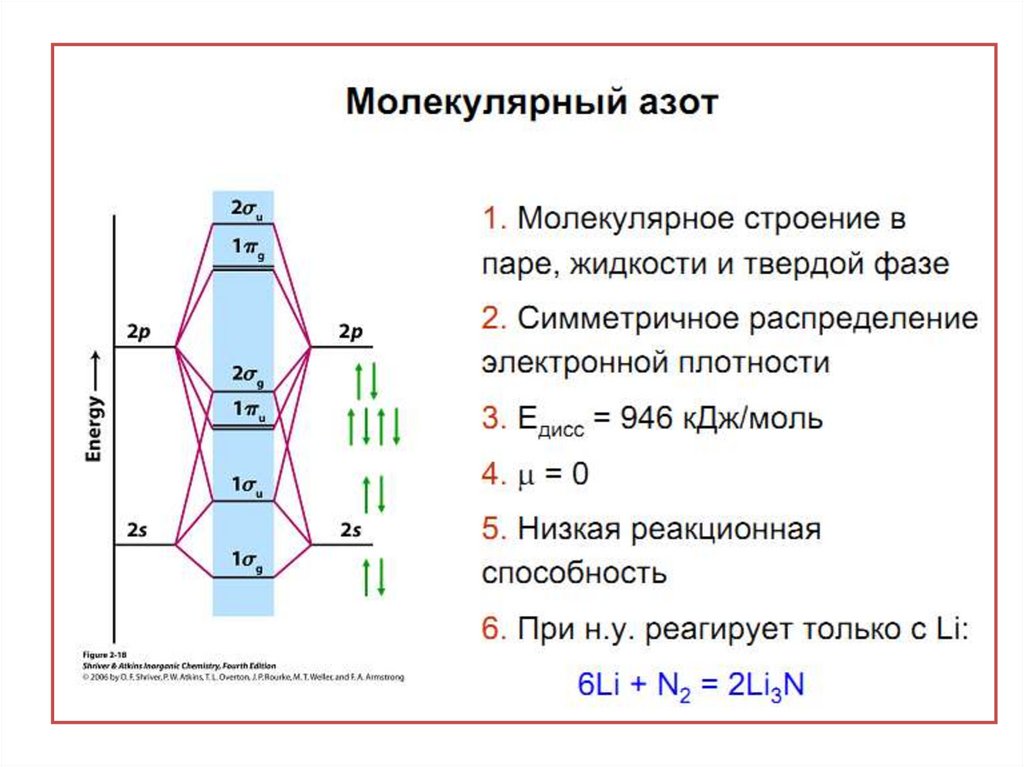
2.
3.
4.
5. Нахождение в природе
Азот• простое вещество в атмосфере ( 78об.%);
• Природные минералы - чилийская селитра
NaNO3, калийная селитра КNO3;
• Содержание в земной коре 2,5 10-3 мас.%
• В виде аминокислот, нуклеиновых кислот в
составе
животных
и
растительных
организмов.
6. Нахождение в природе
ФОСФОРВ земной коре в виде фосфатов (0,1 мас.%)
Распространенные минералы:
Апатиты: гидроксоапатит
Фторапатит
, фосфорит
7. Нахождение в природе
• Мышьяк, сурьма
и
висмут
встречаются в природе
в основном в виде сульфидов:
• Аурипигмета As2S3 реальгара As4S4
8. Нахождение в природе
Сурьмяный блеск(антимонит) Sb2S3
Висмутовый блеск
(висмутит) Bi2S3
9. Получение и применение азота
10.
11.
12. НИТРИДЫ
Практическое значение имеют нитриды d-элементов типа МN (TiN,CrN), M2N (Cr2N, Mo2N) - отличаются высокой твердостью, тугоплавки,
не разрушаются растворами кислот, устойчивы против окисления на
воздухе
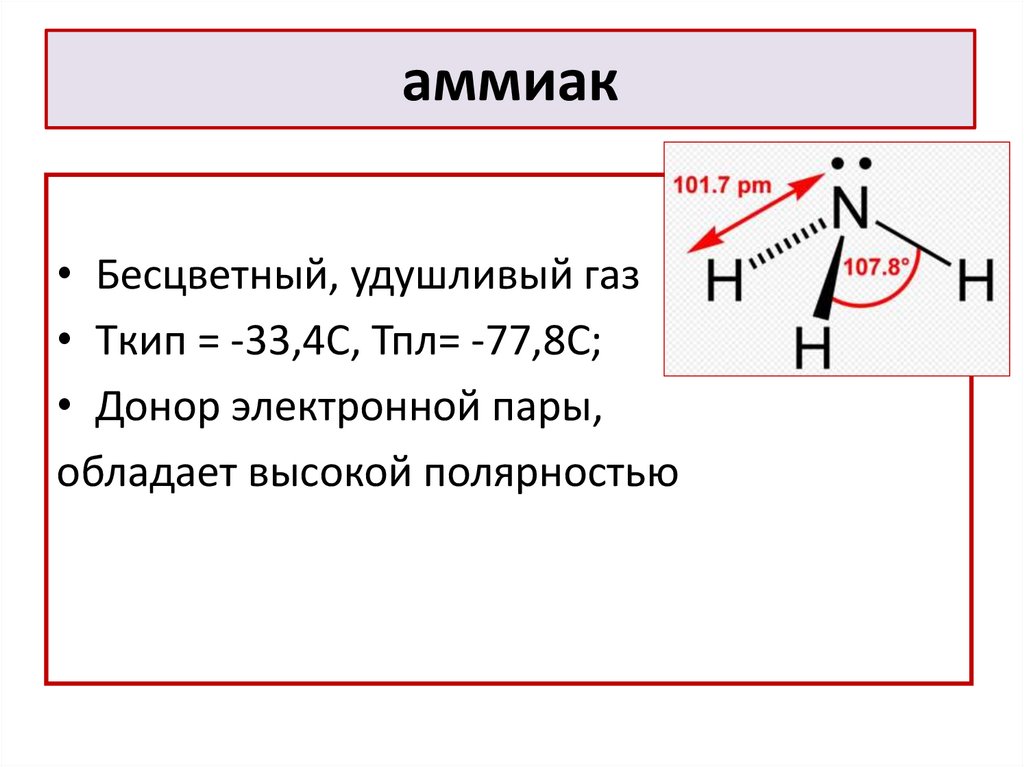
13. аммиак
• Бесцветный, удушливый газ• Tкип = -33,4С, Тпл= -77,8С;
• Донор электронной пары,
обладает высокой полярностью
14. Получение аммиака
В промышленности:В лаборатории
15. аммиак
• Хорошо растворяется в воде (20 С в 1V H2O 700V NH3) –образуется водородная связь между молекулами NH3 и
H2O.
16. аммиак
NH3 – восстановитель• Горит голубоватым пламенем:
В других условиях :
(При нагревании)
17. аммиак
• Наличие свободной sp3 – гибридной электронной пары ваммиаке обусловливает его высокие донорные свойства –
способность реагировать с кислотами:
• А также образовывать
аммиакаты:
комплексные
соединения
–
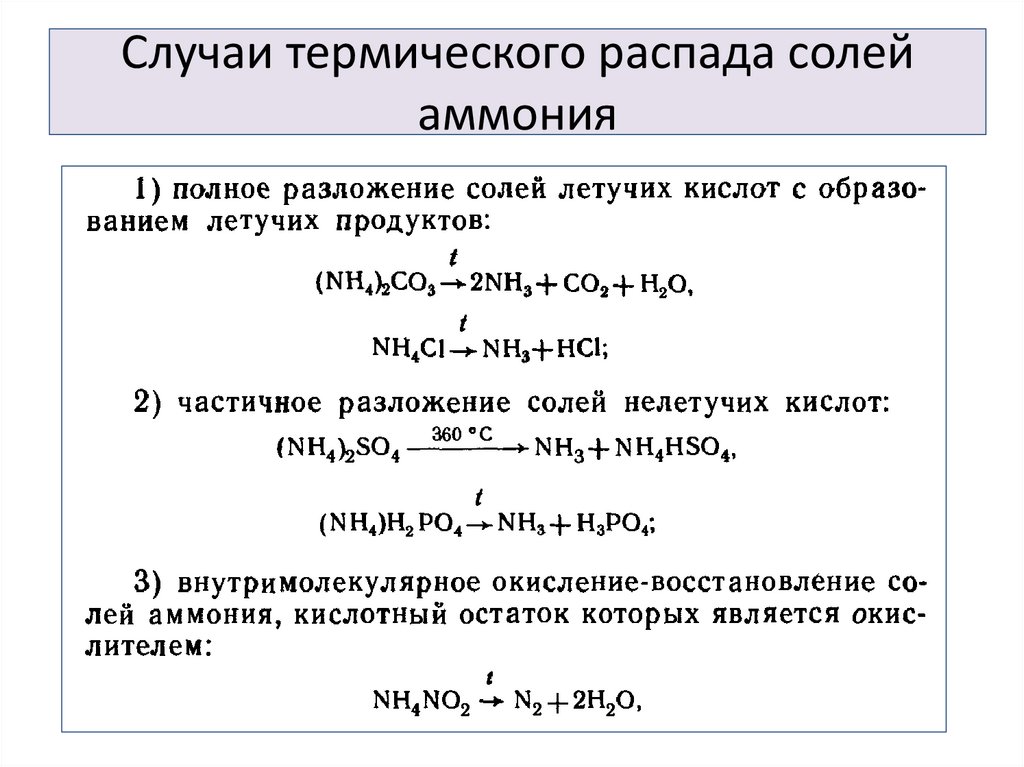
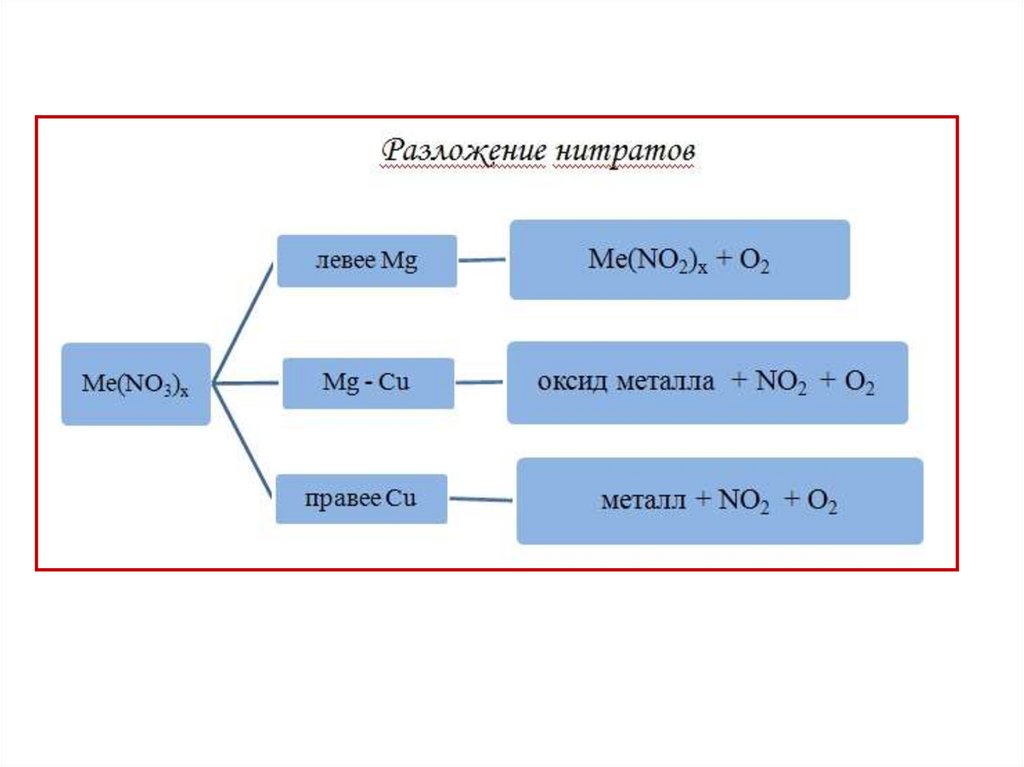
18. Случаи термического распада солей аммония
19. Случаи термического распада солей аммония
20.
21.
22.
23.
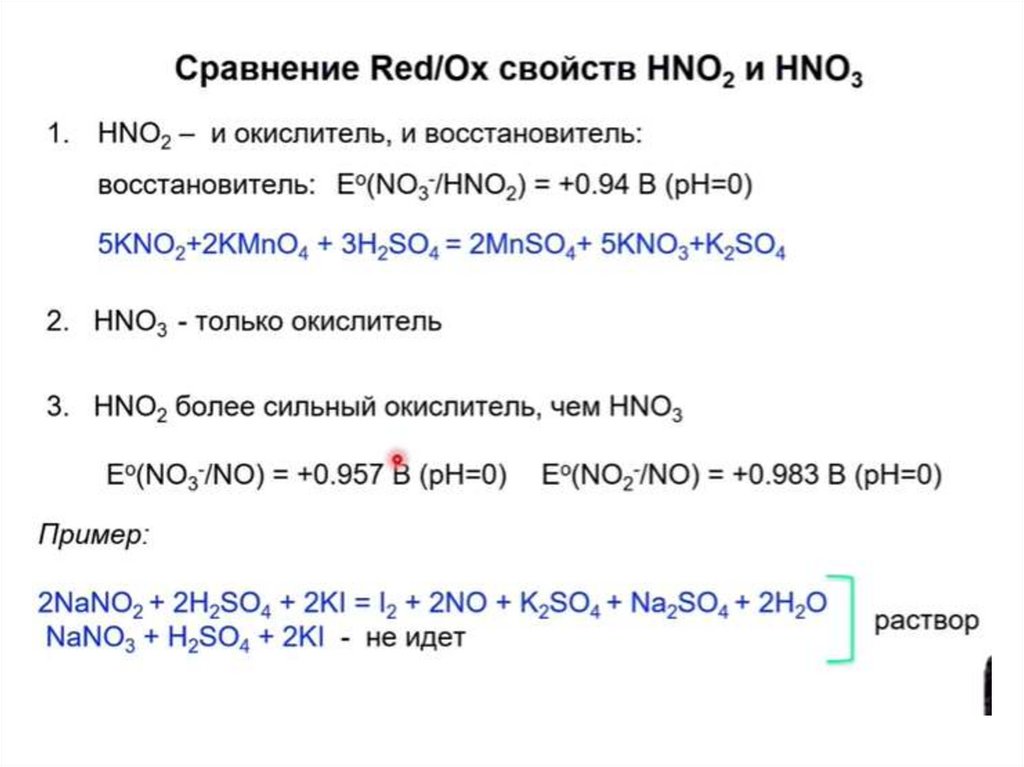
24. Соединения азота (+3)
АЗОТИСТАЯ КИСЛОТА (НNO2)(ТАУТОМЕРНЫЕ СТРУКТУРЫ)
25.
26. Соединения азота (+5)
N2O5 - Оксид азота (V)
HN3 – азотистоводородная кислота
NON (N2O) – оксонитрид азота
HNO3 (азотная кислота), нитраты
27.
28.
Получение:1. Окисление гидразина азотистой кислотой:
N2H4 + HNO2 НN3 + 2Н2О
2.
29.
В разбавленных растворах медленно диспропорционирует:НN3 +H2O NH2OH + 3N2
В безводном состоянии взрывается даже при сотрясении:
2НN3 H2 + 3N2
Соли (азиды) щелочных и щелочно-земельных металлов при
медленном нагревании устойчивы вплоть до плавления.
Азиды тяжелых металлов легко взрываются при ударе:
Pb(N3)2 Pb +3N2
30. NON (N2O) – оксонитрид азота (V), закись азота, «веселящий газ»
При нагревании N2O выше 700° С одновременно с реакцией разложенияпротекает его диспропорционирование:
31. NON (N2O) – оксонитрид азота (V), закись азота, «веселящий газ»
• Не взаимодействует с водой, формально ангидридазотноватистой кислоты:
• Является окислителем (вспыхивает лучина, горит
сера), восстанавливается водородом:
• При поджигании смеси- взрыв:
• Восстановительные свойства:
32.
При растворении в воде образуется азотнаякислота: N2O5 + H2O 2HNO3
33.
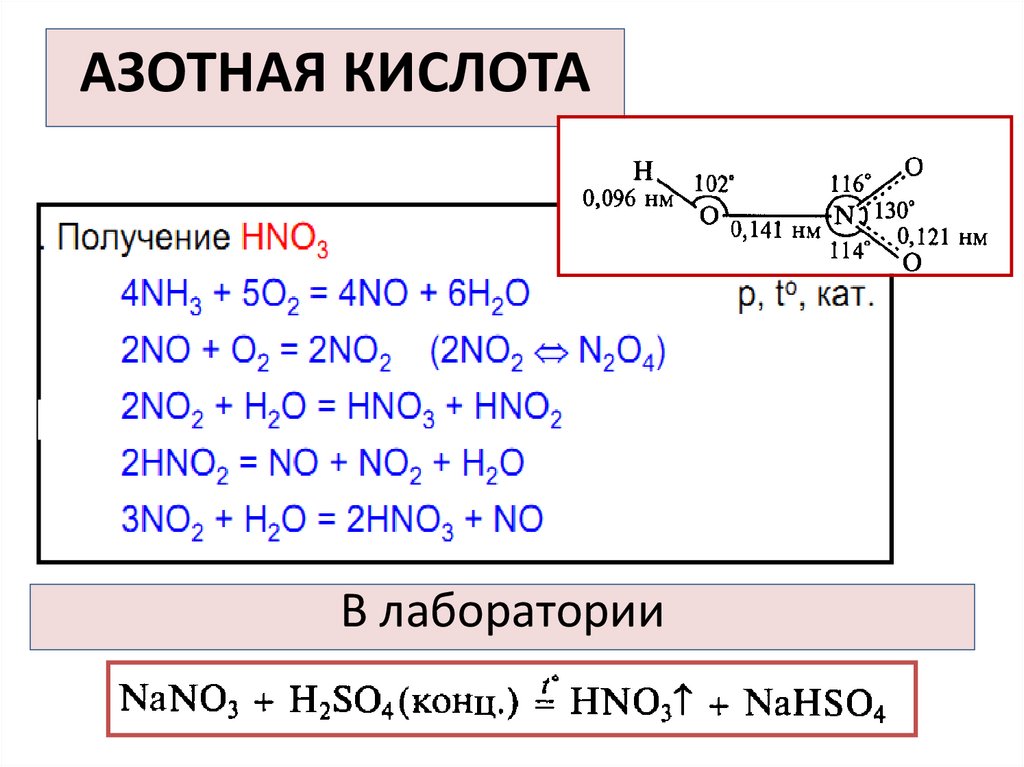
АЗОТНАЯ КИСЛОТАВ лаборатории
34.
35. АЗОТНАЯ КИСЛОТА
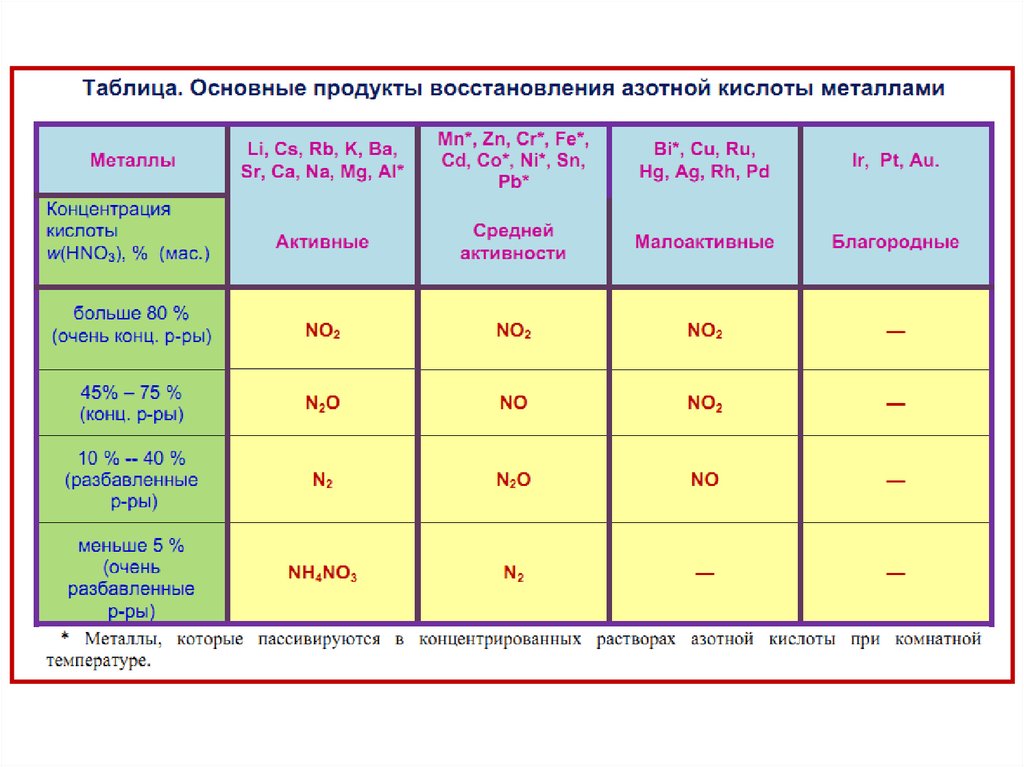
• При взаимодействии азотной кислоты сметаллами часто образуется сложная смесь
продуктов, состав которой определяется,
главным образом, природой металла и
концентрацией кислоты.
• Чем активнее металл и чем более
разбавлена кислота, тем сильнее протекает
восстановление.
36. Азотная кислота
• Особенностью азотной кислоты является то, что азот,входящий в состав NO3- имеет высшую степень
окисления +5 и поэтому обладает сильными
окислительными свойствами.
• Максимальное значение электродного потенциала для
нитрат-иона равно 0,96 В, поэтому азотная кислота – более
сильный окислитель, чем серная.
• Роль окислителя в реакциях взаимодействия металлов с
азотной кислотой выполняет N5+
• Следовательно, водород H2 никогда не выделяется при
взаимодействии металлов с азотной кислотой (независимо
от концентрации).
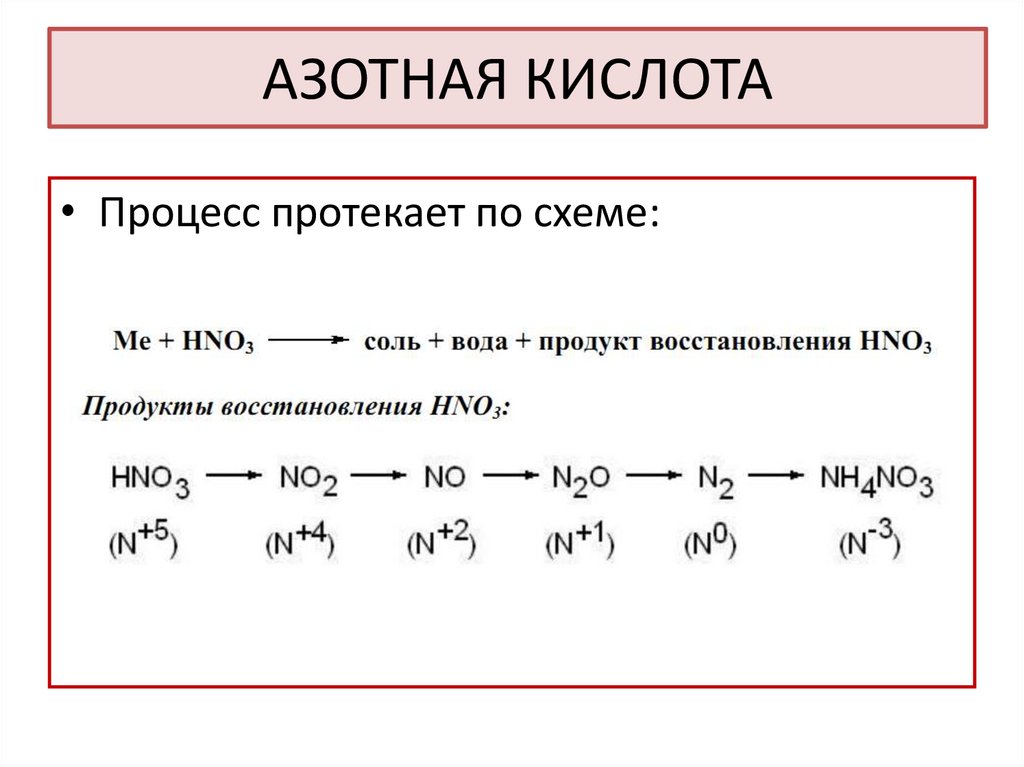
37. АЗОТНАЯ КИСЛОТА
• Процесс протекает по схеме:38.
Концентрированным считают раствор кислоты плотностьюρ > 1,25 кг/м3, что соответствует
концентрации > 40%.
Независимо от активности металла реакция взаимодействия с
HNO3 (конц.) Реакция протекает по схеме:
С концентрированной азотной кислотой не взаимодействуют
благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов
(Al, Ti, Cr,Fe, Co, Ni) при низкой температуре пассивируются
концентрированной азотной кислотой. Реакция возможна при
повышении температуры.
39.
Продукт восстановления азотной кислоты в разбавленномрастворе зависит от активности металла, участвующего в
реакции:
40.
41.
42.
43.
44. «Царская водка»
«Царская водка» (ранее кислоты называливодками) представляет собой смесь одного
объема азотной кислоты и трех-четырех
объемов
концентрированной
соляной
кислоты, обладающую очень высокой
окислительной активностью. Такая смесь
способна
растворять
некоторые
малоактивные
металлы,
не
взаимодействующие с азотной кислотой.
Среди них и «царь металлов» - золото.
45.
• Такое действие «царской водки» объясняется тем, что азотнаякислота
окисляет соляную с выделением свободного хлора и
образованием хлороксида азота (III), или хлорида нитрозила – NOCl:
Хлор в момент выделения состоит из атомов. Атомарный хлор
является сильнейшим окислителем, что и позволяет «царской
водке» воздействовать даже на самые инертные «благородные
металлы».
46.
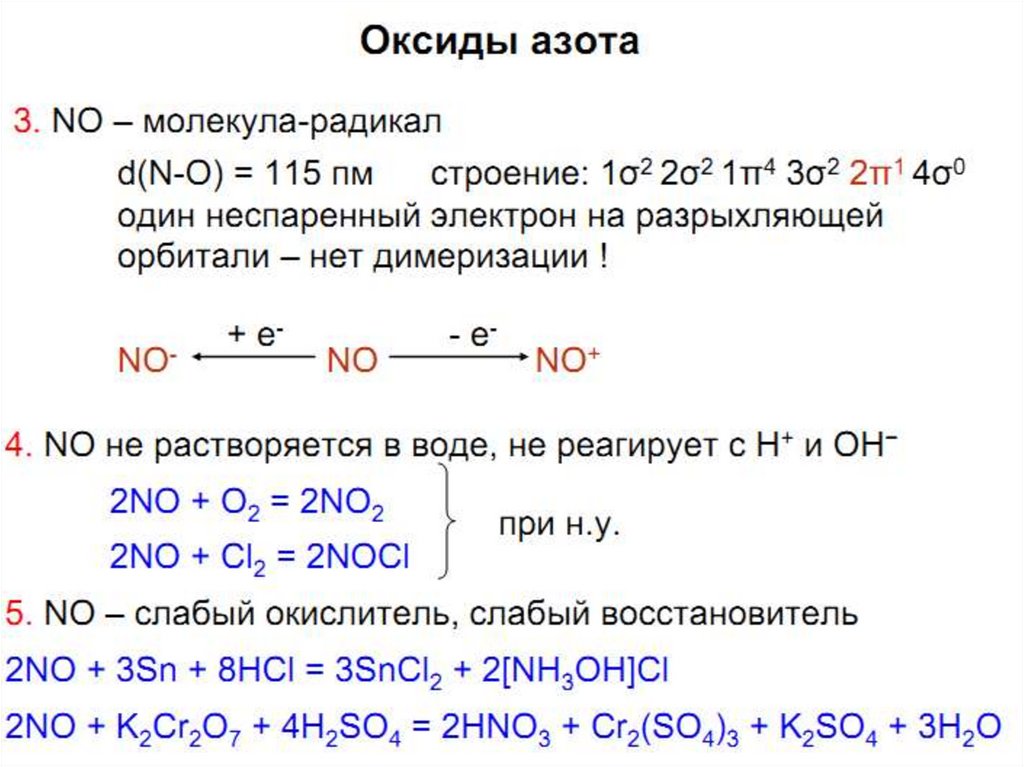
47. NO - Оксид азота (+2)
(грозовые разряды)48.
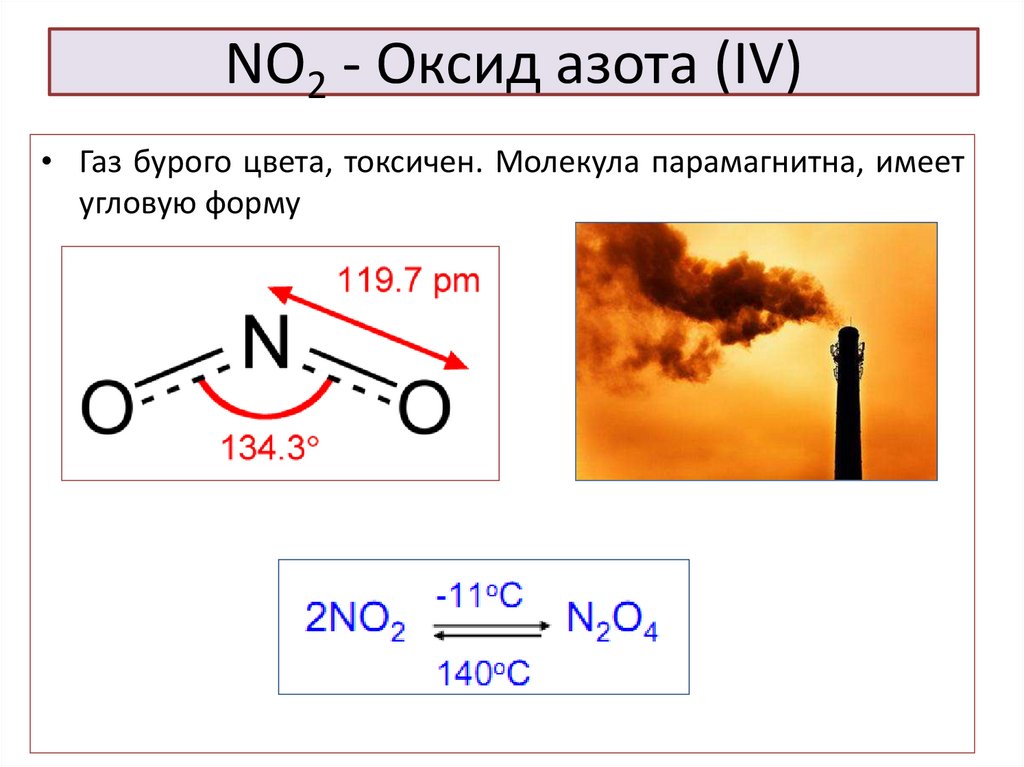
49. NO2 - Оксид азота (IV)
• Газ бурого цвета, токсичен. Молекула парамагнитна, имеетугловую форму
50. Получение NO2 :
1)взаимодействие
меди
с
концентрированной азотной кислотой:
горячей
2) Термическое разложение нитратов тяжелых
металлов:
3) при окислении NO кислородом:
51.
• NO2 – сильный окислитель, ватмосфере горят многие вещества:
его
• NO2 (мономер, димер) хорошо растворим
в воде:
• НNO2 – неустойчива, при t:
• При пропускании смеси NO2 и воздуха :














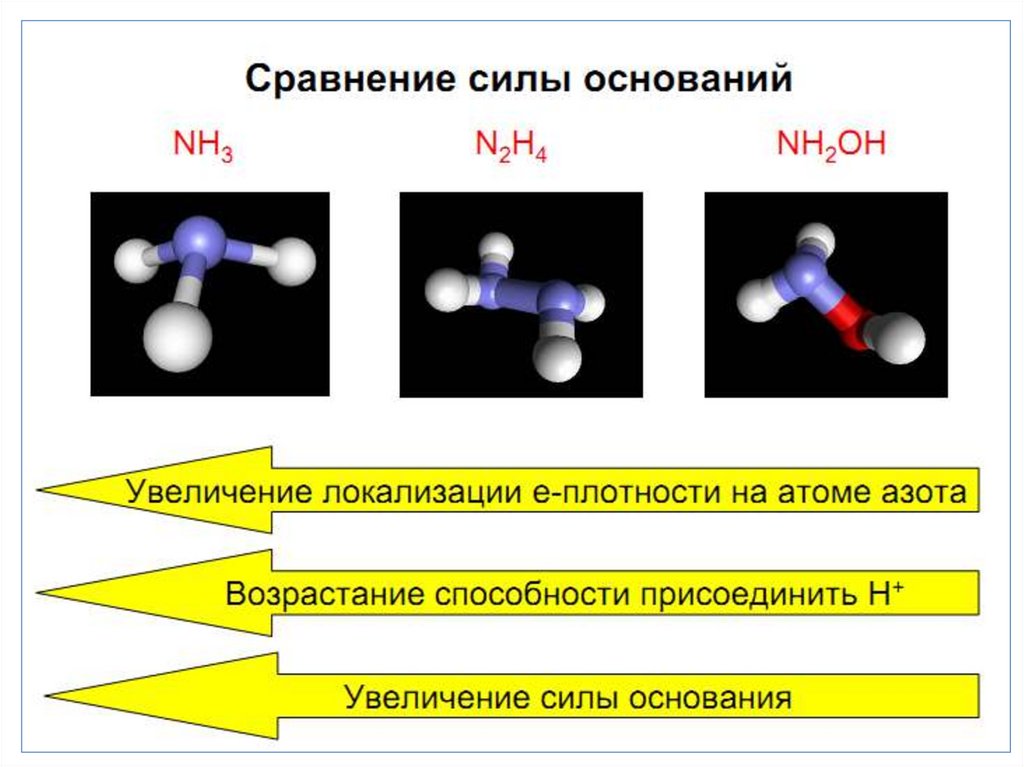
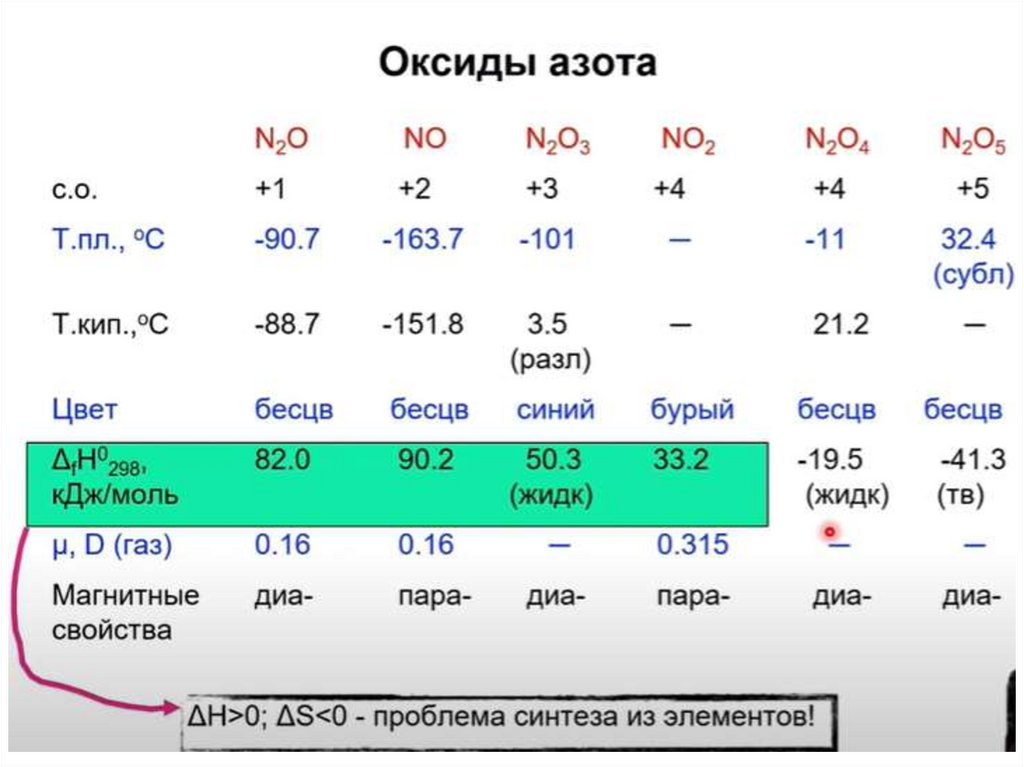
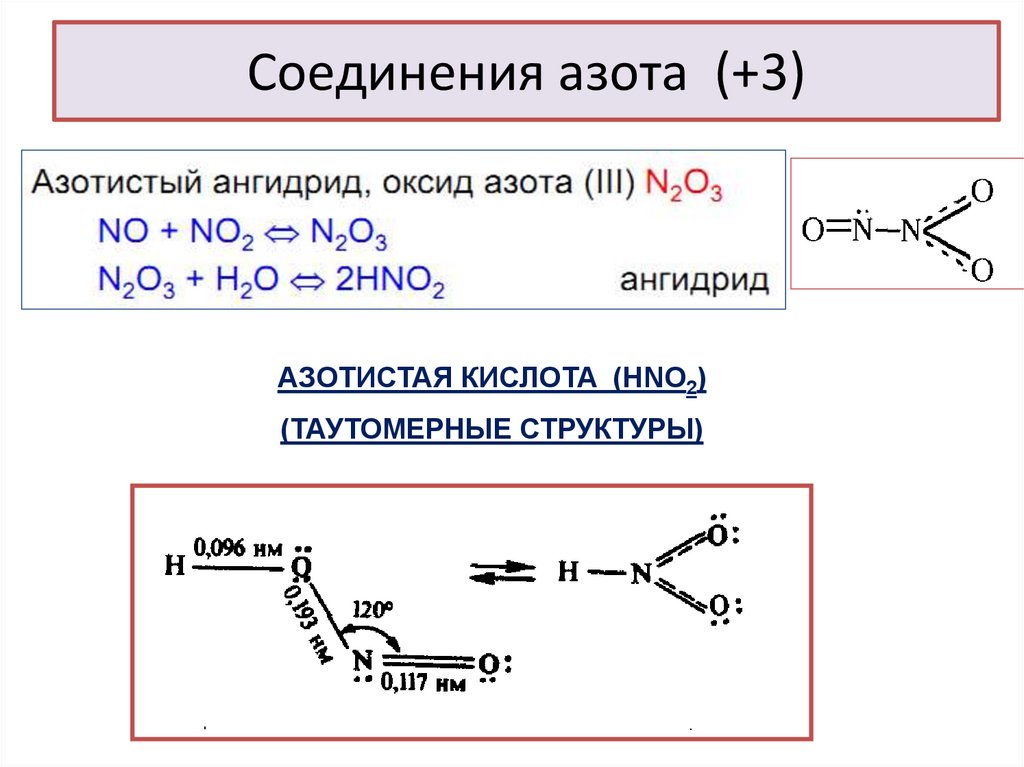



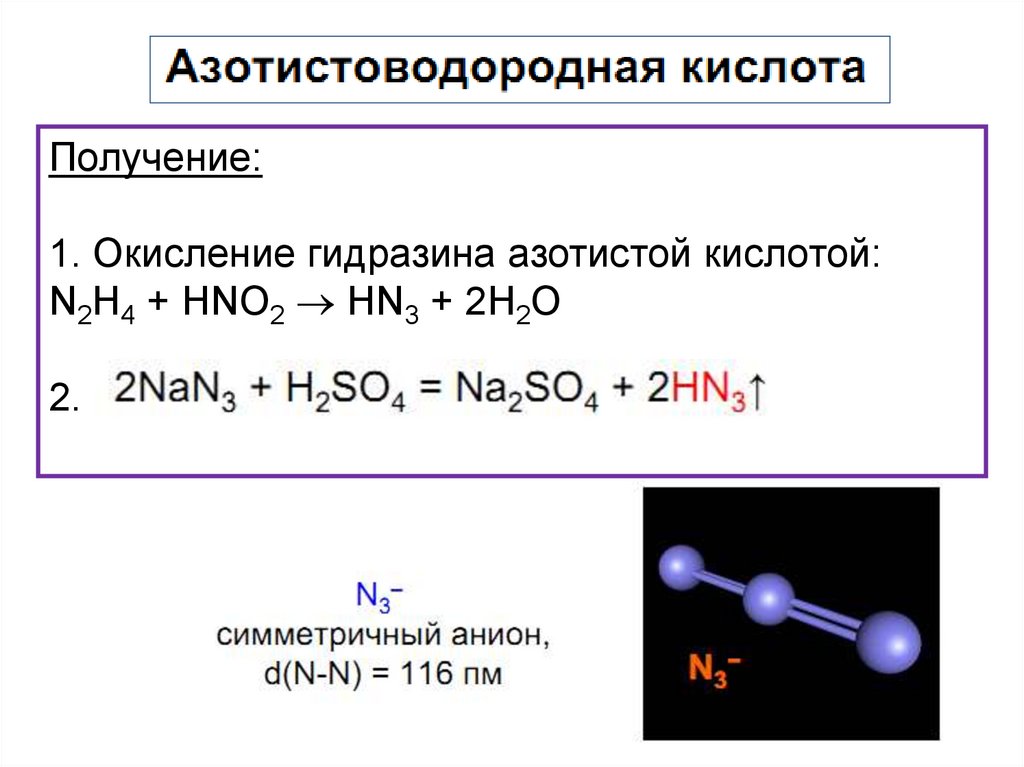

















 chemistry
chemistry