Similar presentations:
Комплексные (координационные) соединения. Строение
1.
Комплексные (координационные) соединенияСтроение
Соединения высшего порядка
NH3
NH3
CuSO4 + 4NH3 [Cu(NH3)4]SO4
(в водной среде и для кристаллогидратов исходные
вещества – уже комплексы
[Cu(H2O)4]SO4*H2O + 4NH3 [Cu(NH3)4]SO4 + 5H2O )1
2.
(ортофосфат тетрааквоуранила)[Co(NH3)6]Cl3
K3[Fe(CN)6]
K4[Fe(CN)6] [Fe(H2O)6]SO4*H2O
2
3.
Становление «Вернеровской» координационной химии. Первыесинтезы координационных соединений
1702, Diesbach, - т.н. кровяные соли K3[Fe(CN)6] и K4[Fe(CN)6]3–, а
также “берлинская лазурь”, она же “турнбулева синь” KFe [Fe(CN)6]
1763, Lewis,
K2[PtCl6]
1798 Tassaert,
1828, Magnus,
Zeise,
[Co(NH3)6]Cl3
[Pt(NH3)4][PtCl4]
K[PtCl3(C2H4)]·H2O
1849, Playfair,
Na2[Fe(CN)5(NO)]·2H2O
1858, Roussin,
[Fe2S2(NO)4]2–
1869, Schützenberger, [Pt(CO)2Cl2]
1888 Mond
1963-65, Vaska,
[Ni(CO)4] (1919, Hein, - комплексы Cr(0) с C6H6)
[Ir(CO)Cl(P(C6H5)3)2(O2)],
Allen, Senoff, [Ru(NH3)5(N2)]2+ (!)
1984, Kubas,
[ W(CO)3( P(C6H5)3)2( H2)]
2000, Seidel, Seppelt, [AuXe4]2+ – ксенон как лиганд! ( [AuXe4]2[SbF6]2 )
2004 - von Schleyer [Ti(P5)2] –, P5 – - аналог С5Н5–
3
4.
Литература•Басоло Ф., Джонсон Р. Химия координационных соединений. – М.: Мир, 1966.
•Гринберг А.А. Введение в химию координационных соединений. М. – Л.:
Химия, 1966.
•Кукушкин Ю.Н. Химия координационных соединений. – М.: Высш. шк., 1985.
•Костромина Н.А., Кумок В.Н., Скорик Н.А. Химия координационных соединений.
М.: Высш. шк., 1990.
•Скопенко В.В., Григорьева В.В. Координационная химия. Киев: Вища школа, 1987.
•Кукушкин В.Ю., Кукушкин Ю.Н. Теория и практика синтеза координационных
соединений. Л.: Наука, 1990.
•Бек М., Надьпал И. Исследование комплексообразования новейшими методами:
Пер. с англ. – М: Мир, 1989.
•Березин Б.Д. Координационные соединения порфиринов и фталоцианина. – М:
Наука, 1978.
•Бальхаузен К., Введение в теорию поля лигандов, М.: Мир, 1964.
•Берсукер И.Б., Электронное строение и свойства координационных соединений, Л.:
Химия, 1986.
•Ливер Э., Электронная спектроскопия неорганических соединений, М.: Мир, 1987,
тт.1,2.
•Свиридов Д.Т., Свиридова Р.К., Смирнов Ю.Ф., Оптические спектры ионов
переходных металлов в кристаллах, М.: Наука, 1976.
•Хартли Ф.,Беогес К., Олкок Р., Равновесия в растворах, М.: Мир, 1983.
•Третьяков Ю.Д., Мартыненко Л.И., Григорьев А.Н., Цивадзе А.Ю. Неорганическая
химия. Кн. I., II. М. Химия. 2001.
•Координационная химия редкоземельных элементов. Под ред. В.И. Спицына.М.
МГУ. 1979. 252 С.
4
5.
Комплексные соединения это…“соединения, существующие как в кристаллическом
состоянии, так и в растворе, особенностью которых является
наличие центрального атома (акцептора электронов),
окруженного лигандами (донорами электронов). Лиганды
способны ступенчато и обратимо отщепляться от
центрального иона по гетеролитическому типу. В большинстве
случаев в молекулярном виде координационные соединения
могут рассматриваться как состоящие из молекул, способных к
самостоятельному существованию.”
(Ю.Н. Кукушкин, 1985)
5
6.
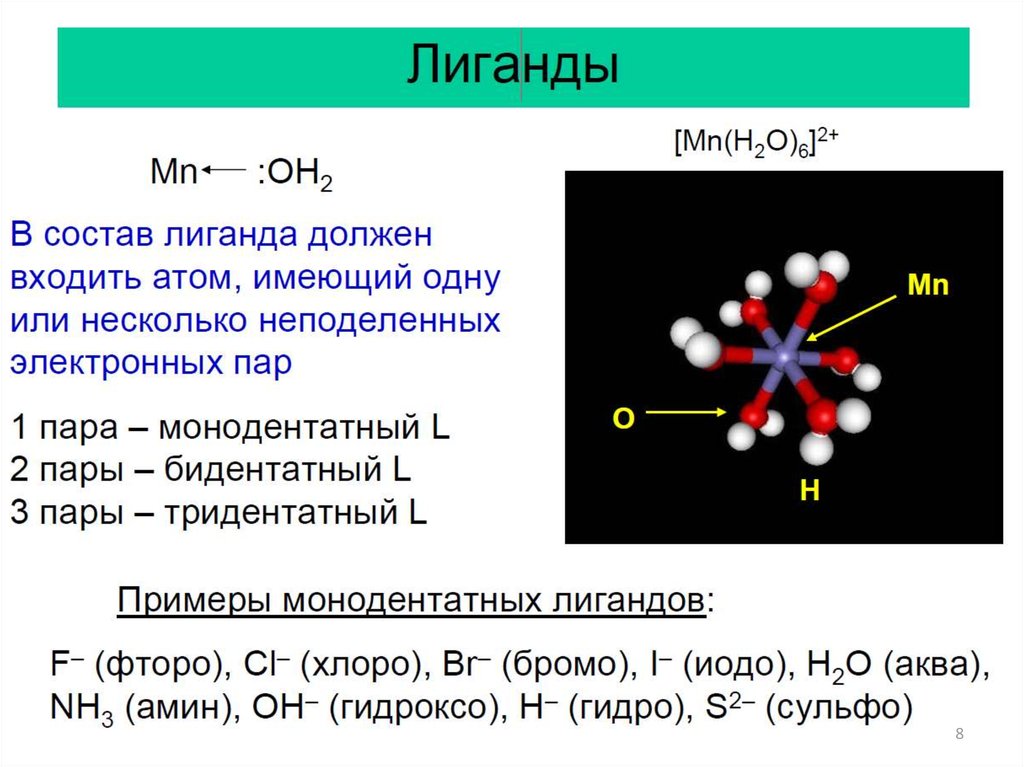
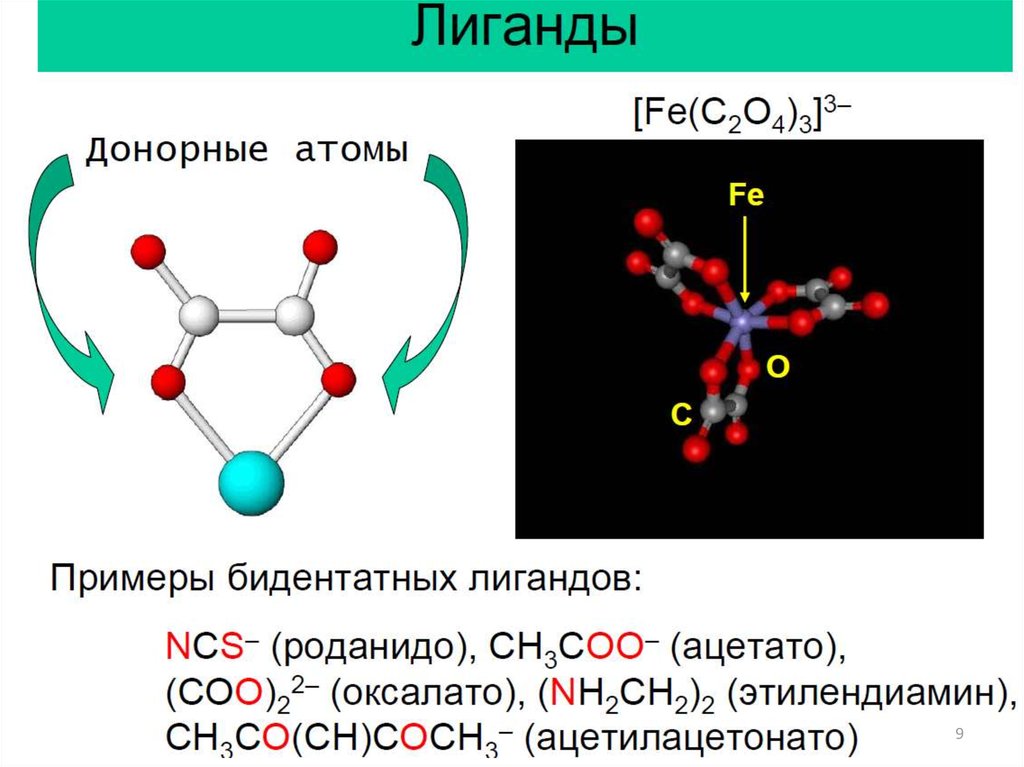
Основные понятия:1. Центральный атом.
2. Лиганды.
3. Дентатность.
4. Координационная сфера, координационное
число.
5. Классификация комплексов.
6
7.
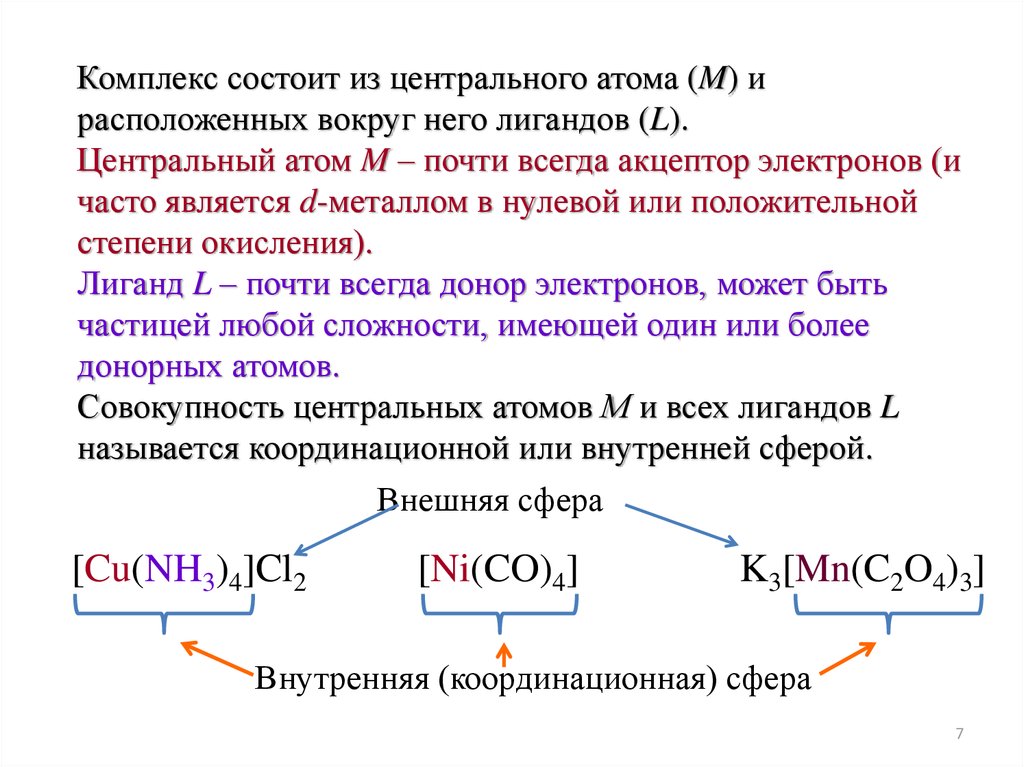
Комплекс состоит из центрального атома (M) ирасположенных вокруг него лигандов (L).
Центральный атом M – почти всегда акцептор электронов (и
часто является d-металлом в нулевой или положительной
степени окисления).
Лиганд L – почти всегда донор электронов, может быть
частицей любой сложности, имеющей один или более
донорных атомов.
Совокупность центральных атомов М и всех лигандов L
называется координационной или внутренней сферой.
Внешняя сфера
[Cu(NH3)4]Cl2
[Ni(CO)4]
K3[Mn(C2O4)3]
Внутренняя (координационная) сфера
7
8.
89.
910.
Номенклатура10
11.
Номенклатура11
12.
1213.
Определение по О.В. Михайлову:Комплекс – это химическое соединение, отличительной
особенностью которого является наличие как минимум
одного
центрального
атома
(комплексообразователя),
окруженного определенным образом частицами (лигандами),
способными к самостоятельному существованию и
равновесному отщеплению от этого комплексобразователя.
Как
правило,
хотя
бы
часть
связей
между
комплексообразователем и лигандами осуществляется по
донорно-акцепторному механизму.
13
14.
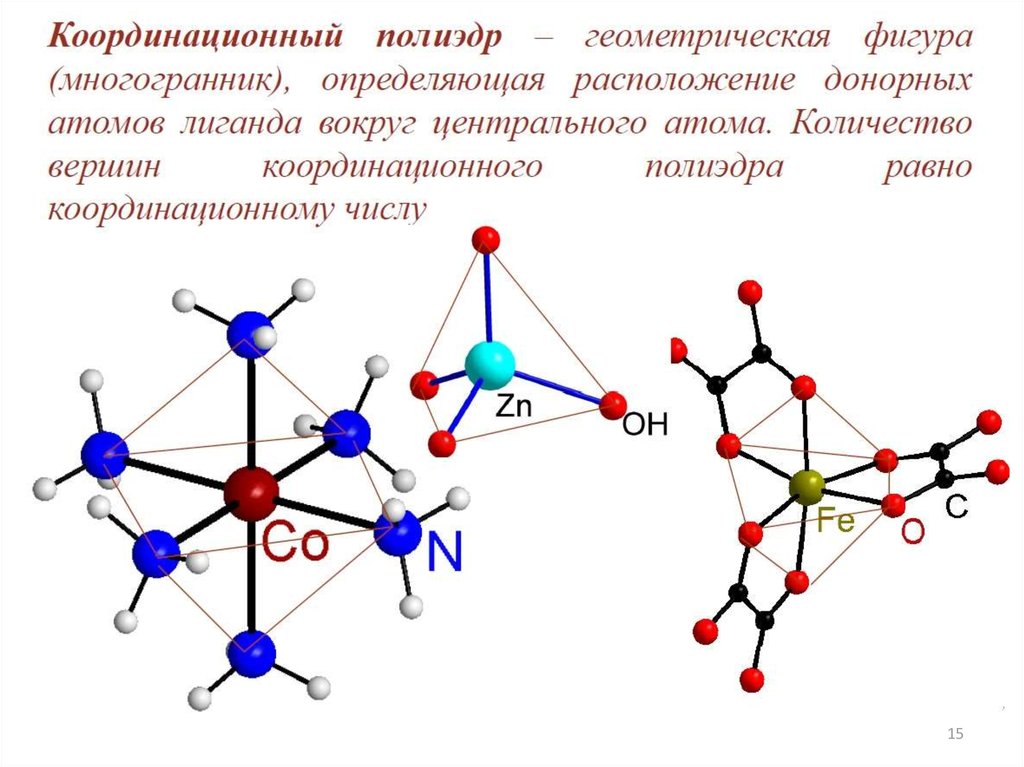
1415.
1516.
1617.
Строение комплексов d-металлов1. Не определяется правилами Гиллеспи.
2. В первом приближении основано на
донорно-акцепторном взаимодействии
металл – лиганд.
3. Учитывает степень окисления и
электронную конфигурацию центрального
атома
17
18.
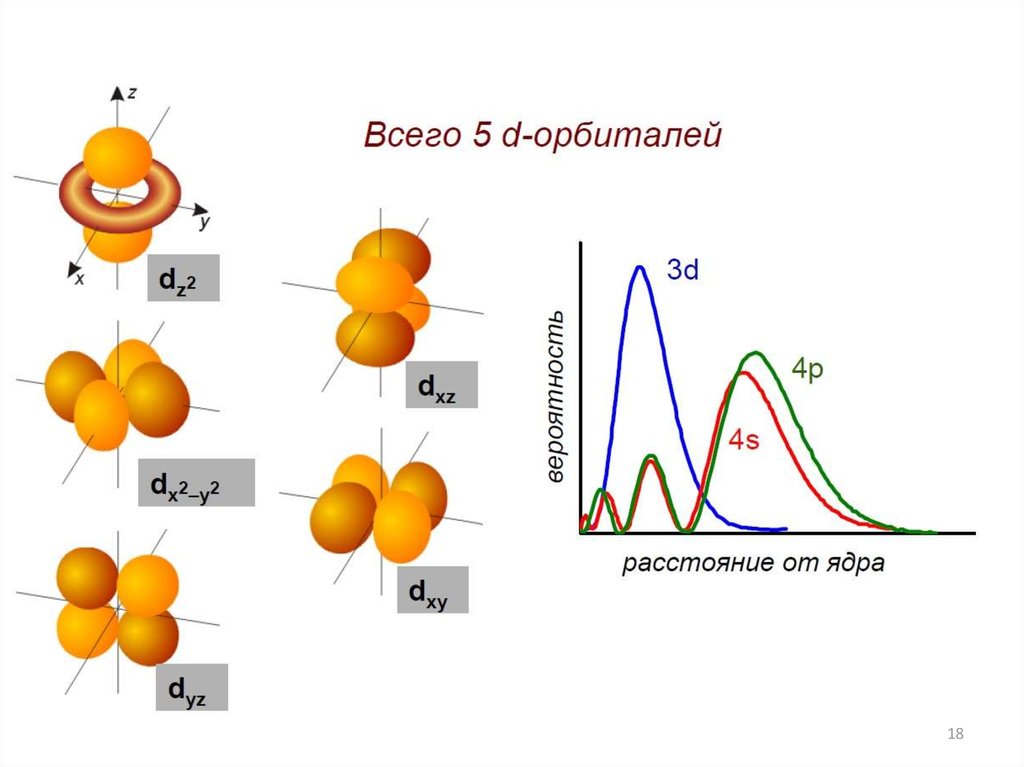
1819.
Электронная конфигурация центральногоатома (иона)
19
20.
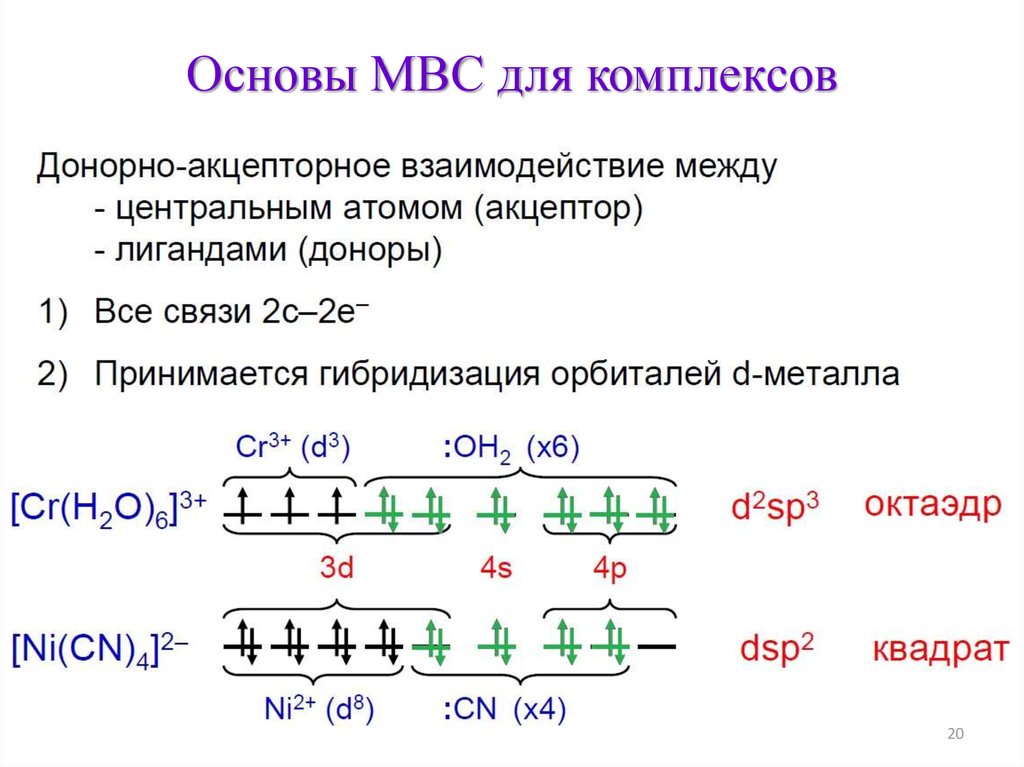
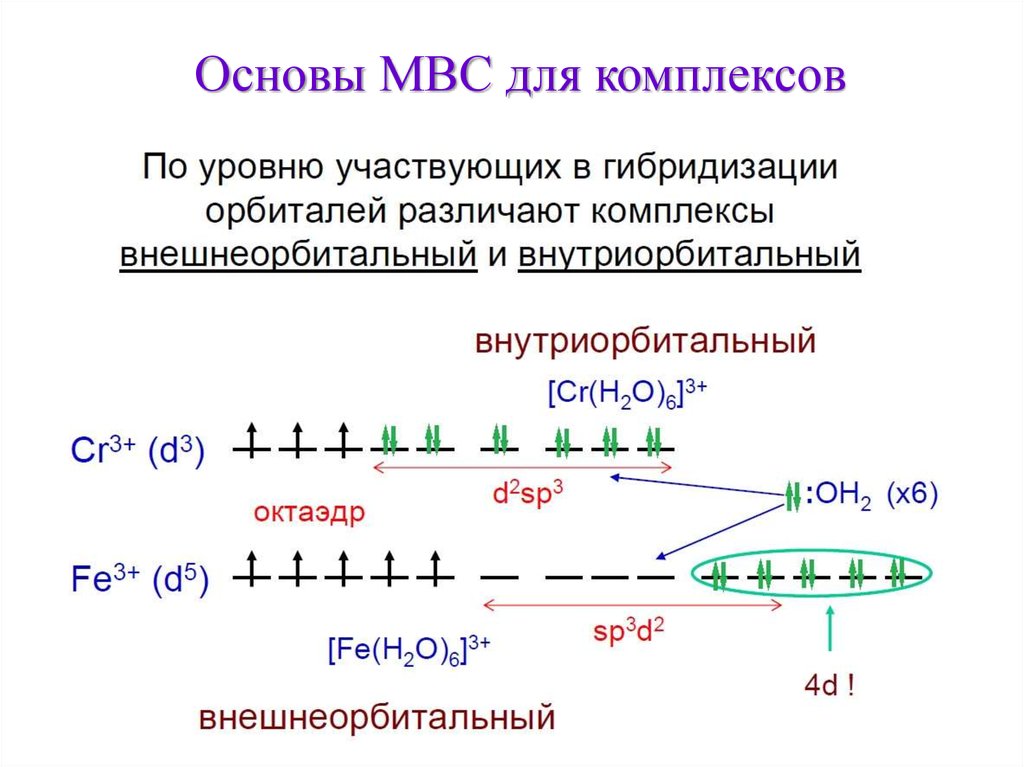
Основы МВС для комплексов20
21.
Основы МВС для комплексов21
22.
Основы МВС для комплексовЭлектронное строение и магнитные свойства
22
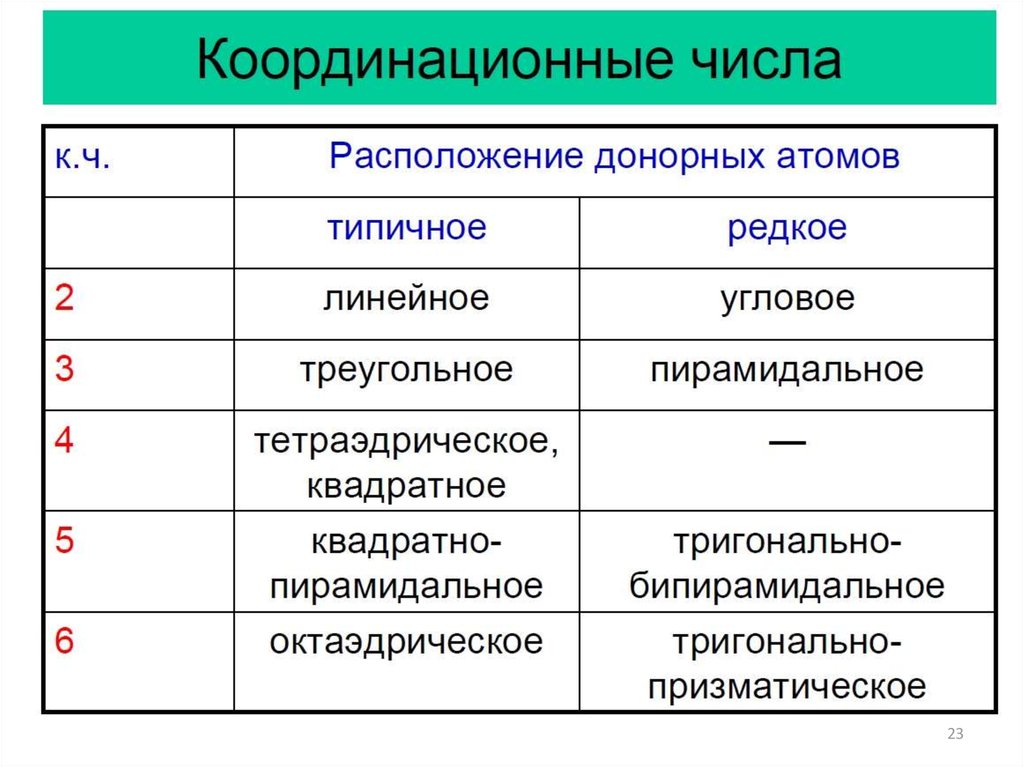
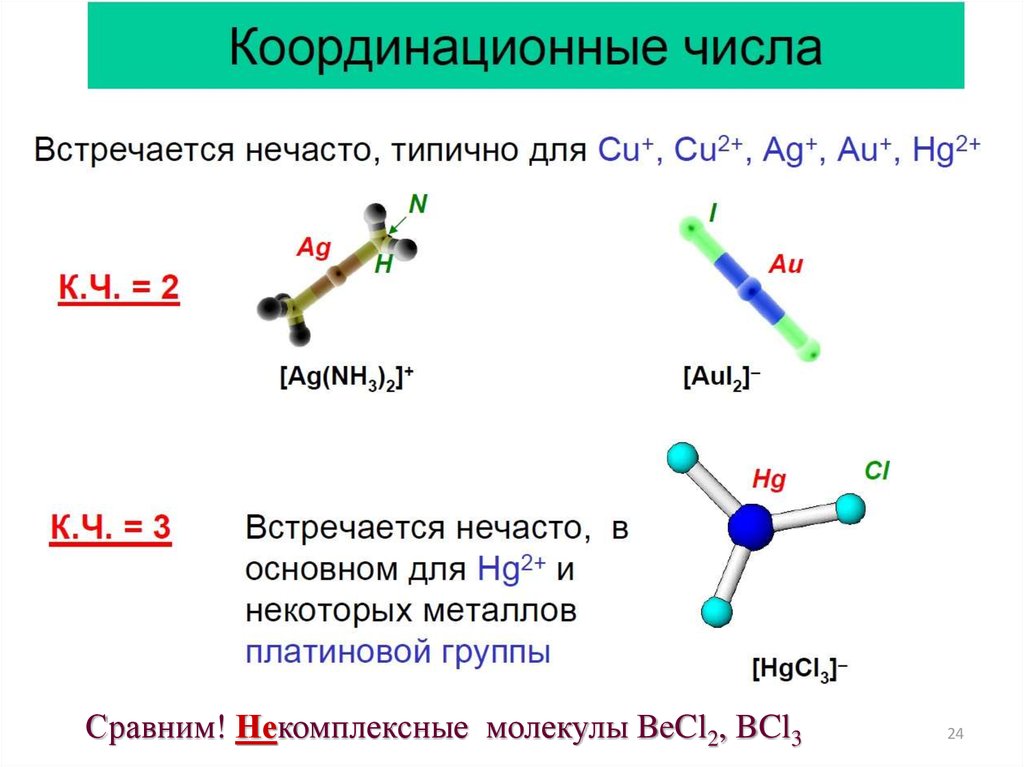
23.
2324.
Сравним! Некомплексные молекулы BeCl2, BCl324
25.
Сравним! Некомплексные молекулы ССl4, XeCl425
26.
Сравним! Некомплексные молекулы IF5, PF526
27.
Сравним! Некомплексные молекулы SF627
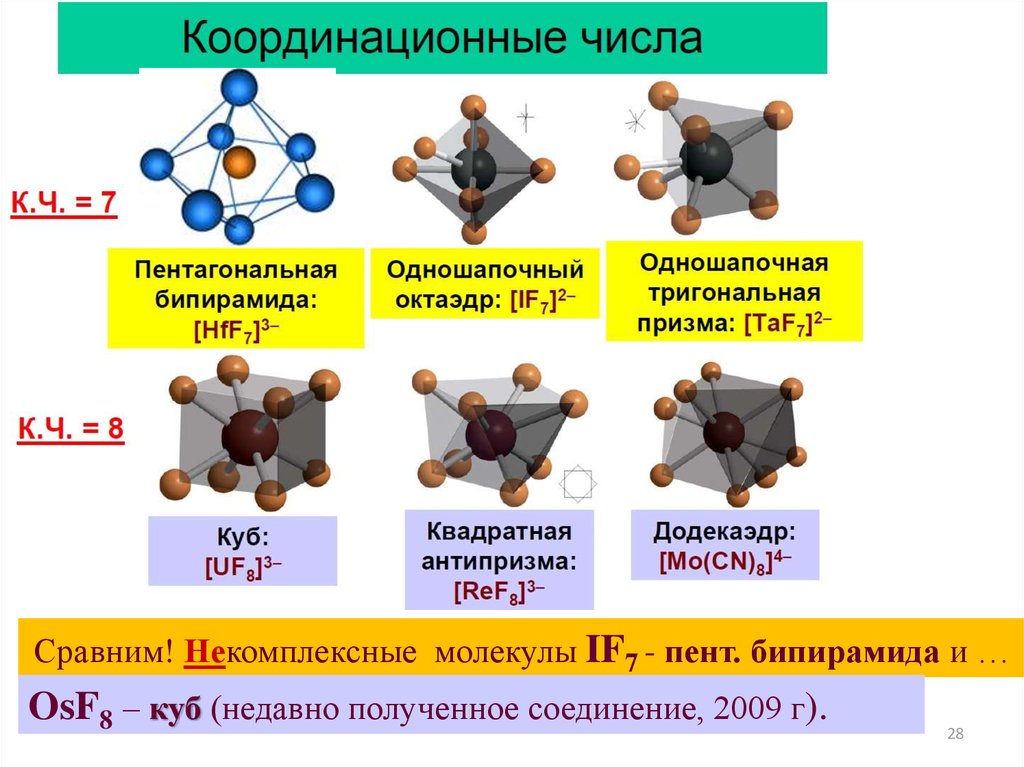
28.
Сравним! Некомплексные молекулы IF7 - пент. бипирамида и …OsF8 – куб (недавно полученное соединение, 2009 г).
28
29.
Координационные числаК.Ч. = 9
[ReH9]2−,
[Nd(OH2)9]3+
Трёхшапочная тригональная призма
29
30.
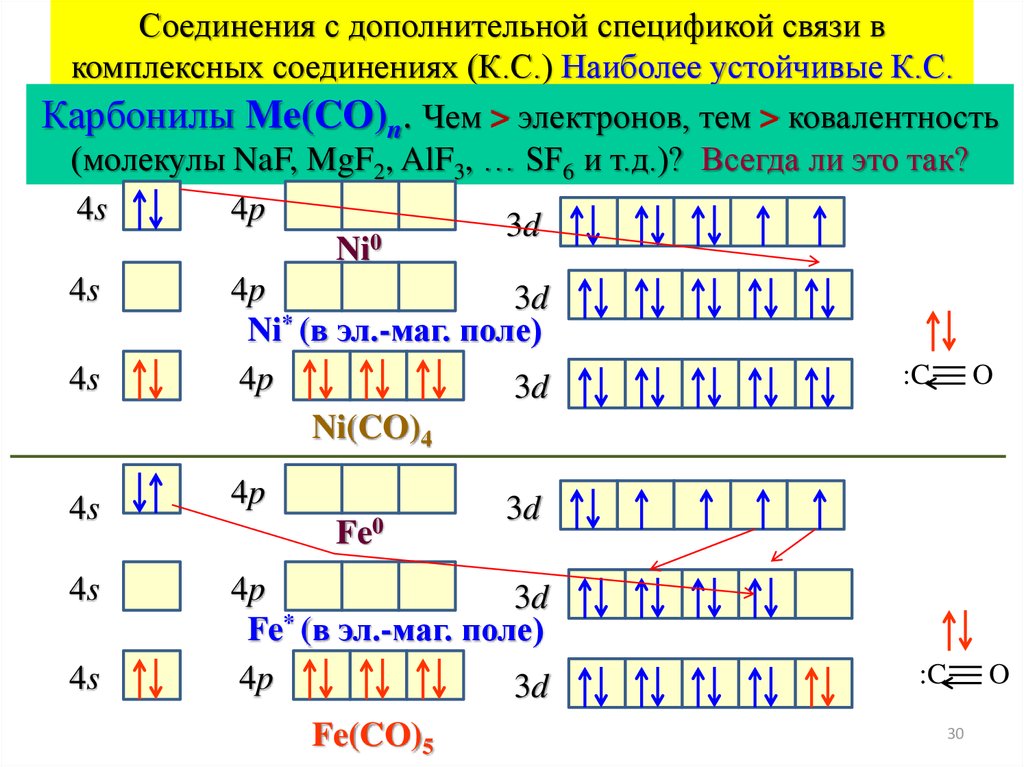
Соединения с дополнительной спецификой связи вкомплексных соединениях (К.С.) Наиболее устойчивые К.С.
Карбонилы Me(CO)n. Чем > электронов, тем > ковалентность
(молекулы NaF, MgF2, AlF3, … SF6 и т.д.)? Всегда ли это так?
4s
4p
3d
0
Ni
4s
4p
3d
Ni* (в эл.-маг. поле)
:C O
4s
4p
3d
Ni(CO)4
4s
4p
4s
4p
3d
Fe* (в эл.-маг. поле)
4p
3d
4s
Fe0
Fe(CO)5
3d
:C
O
30
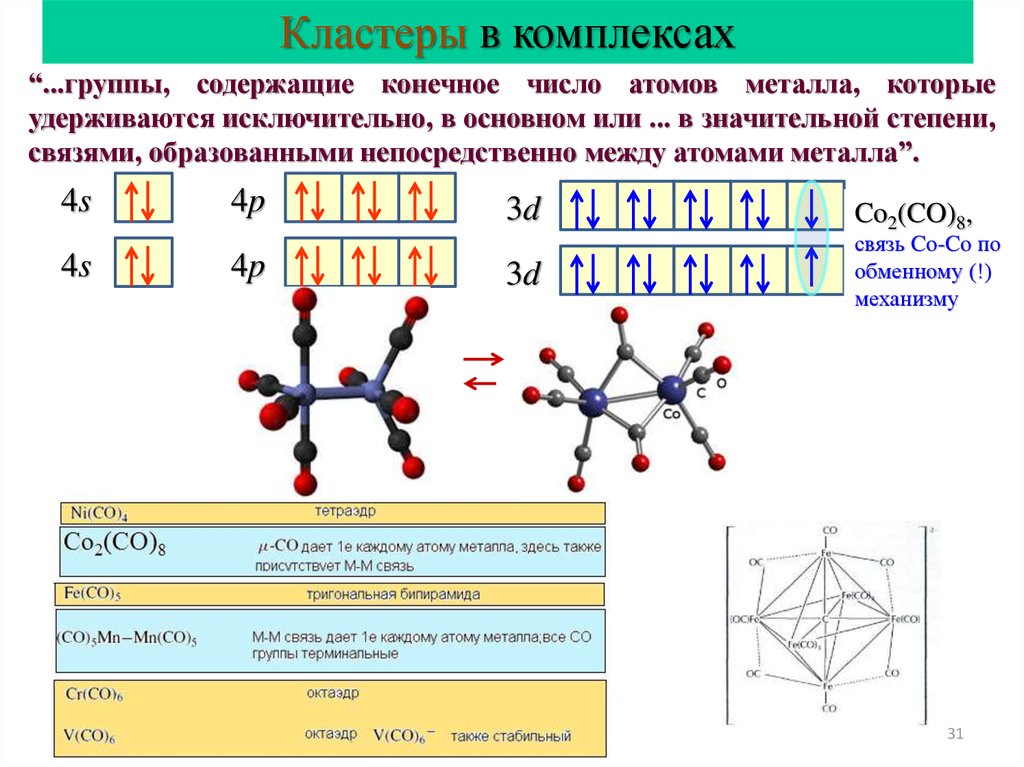
31.
Кластеры в комплексах“...группы, содержащие конечное число атомов металла, которые
удерживаются исключительно, в основном или ... в значительной степени,
связями, образованными непосредственно между атомами металла”.
4s
4s
4p
4p
3d
3d
Co2(CO)8,
связь Co-Co по
обменному (!)
механизму
Co2(CO)8
31
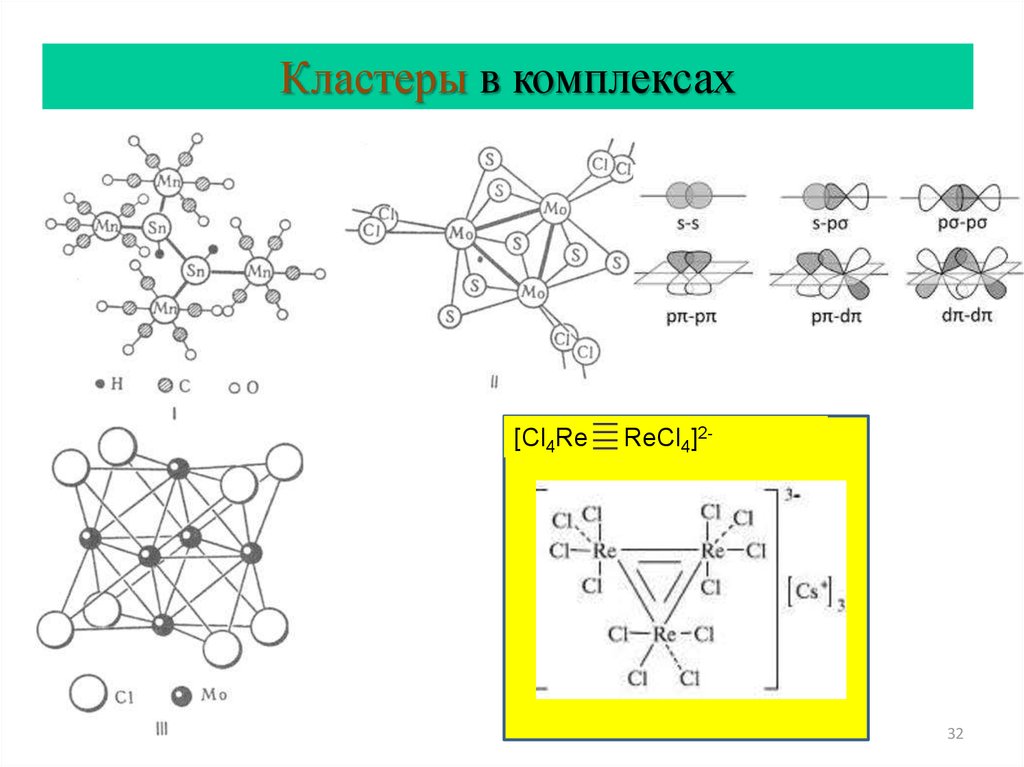
32.
Кластеры в комплексах[Cl4Re
ReCl4]2-
32
33.
Соединения с дополнительной спецификой связи вкомплексных соединениях (К.С.) Наиболее устойчивые К.С.
Дополнительное -связывание в комплексах
33
34.
Соединения с дополнительной спецификой связи вкомплексных соединениях (К.С.) Наиболее устойчивые К.С.
Дополнительное -связывание в комплексах. “Цены”
Ферроцен, [(C5H5)2Fe]
Торио- и урано- цены
34
35.
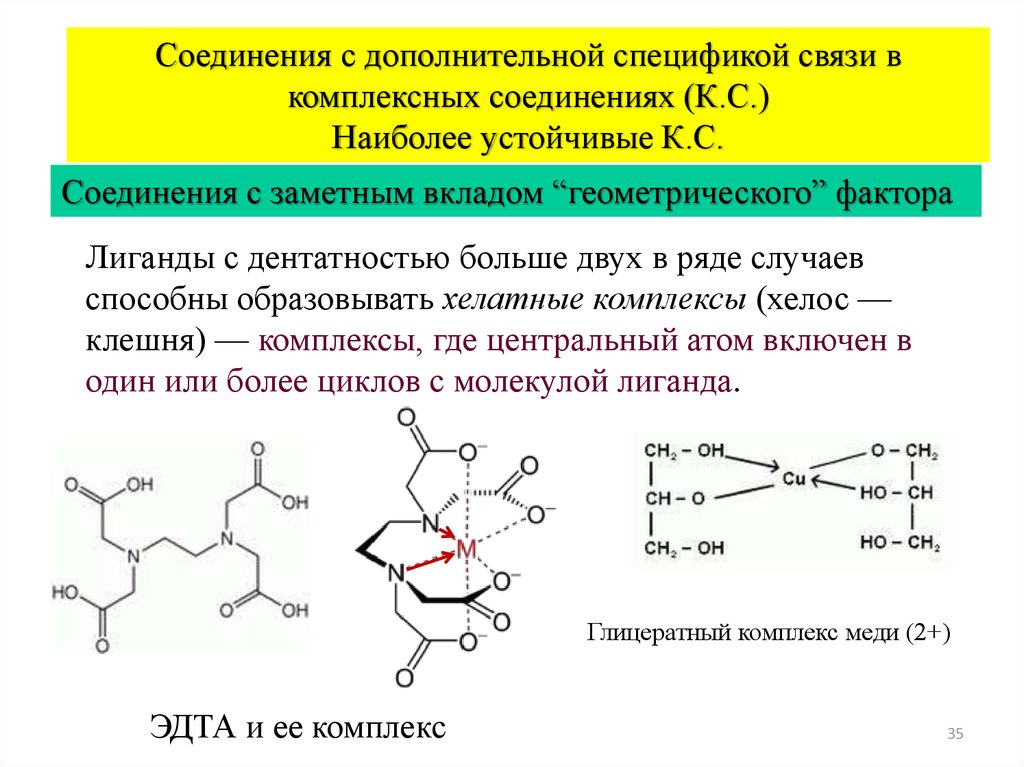
Соединения с дополнительной спецификой связи вкомплексных соединениях (К.С.)
Наиболее устойчивые К.С.
Соединения с заметным вкладом “геометрического” фактора
Лиганды с дентатностью больше двух в ряде случаев
способны образовывать хелатные комплексы (хелос —
клешня) — комплексы, где центральный атом включен в
один или более циклов с молекулой лиганда.
Глицератный комплекс меди (2+)
ЭДТА и ее комплекс
35
36.
Соединения с заметным вкладом “геометрического” фактораКраун-эфиры и комплексы этих эфиров
Сферанды
Криптанды и криптаты
36
37.
Супрамолекулярные соединения (комплексы комплексов)37
38.
Преимущества и недостатки МВС:МВС – очень наглядный метод, объясняет
геометрическое строение известных комплексов
МВС – очень наглядный метод, объясняет геометрическое
строение известных комплексов
Но:
1. Имеет очень малую предсказательную силу
2. Не описывает магнитные свойства комплексов
3. Не объясняет окраску комплексов
4. Не всегда объясняет различную устойчивость комплексов
5. Не всегда учитывает π- связывание
6. Не позволяет оценить энергетические параметры
38























 chemistry
chemistry








