Similar presentations:
Периодический Закон и периодическая система в свете учения о строении атомов
1. Периодический Закон и периодическая система в свете учения о строении атомов.
Автор: Симонов Виталийуч-ся 9 класса
МАОУ СОШ №4 п. Новоорск.
Руководитель: Шурыгина Галина
Александровна
учитель химии – биологии.
2. Цели:
• Проследить общие закономерности структурыпериодической системы химических
элементов в свете учения о строения атома.
3. Заряд ядра – главная характеристика химических элементов.
• Учение о строении атомов вскрыло глубокийфизический смысл периодического закона.
• Главной характеристикой атома является
положительный заряд ядра, определяющий число
электронов в электронной оболочке атома, её
строение, а тем самым все свойства элемента и его
положение в периодической системе.
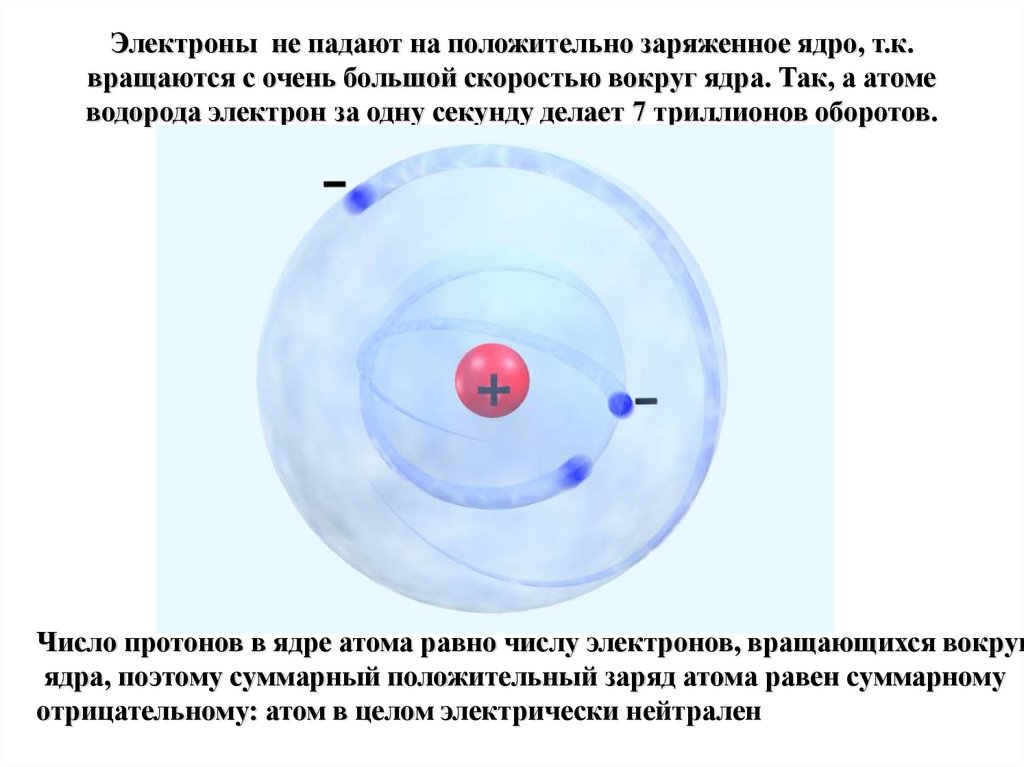
4. Электроны не падают на положительно заряженное ядро, т.к. вращаются с очень большой скоростью вокруг ядра. Так, а атоме
водорода электрон за одну секунду делает 7 триллионов оборотов.Число протонов в ядре атома равно числу электронов, вращающихся вокруг
ядра, поэтому суммарный положительный заряд атома равен суммарному
отрицательному: атом в целом электрически нейтрален
5. В связи с этим претерпела изменение и формулировка закона:
• Свойства химических элементов, а также формыи свойства их соединений находятся в
периодической зависимости от заряда ядер их
атомов.
• Такая формулировка нисколько не противоречит формулировке,
данной Менделеевым, а только базируется на новых данных,
которые придают закону и системе научную обоснованность и
подтверждают их правильность.
• Периодическая система элементов Д.И. Менделеева отражает
периодический закон, а вместе с тем и строение атомов
элементов.
6. Физический смысл периодического закона:
• Теория строения атомов объясняет периодическоеизменение свойств элементов. Возрастание
положительных зарядов атомных ядер от 1 до 109
обусловливает периодическое повторение строения
внешнего энергетического уровня. А поскольку
свойства элементов в основном зависят от числа
электронов на внешнем уровне, то и они
периодически повторяются.
7.
• С ростом положительного заряда ядер атомоввозрастает число электронов на внешнем уровне (от 1
до 2 – в I периоде, и от 1 до 8 – во II и III периодах),
что объясняет изменение свойств элементов: в начале
периода (кроме I) находятся щелочной металл, затем
металлические свойства постепенно ослабевают и
усиливаются неметаллические свойства.
8.
• С ростом заряда ядер заполнение уровнейэлектронами происходит сложнее т. к. изменение
свойств элементов по сравнению с элементами малых
периодов тоже сложное. Так, в чётных рядах
больших периодов с ростом заряда число электронов
на внешнем уровне остаётся постоянным и равно –
• 2 или 1. Поэтому, пока идёт заполнение электронами
предвнешнего уровня, свойства элементов в этих
рядах изменяются крайне медленно.
9.
В свете учения о строении атомов становится обоснованным разделениеД.И. Менделеевым всех элементов на семь периодов. Номер периода
соответствует числу энергетических уровней атомов, заполняемых
электронами. Поэтому S – элементы имеются во всех периодах,
P – элементы – во II и последующих, d - элементы – в IV и последующих
И f - элементы – в VI и VII периодах.
10. Легко объяснимо деление групп на подгруппы:
• Основано оно на различии в заполнении электронамиэнергетических уровней. У элементов главных подгрупп
заполняется или s – подуровни или p – подуровни внешних
уровней.
• У элементов побочных подгрупп заполняется d – подуровень
предвнешнего уровня. У лантаноидов и актиноидов
заполняется соответственно 4 f - и 5 f – подуровни.
• Таким образом, в каждой подгруппе объединены элементы,
атомы которых имеют сходное строение внешнего электронного
уровня.
11.
• Различия в строении обусловливает и различия всвойствах элементов разных подгрупп одной группы.
• Так, на внешнем уровне атомов элементов
подгруппы галогенов имеется по семь электронов, а
подгруппы марганца – по два электрона.
• Первые – типичные неметаллы, а вторые – металлы.
12. Физический смысл номера группы:
Таким образом, у элементов побочных подгрупп валентными являютсяэлектроны не только внешних, но и предвнешних уровней – в чём и состоит
основное различие в свойствах элементов главных и побочных подгрупп.
Отсюда следует, что номер группы, как правило, указывает число электронов,
которые могут участвовать в образовании химической связи.
13.
Итак, строение атома обусловливает две закономерности:Изменение свойств по горизонтали – в периоде слева
направо ослабляет металлические и усиливает
неметаллические свойства;
2. Изменение свойств по вертикали – в подгруппе с
ростом порядкового номера усиливаются
металлические свойства и ослабевают
неметаллические.
1.
14. Ресурсы:
• Балезин С.А., Бесков С.Д. Выдающиеся русскиеученые-химики. М.: Просвещение, 1972, 222 с.;
Габриелян О.С. Химия. 8 класс. М.: Дрофа, 2000;
Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия. 8
класс. М.: Дрофа, 2000;
Химия в школе, 1993, № 2, с. 74–75; № 3, с. 24–28; №
5, с. 33;
Ватаману И. Приключения Атомика. Повесть.
Кишинев: Литература артистикэ, 1989;
Куликова Е.Л. Вечера занимательной химии. Минск:
Народная асвета, 1986.












 chemistry
chemistry








