Similar presentations:
Химическая связь. Строение вещества
1. Химическая связь
Составители: учитель химииПищалова С.Е., учащиеся 11а класса
Морозов Евгений, Лазарев Евгений
2. Строение вещества
Экспериментальными даннымиустановлено, что свойства веществ и их
реакционная способность зависит от
химического строения их молекул.
состав
вещество
строение
свойства
3. Классическую теорию химической связи предложил Гилберт Ньютон Льюис 1916г
В природе свободные атомы встречаютсякрайне редко, известно что благородные газы
(He, Ne, Ar, Xe) существуют в виде одиночных
атомов.
Все остальные существуют в виде молекул и
кристаллов (свыше 18 млн.)
Все атомы стремятся приобрести устойчивую
электронную оболочку (дуплет или октет) за
счет химической связи друг с другом.
4. Химическая связь
Химическая связь - совокупность сил,действующих между атомами или
группами атомов, приводящих к
образованию молекул или кристаллов.
Различают 3 основных вида химической связи:
Ковалентная
Ионная
Металлическая
Водородная (разновидность ковалентной )
Донорно-акцепторная (разновидность ковалентной )
5. Ковалентная связь
Ковалентная связь – это связь атомов спомощью общих электронных пар.
Ковалентная связь – образованная атомами
одного неметалла с одинаковой ЭО
называется - неполярной
(H2, Cl2, O2, N2 и др.)
При образовании неполярной связи область
перекрывания электронных облаков
находится на одинаковом расстоянии от
обоих атомов
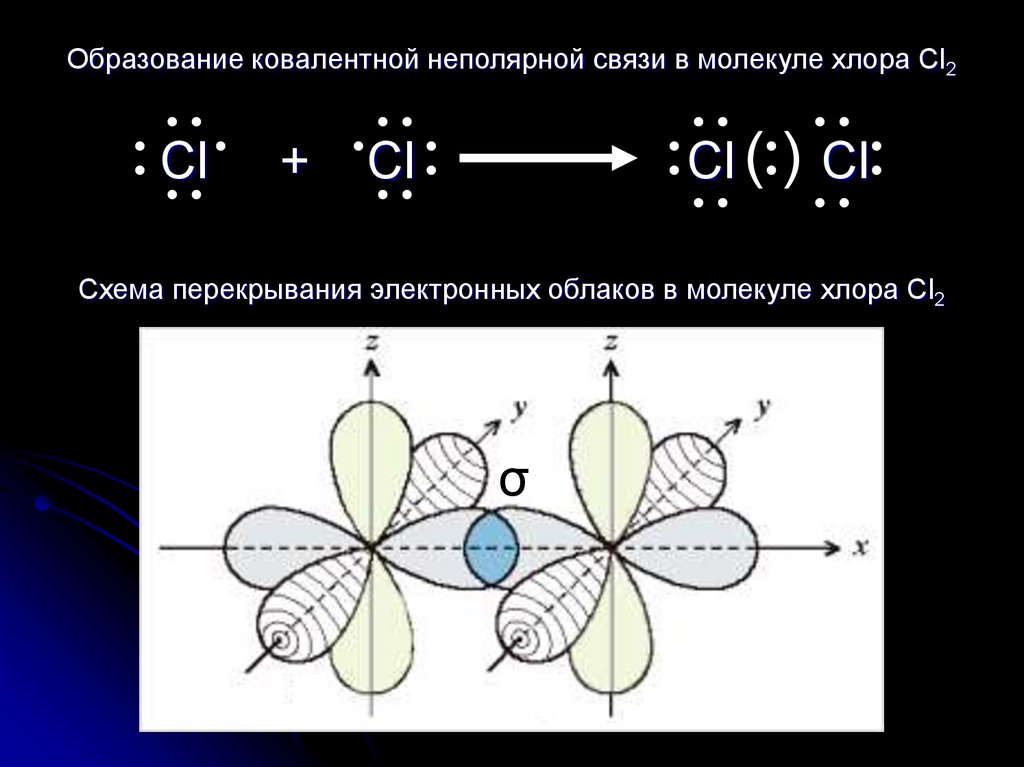
6.
Образование ковалентной неполярной связи в молекуле хлора Cl2Cl
+
Cl (
Cl
) Cl
Схема перекрывания электронных облаков в молекуле хлора Cl2
σ
7.
Неполярными являются связи вмолекулах простых веществ:
H2, O2, Cl2, N2 и др.
N
+
N
N ( )N
8.
Полярная связь – это ковалентная связь междуатомами с различной ЭО в молекулах,
образованных атомами различных неметаллов
(HCl, H2O, PCl3 и др.)
При образовании полярной связи область
перекрывания электронных облаков
смещается в сторону атома с большей ЭО.
.
H
+ Cl
H ( ) Cl
ЭО: 2,1
3,0
9.
Чем больше разность величин ЭО связанныхатомов, тем больше полярность связи.
Например:
H-F
H - Cl
H - Br
H-J
ЭО
2,1 4,0
2,1 3,0
2,1 2,8
2,1 2,6
∆ЭО
1,9
0,9
0,7
0,5
Полярность связи уменьшается
10.
Механизмы образованияковалентной связи
Обменный ( за счет объединения
неспаренных электронов)
Донорно – акцепторный (за счет
неподеленной электронной пары одного
атома (донора) и свободной орбитали
другого (акцептора))
11.
По способу перекрывания электронныхоблаков различают:
σ–связи - это ковалентные связи, при
образовании которых область перекрывания
электронных облаков находится на линии,
соединяющей ядра атомов. (H2 и Cl2 )
π-связи - ковалентные связи, при образовании
которых область перекрывания электронных
облаков находится по обе стороны от линии,
соединяющей ядра атомов.
( N2 – 2π и 1σ связь)
12.
По числу общих электронных пар ковалентныесвязи бывают:
одинарными;
двойными;
тройными.
Если связь образована одной общей
электронной парой, то такая связь
называется одинарная (простая).
Если связь между атомами образуется двумя
общими электронными парами, то такая
связь называется двойной (кратная).
Если тремя общими электронными парами, то
тройной (кратная).
13. Ионная связь
Связь между атомами типичных металлов (I иIIА гр.) и атомами типичных неметаллов (VI
и VIIА гр.) называется ионной ( KF, Na2O,
CaO).
При образовании ионной связи атомы типичных
металлов отдают электроны
Na0 – 1eNa+1 (ион натрия)
1s22s22p63s1
1e-
1s22s22p6
8e-
Заряд катиона равен числу отданных
электронов
14.
Атомы типичных неметаллов принимаютэлектроны
Cl0 + 1e1s22s22p63s23p5
7e-
Cl-1 (ион натрия)
1s22s22p63s23p6
8e
Величина отрицательного заряда аниона
равна числу принятых электронов
Говорят что ионная связь является
крайним случаем ковалентной полярной
15.
В результате электростатическогопритяжения между катионом и анионом
образуется молекула с ионным типом
связи
+
Катион
+
Анион
+
-
Молекула
16.
Вывод: Тип связи между молекулами можноопределить по разности
электроотрицательности(∆ЭО).
∆ЭО
Тип связи
Примеры
0
Ковалентная
неполярная
Cl – Cl (∆ЭО=0)
<1,7
Ковалентная
полярная
H – Cl (∆ЭО=0,9)
>1,7
Ионная
Na – Cl (∆ЭО=2,1)
17. Металлическая связь
В металлах и сплавахХарактеризуется:
Большим числом свободных орбиталей
Небольшим числом валентных
электронов (электронный газ)
Ме0 - ne → Меn+
18. Водородная связь
Химическая связь между положительнополяризованными атомами водорода одной
молекулы и отрицательно поляризованными
атомами сильно ОЭО элементов, имеющих
неподеленные электронные пары (F,O,N и
реже Cl и S) другой молекулы.
HF…HF…
NH3… NH3 … H2O…H2O…
C2H5-OH…OH-C2H5
В молекулах белков (вторичная структура),
ДНК ( принцип комплементарности)
ОЭО относительная электроотрицательность
19. Определить тип связи и рассмотреть схемы ее образования.
1 вариант Ca CaF2 F2 (CH3OH)2 вариант OF2 AlCl3 NH3 O2
3 вариант CO SO3 S8 MgBr2

















 chemistry
chemistry








