Similar presentations:
Гетероциклические соединения
1.
ГЕТЕРОЦИКЛИЧЕСКИЕСОЕДИНЕНИЯ
2.
Гетероциклическими называютсоединения циклического
строения, содержащие в цикле не
только атомы углерода, но и
атомы (один или несколько)
других элементов (кислорода,
азота, серы, фосфора и др.).
3.
Гетероциклические соединения – самаяраспространенная группа органических
соединений. Они входят в состав многих
веществ природного происхождения, таких как
нуклеиновые кислоты, хлорофилл, гемоглобин
крови, алкалоиды, пенициллины, многие
витамины. Гетероциклические соединения
играют важную роль в процессах метаболизма,
обладают высокой биологической активностью.
Значительная часть современных
лекарственных веществ содержит в своей
структуре гетероциклы.
4.
Классификация :1) по размеру цикла (числу атомов
в цикле);
2) по природе гетероатома;
3) по числу гетероатомов в цикле;
4) по степени ненасыщенности
(насыщенные и ненасыщенные).
5.
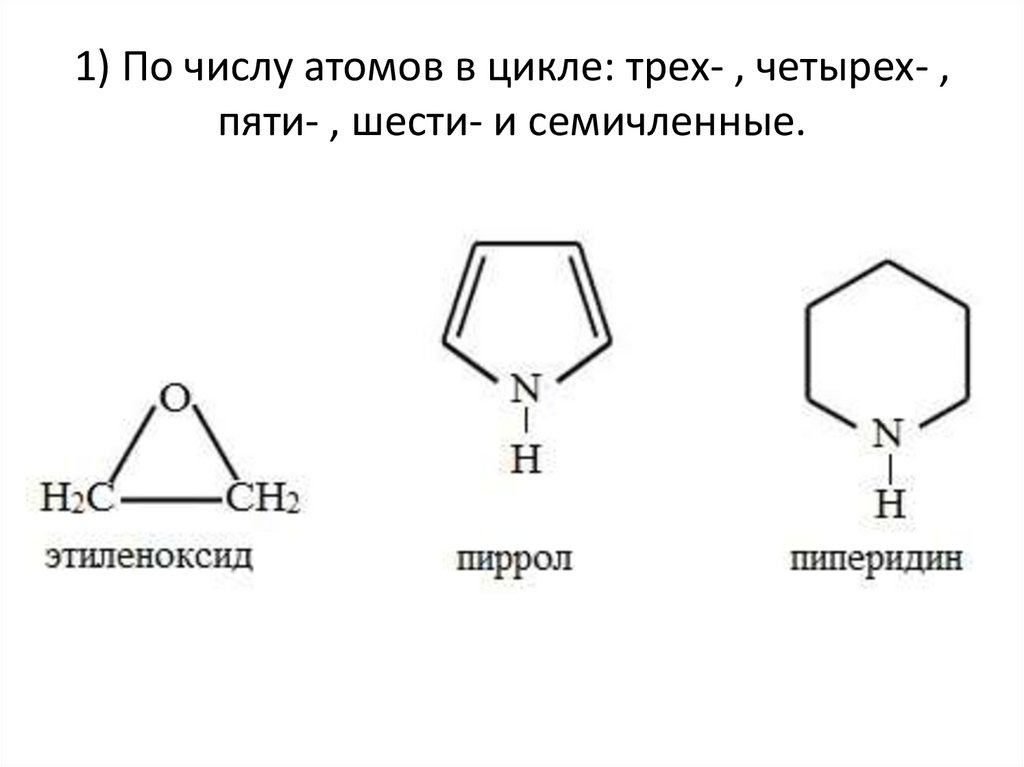
1) По числу атомов в цикле: трех- , четырех- ,пяти- , шести- и семичленные.
6.
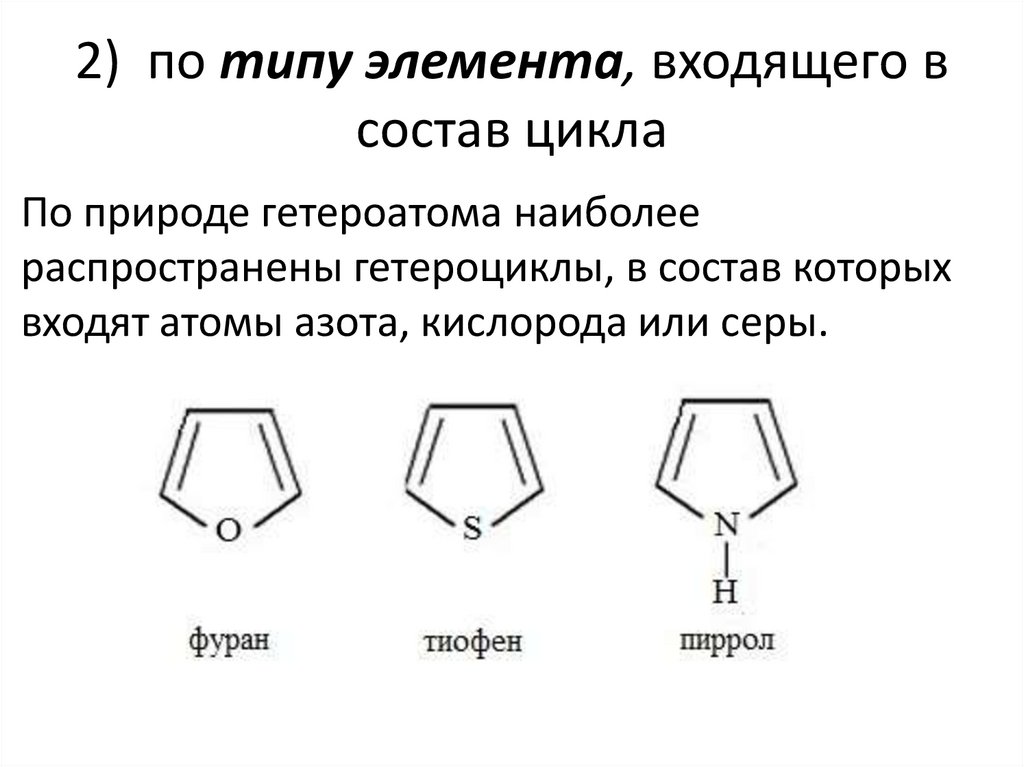
2) по типу элемента, входящего всостав цикла
По природе гетероатома наиболее
распространены гетероциклы, в состав которых
входят атомы азота, кислорода или серы.
7.
3. По числу гетероатомов, входящихв цикл
• С одним гетероатомом
• С двумя гетероатомами
8.
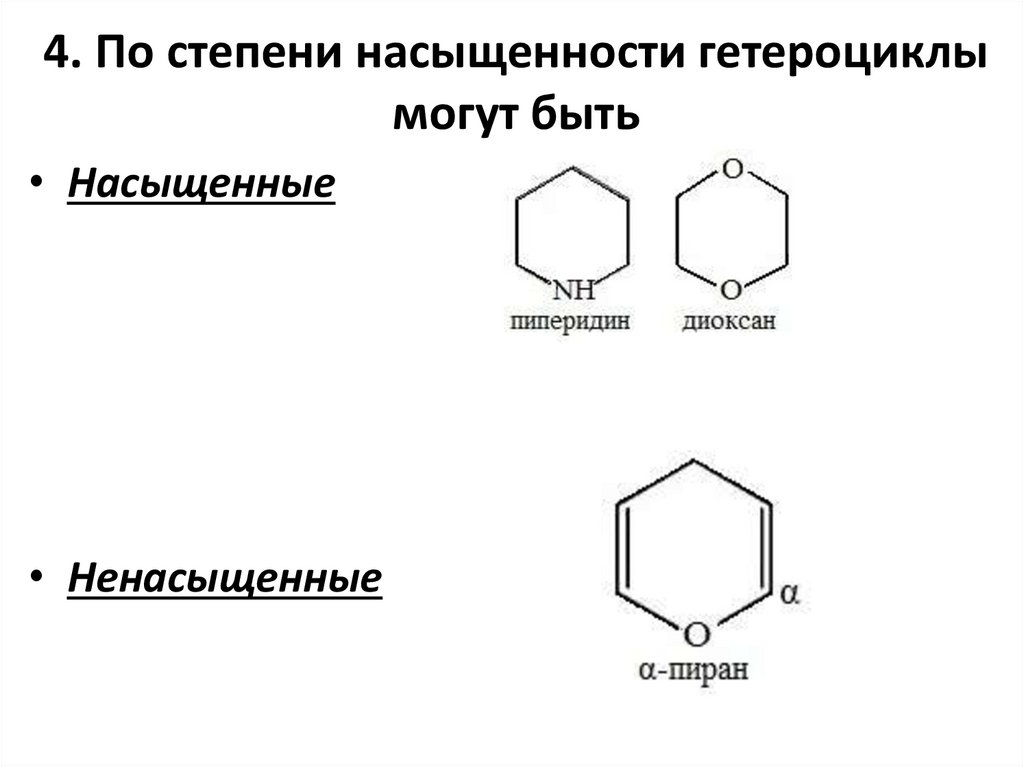
4. По степени насыщенности гетероциклымогут быть
• Насыщенные
• Ненасыщенные
9.
4. По степени насыщенности гетероциклымогут быть
• Ароматические
имеют плоское строение и замкнутую систему πэлектронов.
наиболее разнообразны и хорошо изучены
ароматические азотсодержащие гетероциклические соединения.
по некоторым свойствам гетероциклы сходны с
соответствующими алифатическими и
карбоциклическими соединениями.
аналогично карбоциклическим соединениям,
наиболее устойчивыми являются пяти- и
шестичленные гетероциклы.
10.
Пятичленные гетероциклыа) с одним атомом азота
б) с двумя атомами азота
11.
Эти гетероциклы имеют плоское строение иединую π-систему из шести электронов (по
одному от четырех атомов углерода и пара
электронов – от атома кислорода, серы или
азота).
В этом проявляется сходство данных
соединений с бензолом: пятичленные
гетероциклы обладают ароматическим
характером и склонны к реакциям
замещения.
12.
Шестичленные гетероциклыа) с одним атомом азота
(пиридин и его производные)
б) с двумя атомами азота (пиримидин
и его производные)
13.
Конденсированные(бициклические) гетероциклы
(пурин и его производные)
14.
Большое значениеимеют гетероциклы,
конденсированные с бензольным
кольцом или с другим
гетероциклом.
15.
При названии гетероцикловшироко используются
тривиальные названия:
16.
Гетероциклические соединения, как и бензол,более склонны к реакциям замещения, чем к
реакциям присоединения. Они вступают в
типичные для бензола реакции электрофильного
замещения, устойчивы по отношению к
восстановителям и окислителям.
₽Эти особенности в химическом поведении
определяются наличием в их кольцах электронного
секстета. Благодаря сопряжению, связи
выравниваются, и кольцо становится плоским.
Однако стабильность секстетов π-электронов в
молекуле бензола и в молекулах гетероциклов
различна.
17.
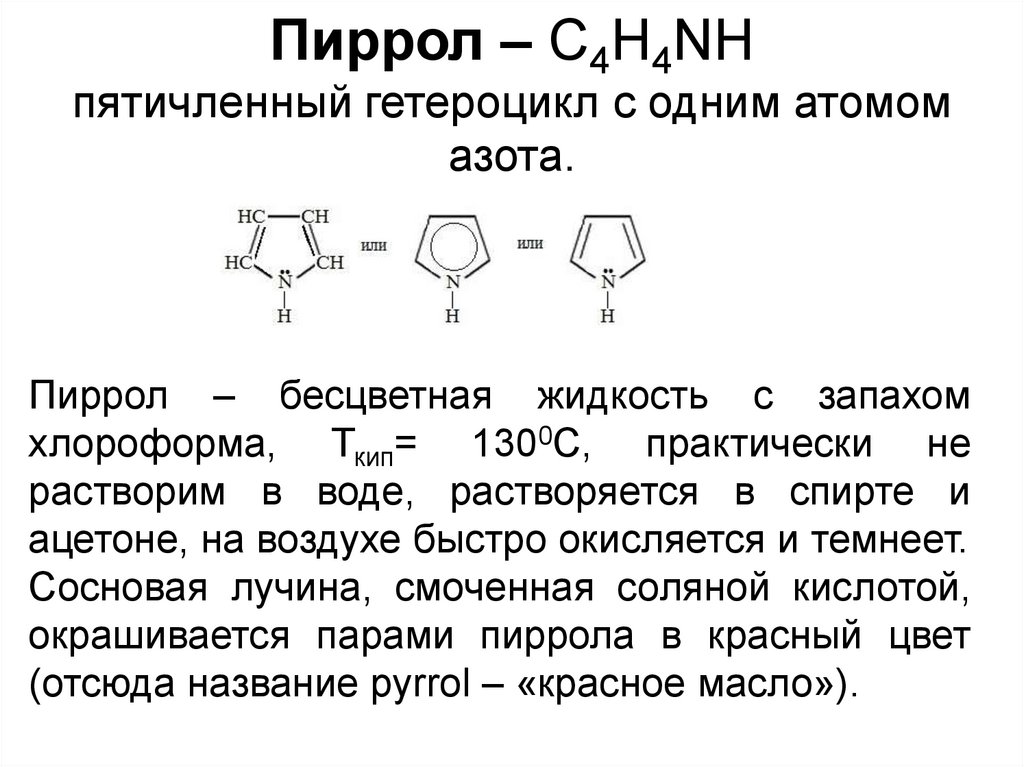
Пиррол – С4Н4NHпятичленный гетероцикл с одним атомом
азота.
Пиррол – бесцветная жидкость с запахом
хлороформа, Ткип= 1300С, практически не
растворим в воде, растворяется в спирте и
ацетоне, на воздухе быстро окисляется и темнеет.
Сосновая лучина, смоченная соляной кислотой,
окрашивается парами пиррола в красный цвет
(отсюда название pyrrol – «красное масло»).
18.
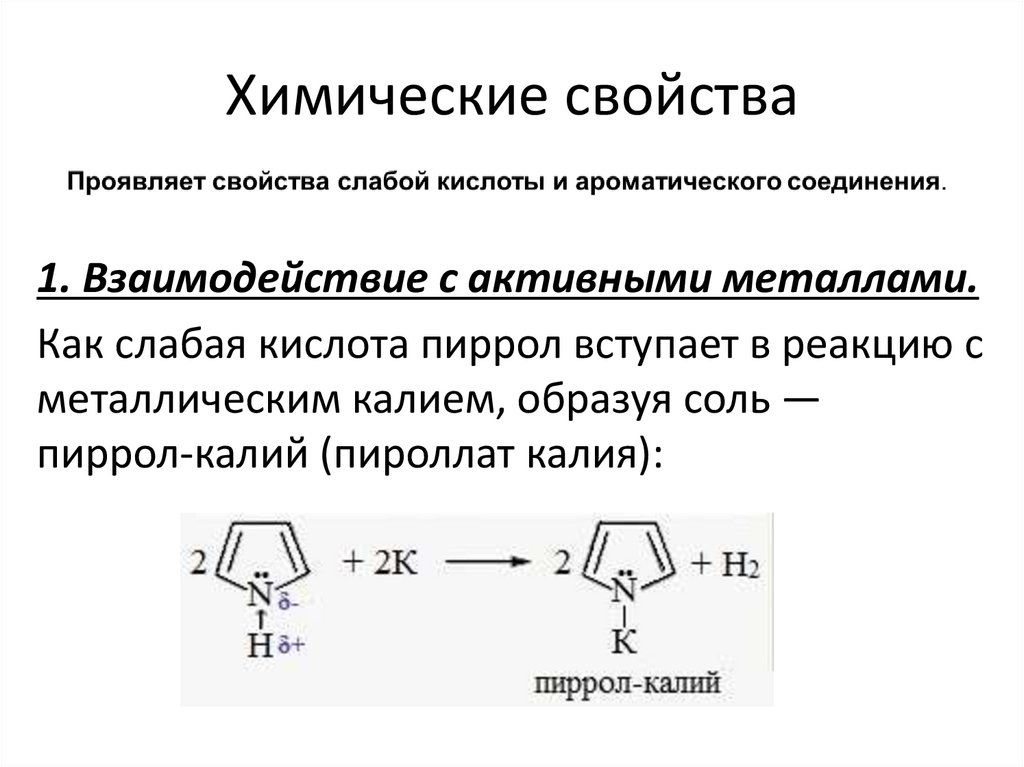
Химические свойства1. Взаимодействие с активными металлами.
Как слабая кислота пиррол вступает в реакцию с
металлическим калием, образуя соль —
пиррол-калий (пироллат калия):
19.
2.Реакции присоединения:Гидрирование.
Полимеризация.
Под действием сильных минеральных кислот пиррол
вступает в реакции полимеризации.
20.
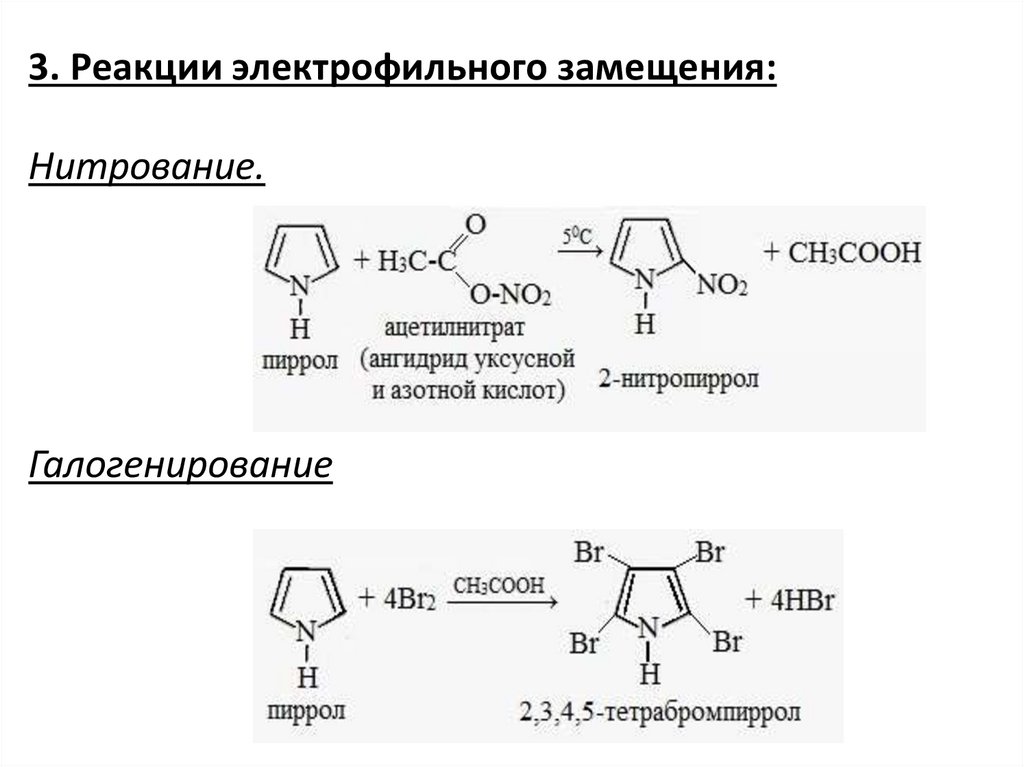
3. Реакции электрофильного замещения:Нитрование.
Галогенирование
21.
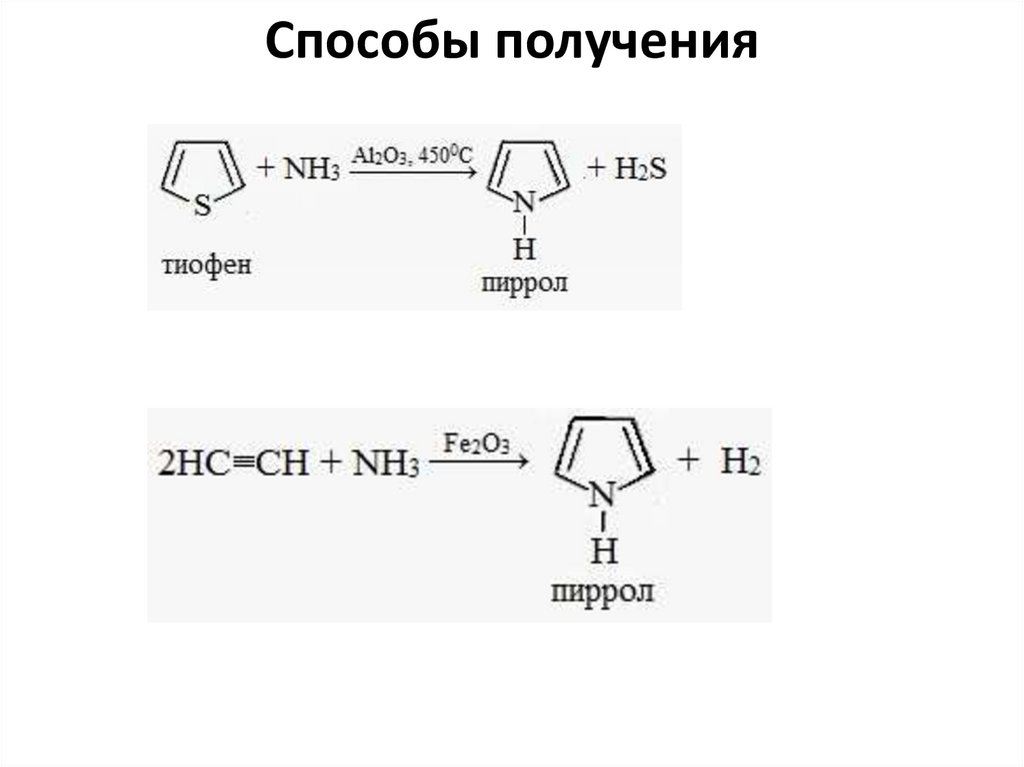
Способы получения22.
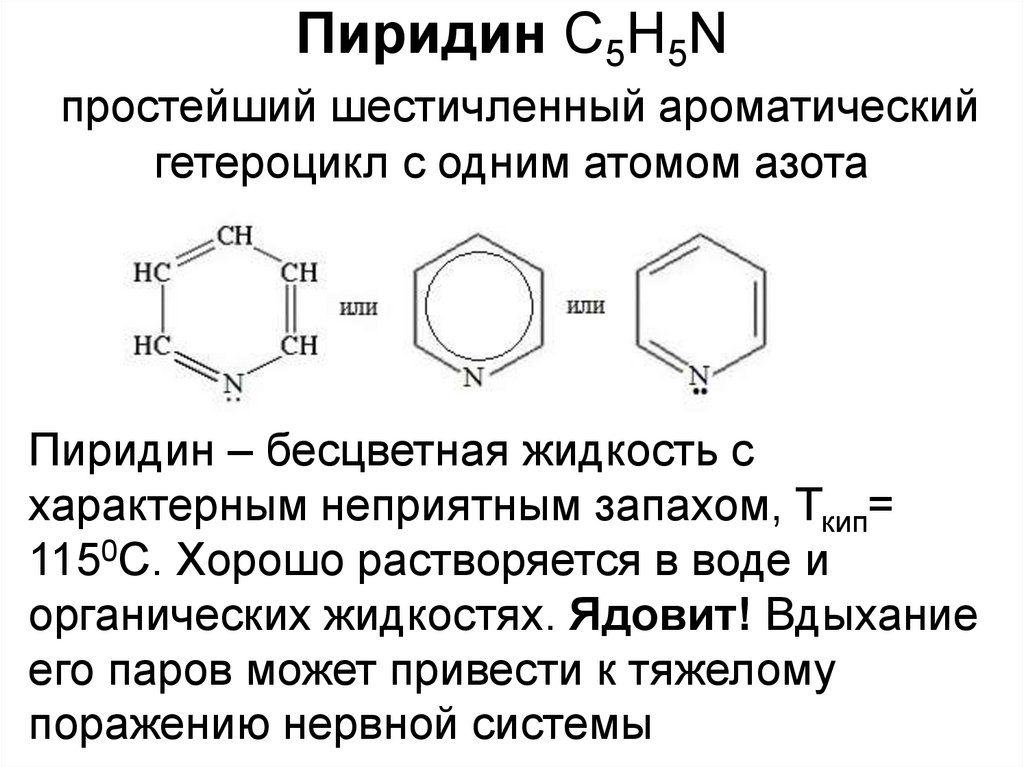
Пиридин С5Н5Nпростейший шестичленный ароматический
гетероцикл с одним атомом азота
Пиридин – бесцветная жидкость с
характерным неприятным запахом, Ткип=
1150С. Хорошо растворяется в воде и
органических жидкостях. Ядовит! Вдыхание
его паров может привести к тяжелому
поражению нервной системы
23.
Химические свойстваХимические свойства пиридина определяются
наличием ароматической системы и атома азота
с неподеленной электронной парой.
Основные свойства!
Неподеленная электронная пара атома азота в
молекуле не участвует в образовании единой πэлектронной системы, поэтому пиридин
подобно аминам, проявляет свойства
основания. Пиридин – более слабое основание,
чем алифатические амины.
24.
1) Взаимодействие с водой:2) Взаимодействие с кислотами:
25.
3) Реакции электрофильного замещения.Наряду с основными свойствами пиридин
проявляет свойства ароматического соединения.
Нитрование:
26.
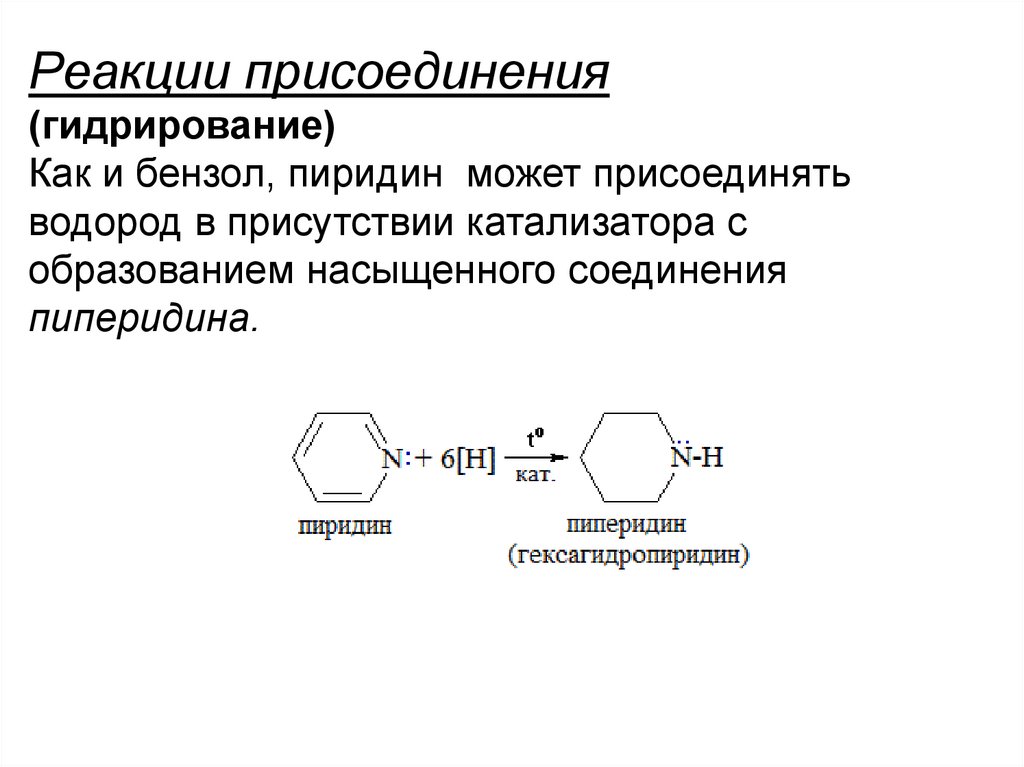
Реакции присоединения(гидрирование)
Как и бензол, пиридин может присоединять
водород в присутствии катализатора с
образованием насыщенного соединения
пиперидина.
27.
4) Реакции нуклеофильного замещения.Аминирование.
28.
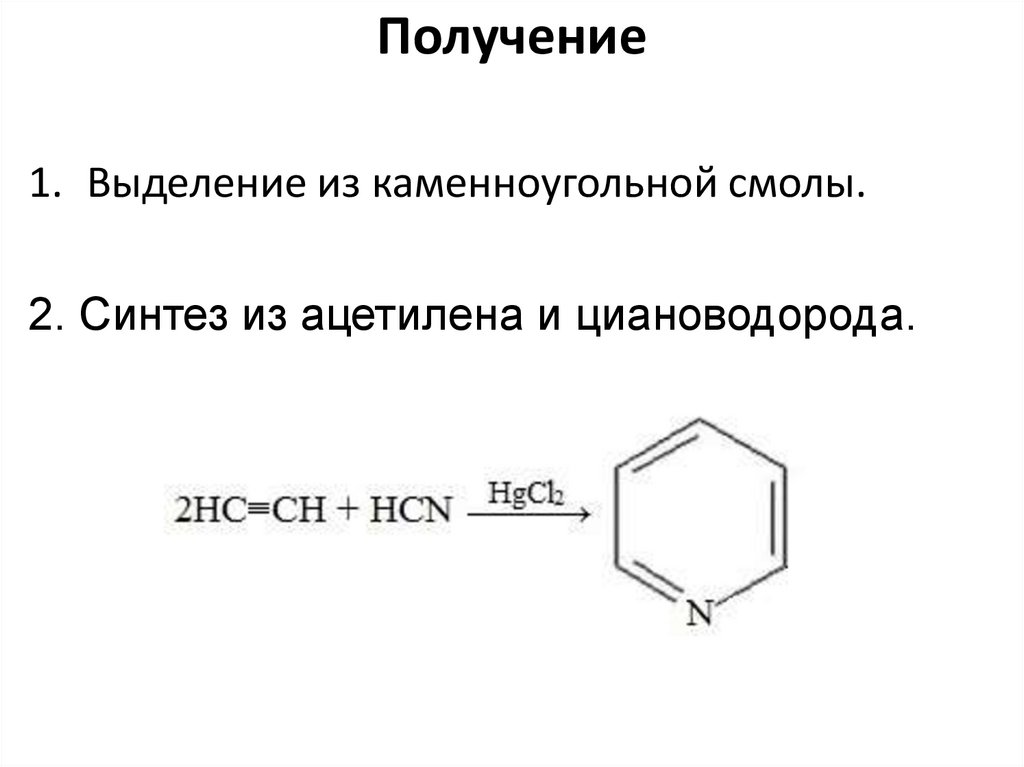
Получение1. Выделение из каменноугольной смолы.
2. Синтез из ацетилена и циановодорода.
29.
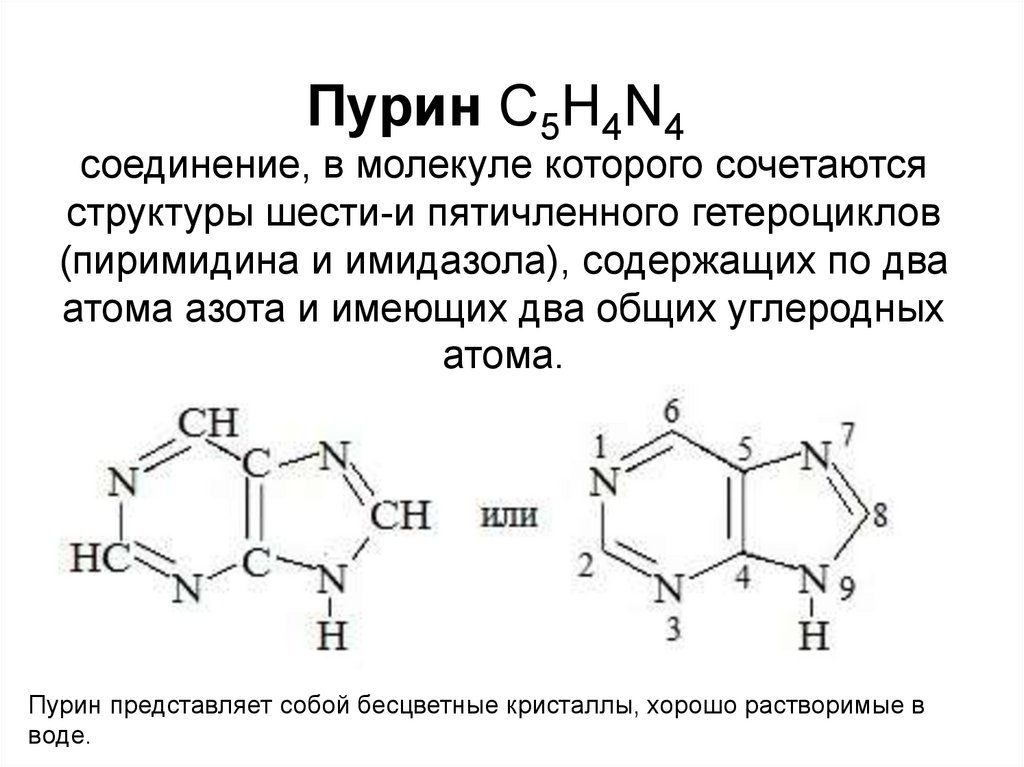
Пурин С5H4N4соединение, в молекуле которого сочетаются
структуры шести-и пятичленного гетероциклов
(пиримидина и имидазола), содержащих по два
атома азота и имеющих два общих углеродных
атома.
Пурин представляет собой бесцветные кристаллы, хорошо растворимые в
воде.
30.
Пурин проявляет амфотерныесвойства.
Слабые основные свойства связаны с
атомами азота шестичленного
(пиримидинового) цикла.
Слабые кислотные свойства
обусловлены группой N-H
пятичленного цикла имидазола (по
аналогии с пирролом).
31.
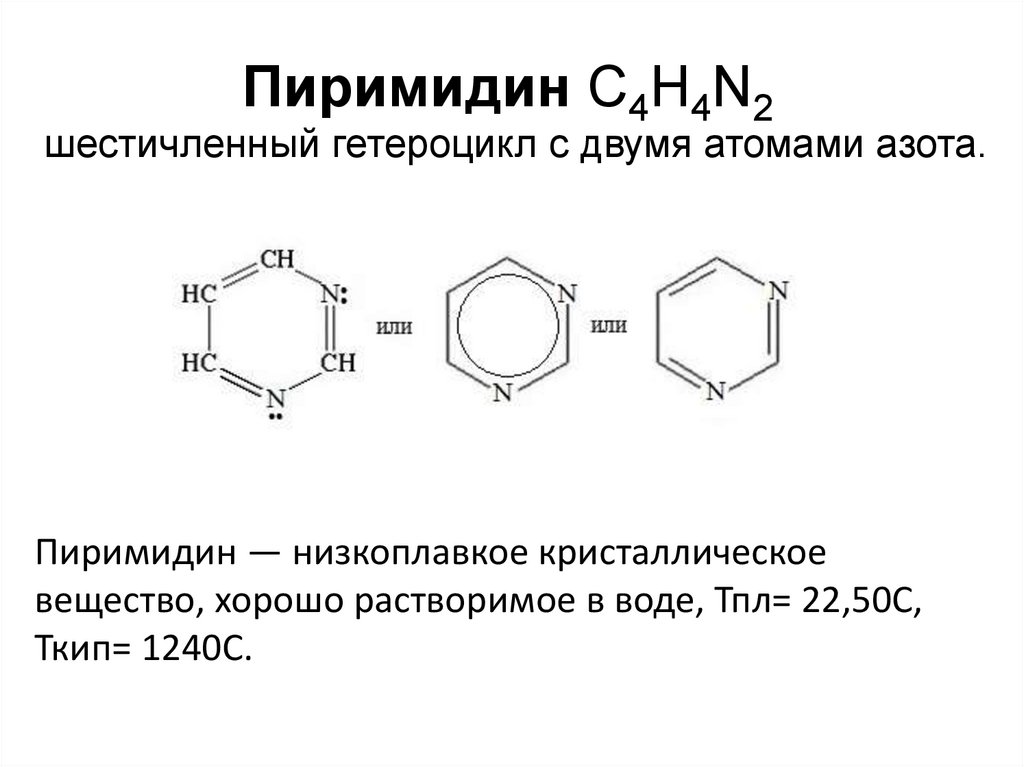
Пиримидин С4Н4N2шестичленный гетероцикл с двумя атомами азота.
Пиримидин — низкоплавкое кристаллическое
вещество, хорошо растворимое в воде, Тпл= 22,50C,
Ткип= 1240C.
32.
Пиримидин проявляет свойства очень слабогооснования, т.к. атомы азота в sp2-гибридизованном
состоянии довольно прочно удерживают
неподеленную электронную пару.
Для пиримидина, подобно пиридину, характерна
6p-электронная ароматическая система. Поэтому
его цикл обладает повышенной устойчивостью.
Благодаря наличию в кольце двух
электроотрицательных атомов азота, пиримидин
еще менее активен в реакциях электрофильного
замещения, чем пиридин. Его основные свойства
также выражены слабее, чем у пиридина.




















 chemistry
chemistry








