Similar presentations:
Гетероциклы. Гетероциклические соединения
1.
2.
3.
Гетероциклические соединения – этоорганические соединения, в циклах
которых содержатся не только
атомы углерода, но и атомы других
элементов, называемые
гетероатомами (атомы азота, серы,
кислорода и некоторых других
элементов).
4.
1. ПО РАЗМЕРУ ЦИКЛА (ПЯТИ-, ШЕСТИЧЛЕННЫЕ ИТ.Д.)
2. ПО ЧИСЛУ ГЕТЕРОАТОМОВ В ЦИКЛЕ (С ОДНИМ,
ДВУМЯ И Т.Д.)
3. ПО ПРИРОДЕ ГЕТЕРОАТОМА (КИСЛОРОД-, АЗОТ-,
СЕРОСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ)
4. ПО СТРОЕНИЮ ГЕТЕРОЦИКЛА (ПРЕДЕЛЬНЫЙ,
НЕПРЕДЕЛЬНЫЙ, АРОМАТИЧЕСКИЙ)
5. ПО ЧИСЛУ ЦИКЛОВ (МОНОЦИКЛИЧЕСКИЕ,
БИЦИКЛИЧЕСКИЕ)
5.
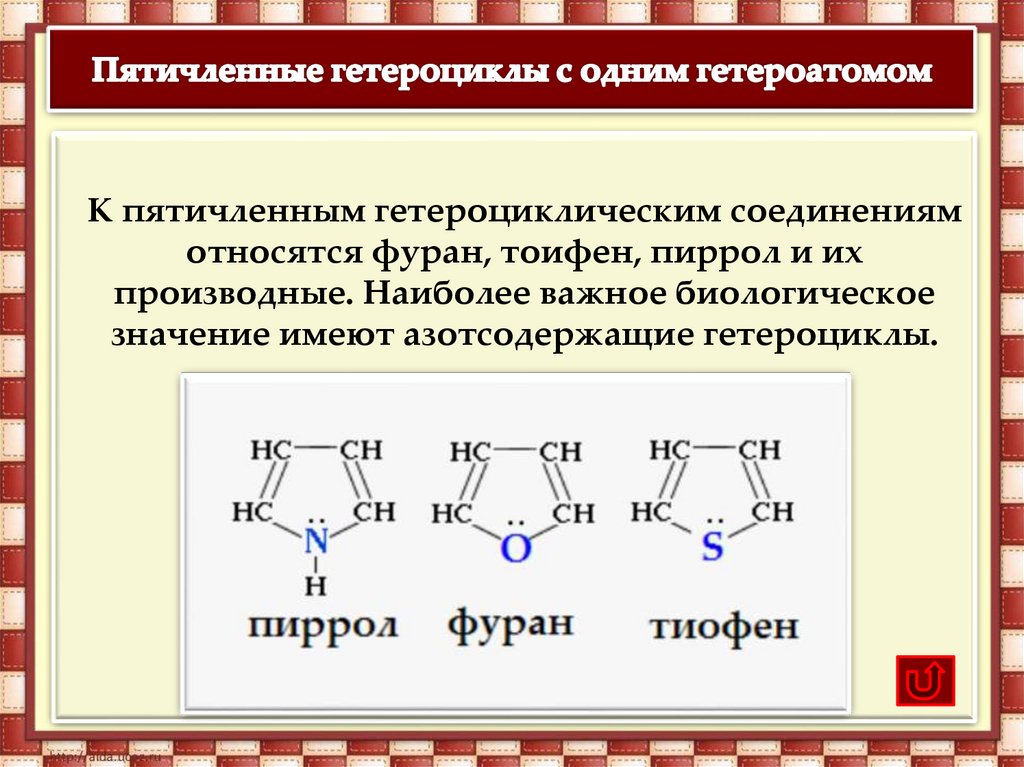
К пятичленным гетероциклическим соединениямотносятся фуран, тоифен, пиррол и их
производные. Наиболее важное биологическое
значение имеют азотсодержащие гетероциклы.
6.
7.
8.
9.
Бесцветная жидкость с температуройкипения 131 С, с запахом хлороформа,
плохо растворимая в воде, на воздухе
быстро окисляется и темнеет.
10.
РЕАКЦИИ С УЧАСТИЕМ КОЛЬЦА(АРОМАТИЧЕСКОГО ХАРАКТЕРА)
РЕАКЦИИ С УЧАСТИЕМ
АМИНОГРУППЫ
11.
1. Реакции замещения. Подобно бензолу, пирролвступает в реакции замещения (пиррол более
реакционноспособен, чем бензол). При этом:
• преимущественно замещается водород,
находящийся в соседнем положении с
гетероатомом (2-е положение);
• необходимы мягкие специфические реагенты, не
содержащие протонов (Н+), так как в
сильнокислых средах происходит
полимеризация пиррола.
12.
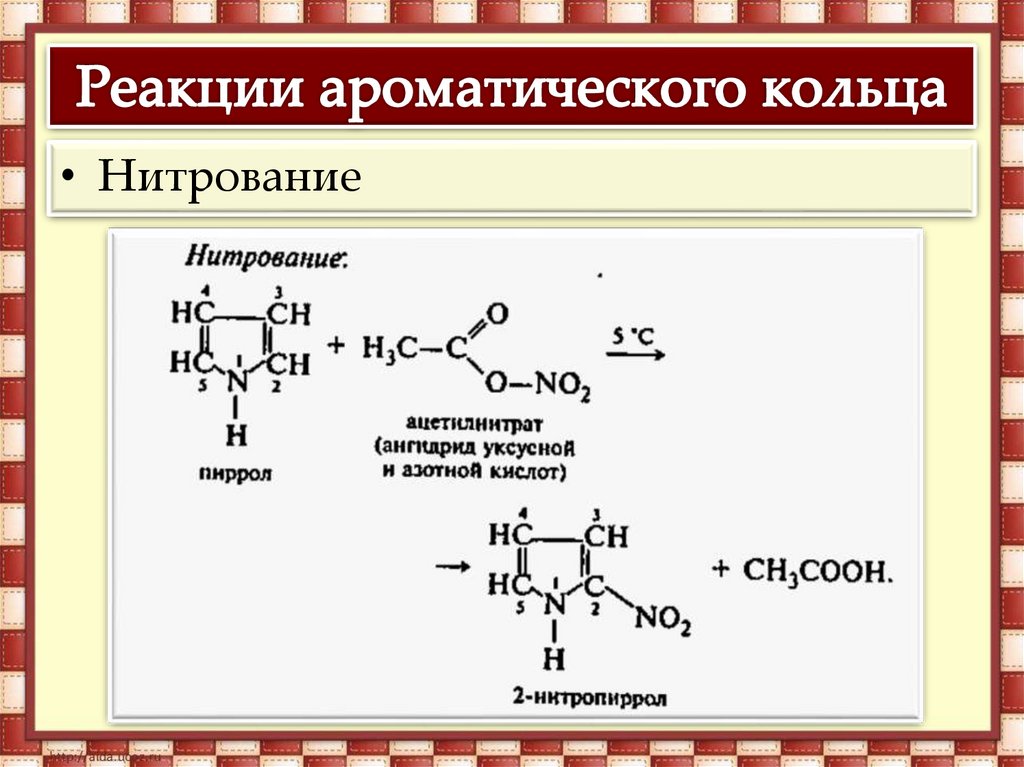
• Нитрование13.
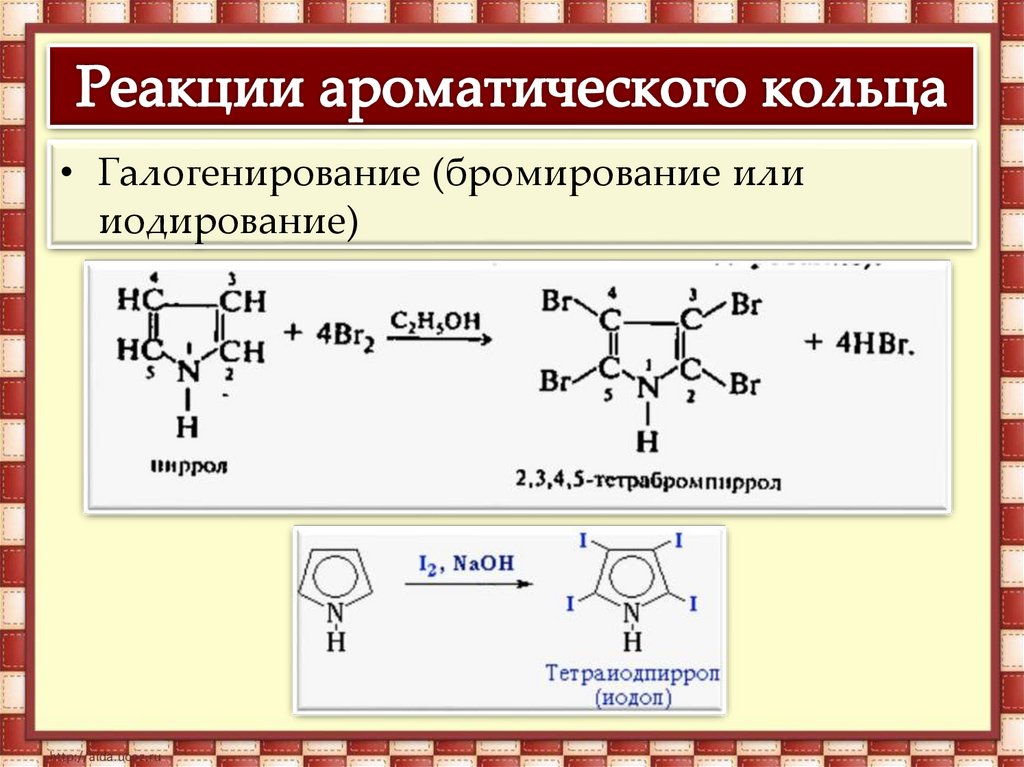
• Галогенирование (бромирование илииодирование)
14.
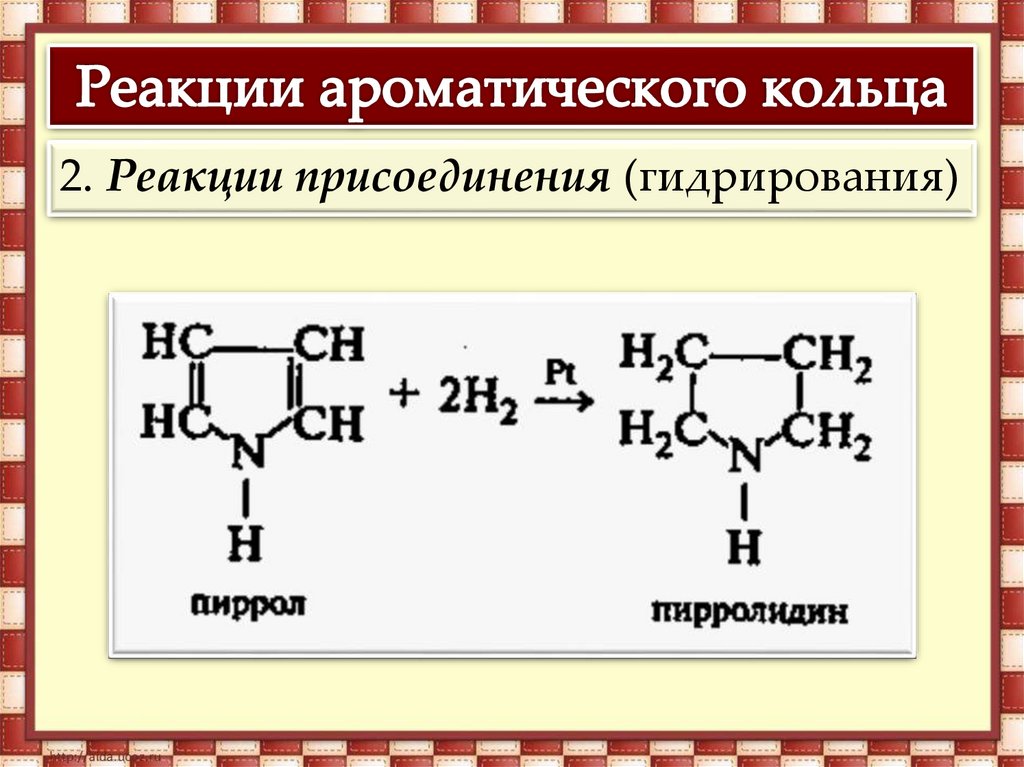
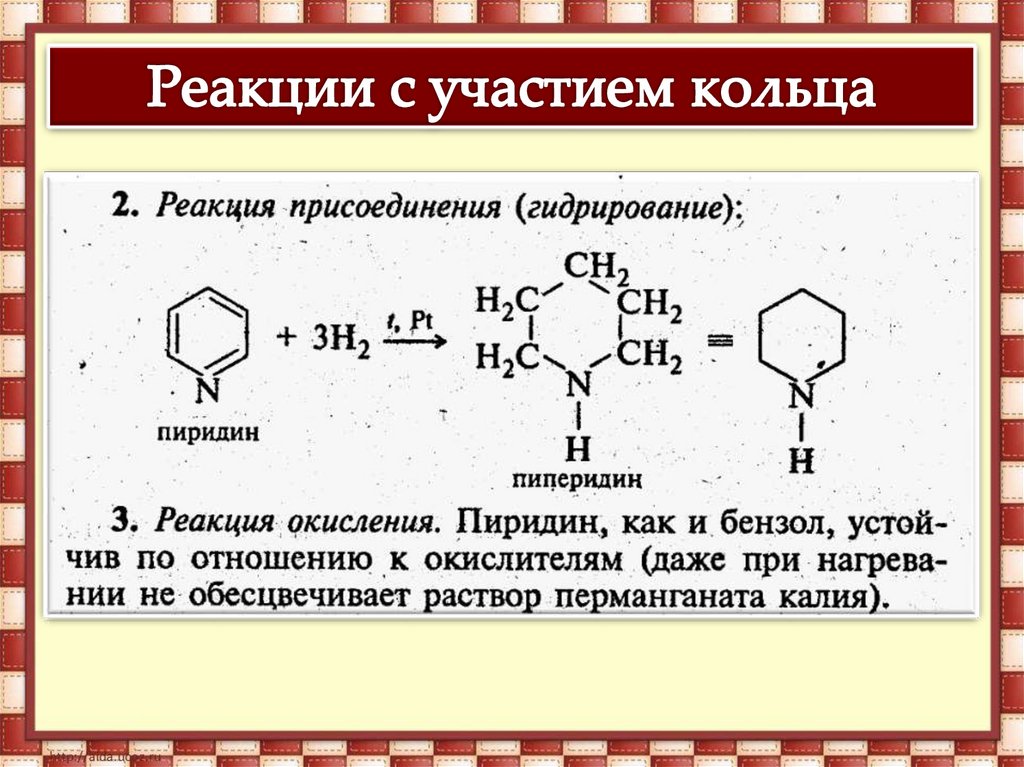
2. Реакции присоединения (гидрирования)15.
3. Окисление.Пиррол в отличие от бензола легко
окисляется азотной кислотой,
перманганатом калия и другими
окислителями
16.
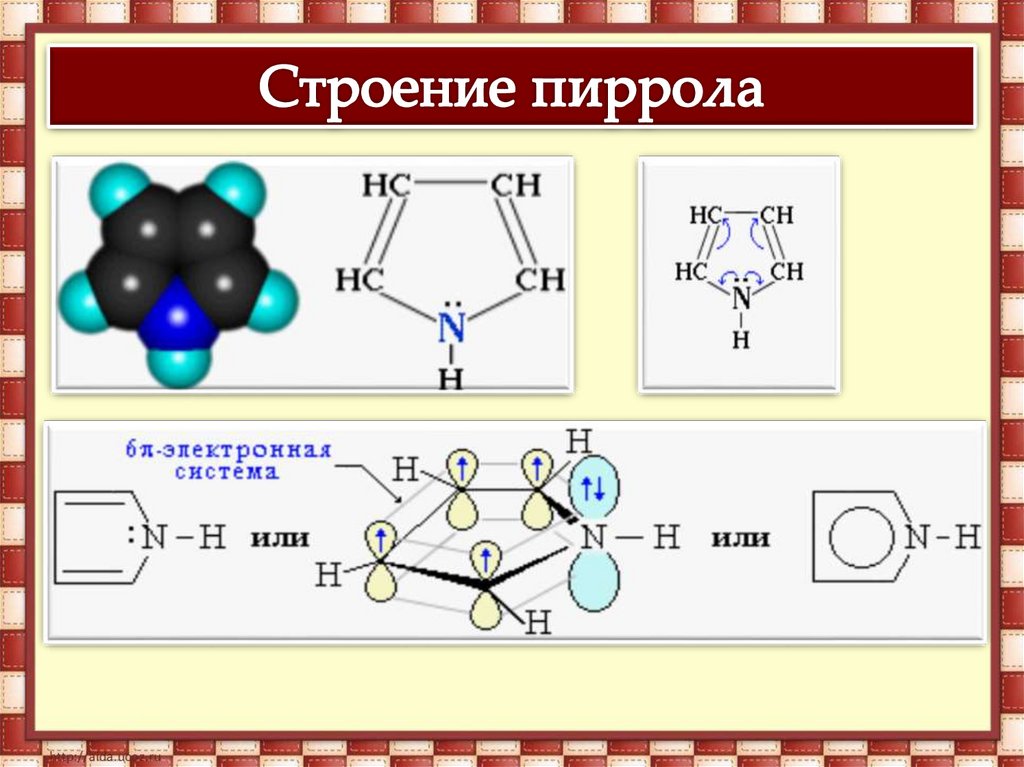
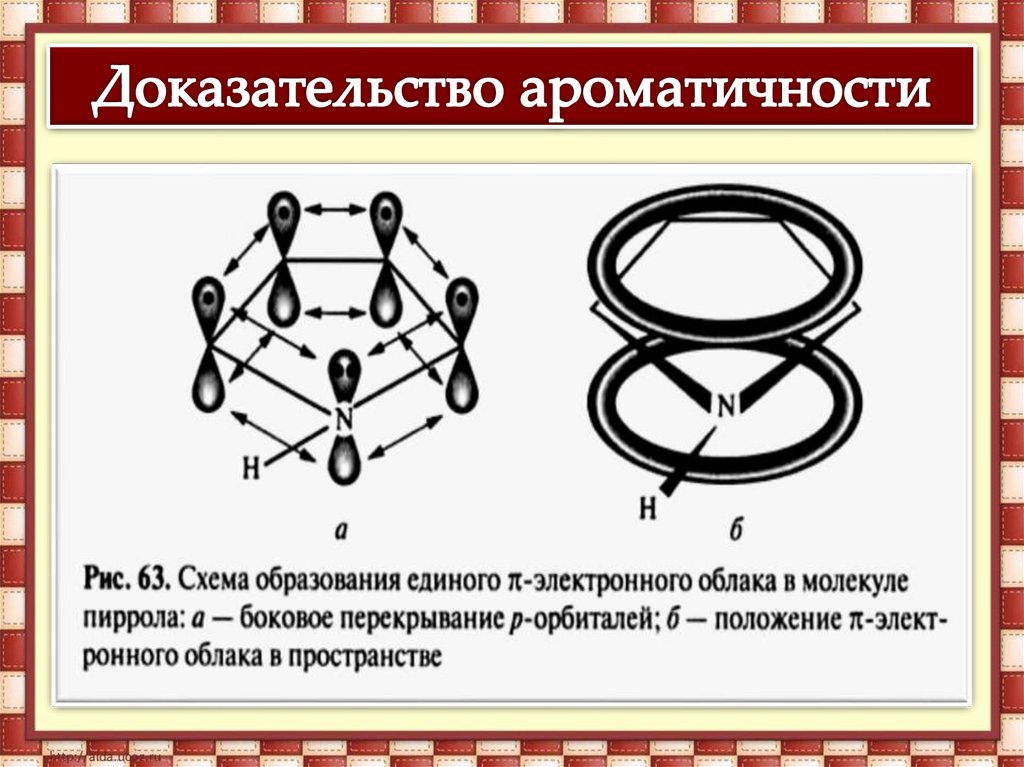
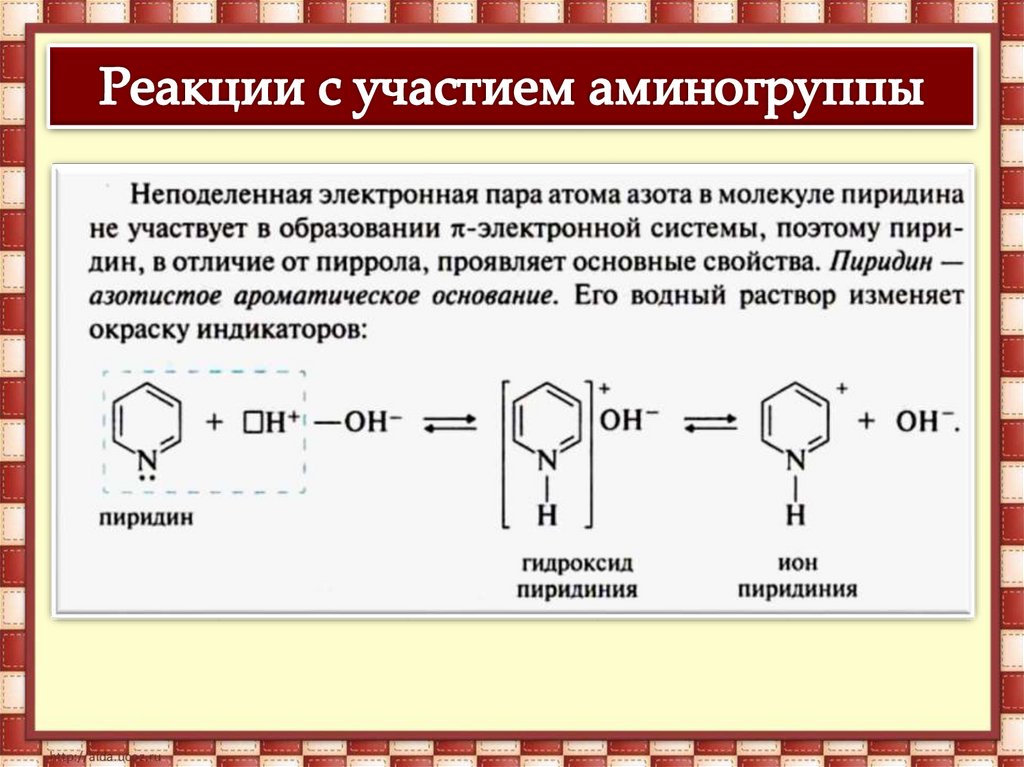
Связывание неподеленной электроннойпары атома азота системой
сопряжения приводит к резкому
ослаблению основных и проявлению
кислотных свойств.
17.
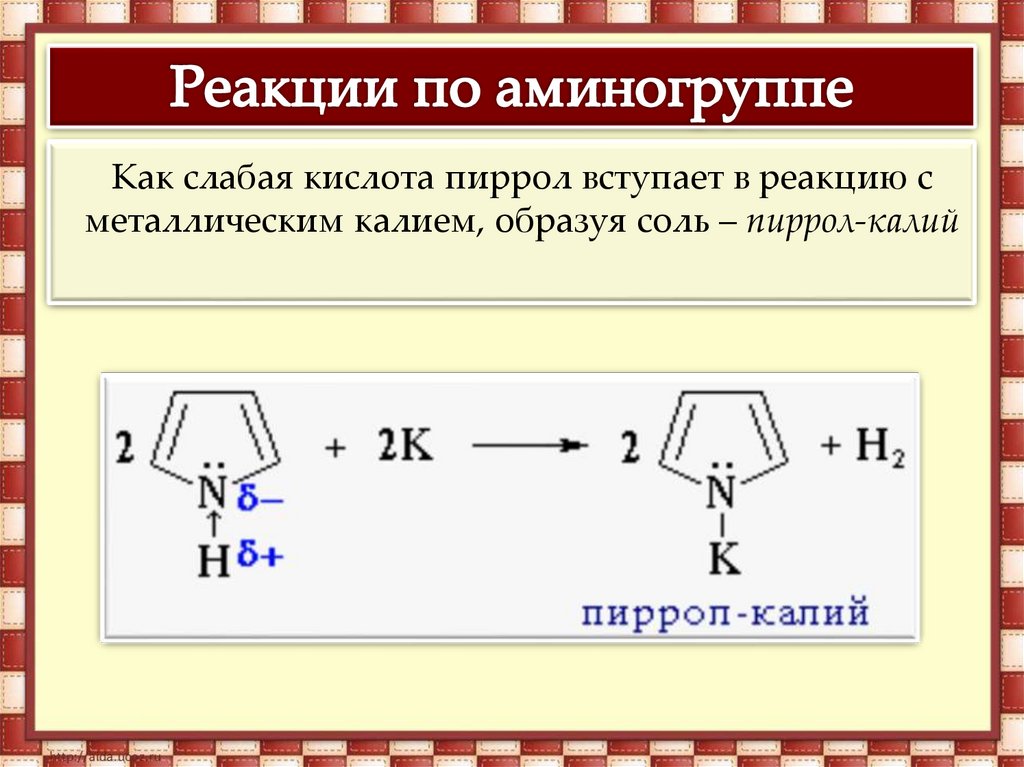
Как слабая кислота пиррол вступает в реакцию сметаллическим калием, образуя соль – пиррол-калий
18.
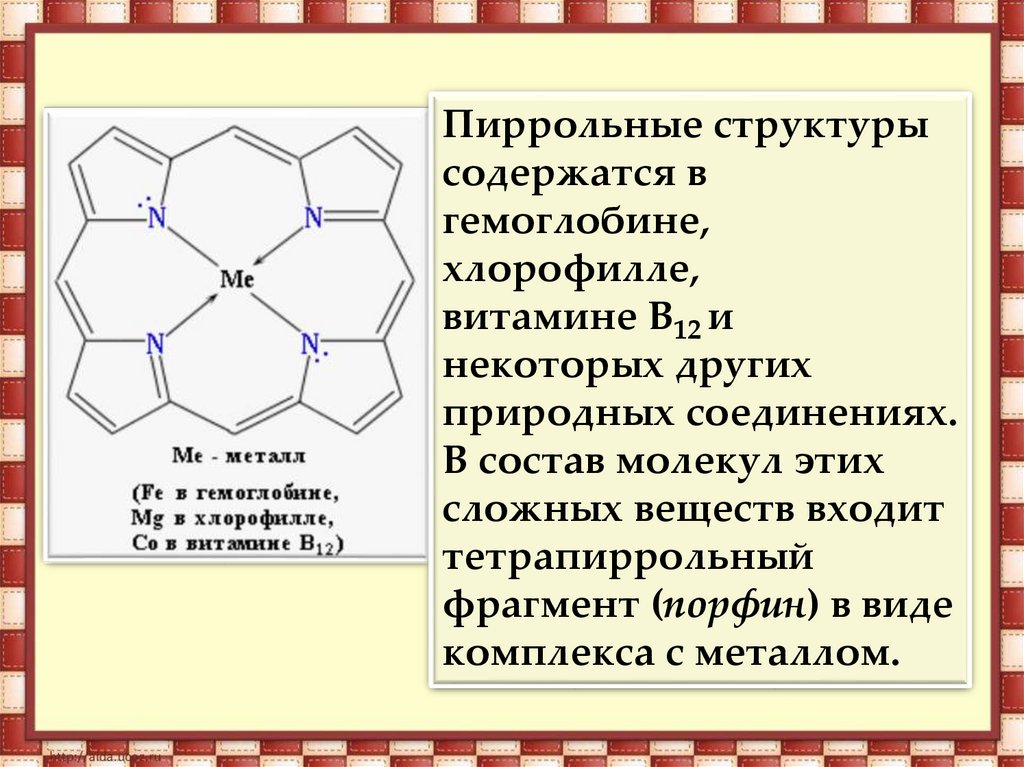
Пиррольные структурысодержатся в
гемоглобине,
хлорофилле,
витамине В12 и
некоторых других
природных соединениях.
В состав молекул этих
сложных веществ входит
тетрапиррольный
фрагмент (порфин) в виде
комплекса с металлом.
19.
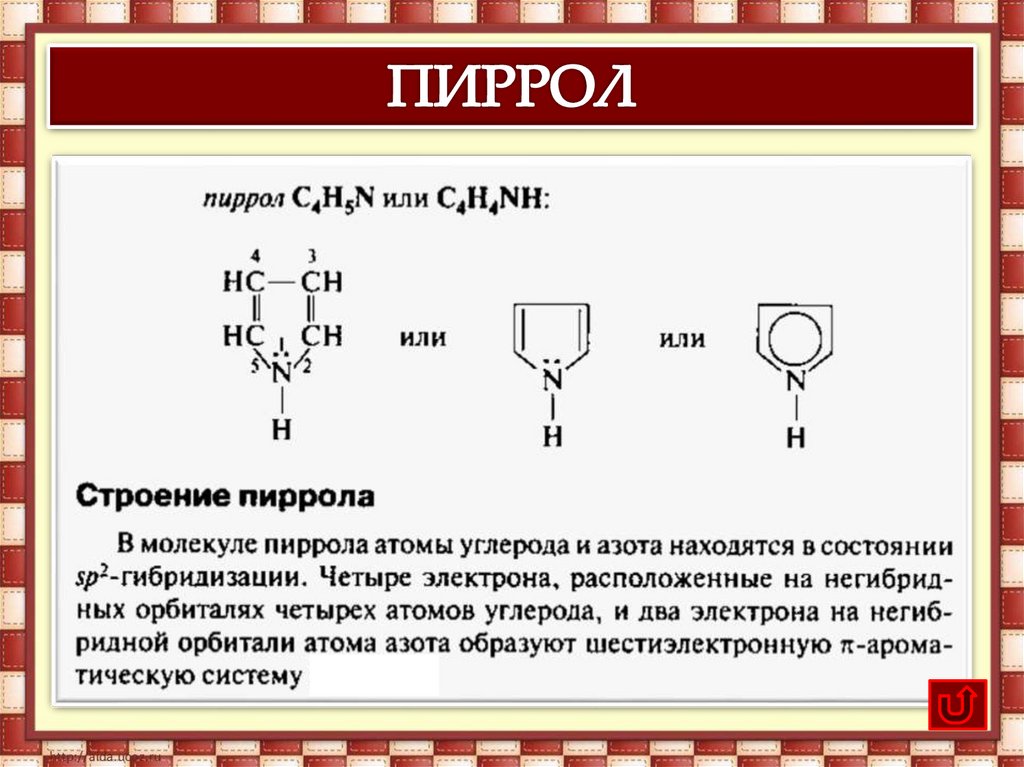
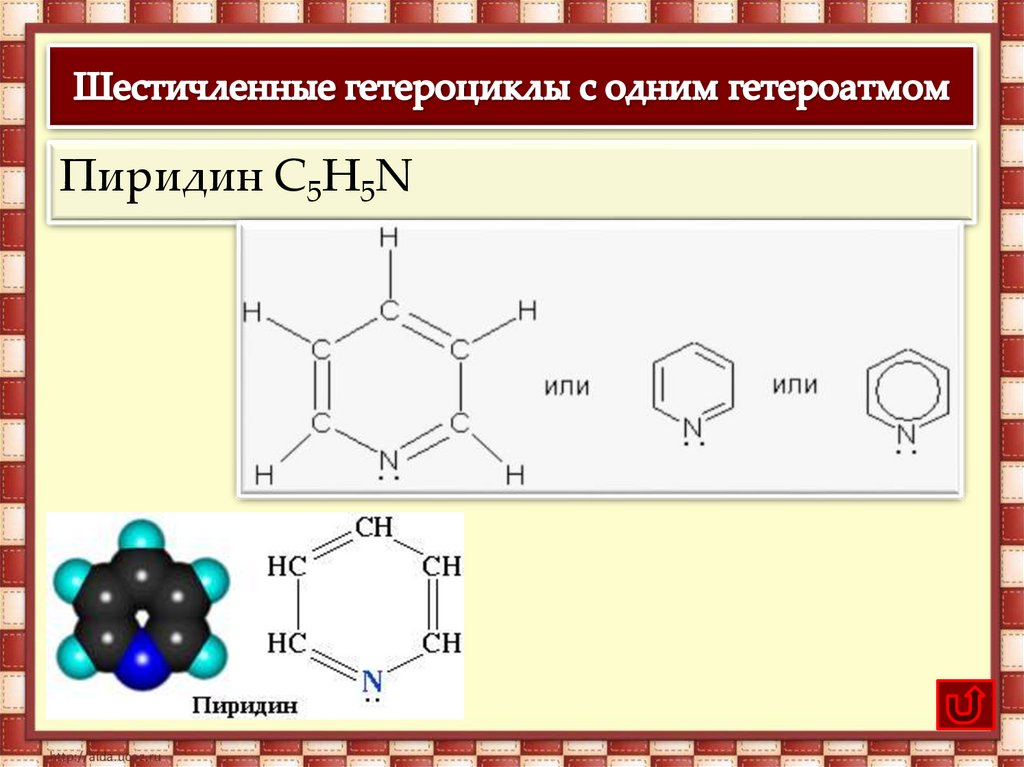
Пиридин C5H5N20.
21.
1. Пиридин выделяют изкаменноугольной смолы
2. Из костного масла, полученного при
пиролизе костей
3. В лабораторных условиях пиридин
можно синтезировать из синильной
кислоты и ацетилена: 2CH≡CH +HCN
→ C5H5N (катализатор HgCl2)
22.
Пиридин представляет собойбесцветную жидкость с характерным
очень неприятным запахом температура
кипения 115°С. Его добавляют к
этиловому спирту при приготовлении
денатурата. С водой смешивается в
любых соотношениях, отличаясь этим от
бензола. Пиридин ядовит, вызывает
резкие головные боли и общие
отравления
23.
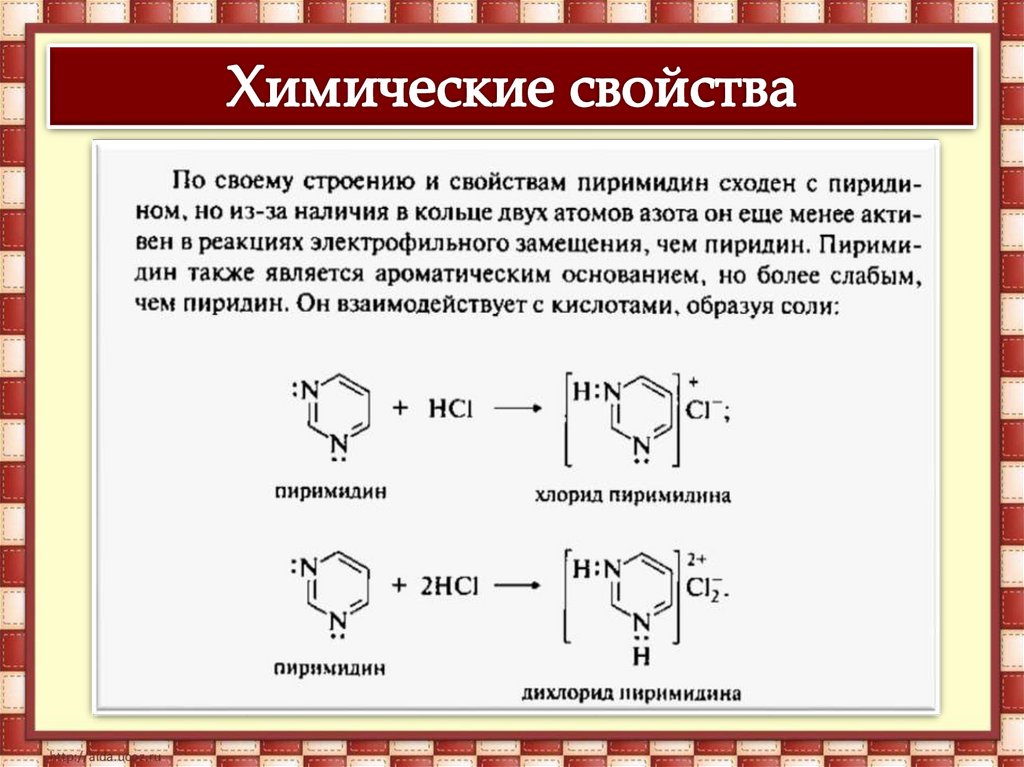
определяются наличиемароматической системы и атома
азота с неподеленной электронной
парой
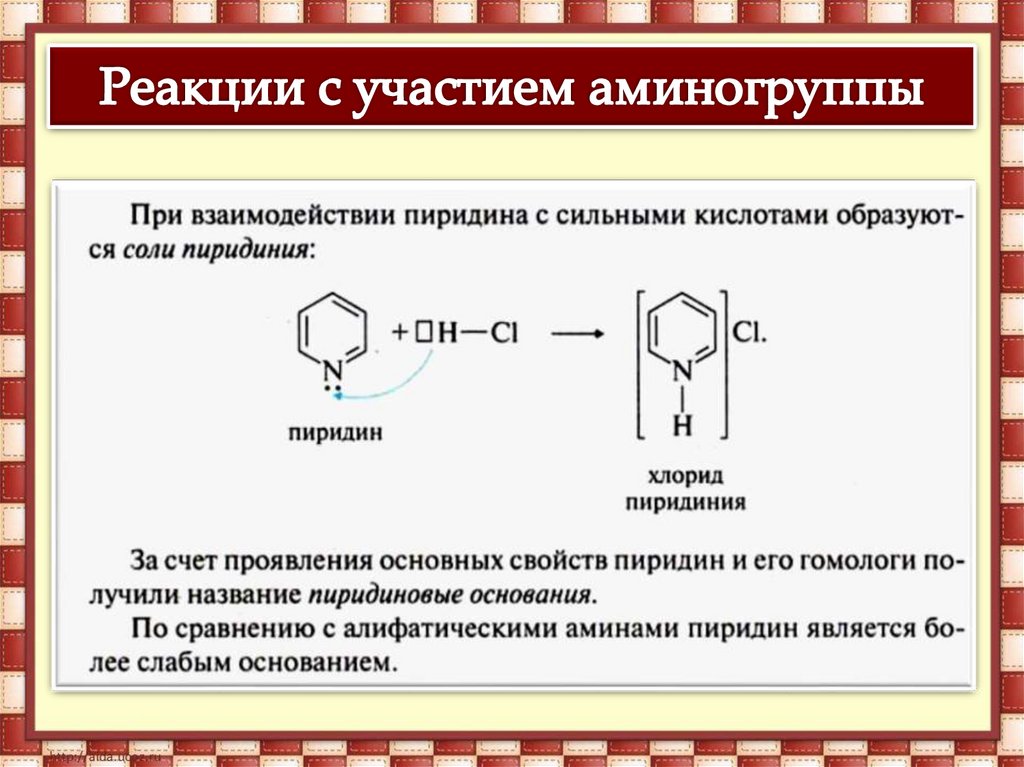
1. Основные свойства
2. Реакции с участием бензольного
кольца
24.
25.
26.
Реакции замещения. Пиридин какароматическое соединение вступает в реакции
электрофильного замещения, но его активность в
этих реакциях ниже, чем бензола, что связано с
влиянием более электроотрицательного атома
азота. Азот оттягивает электронную плотность и
уменьшает ее в положениях 2,4,6 (орто- и пара-),
поэтому электрофилъное замещение
происходит в положении 3 (мета-) и реакция
протекает в жестких условиях
27.
28.
29.
30.
31.
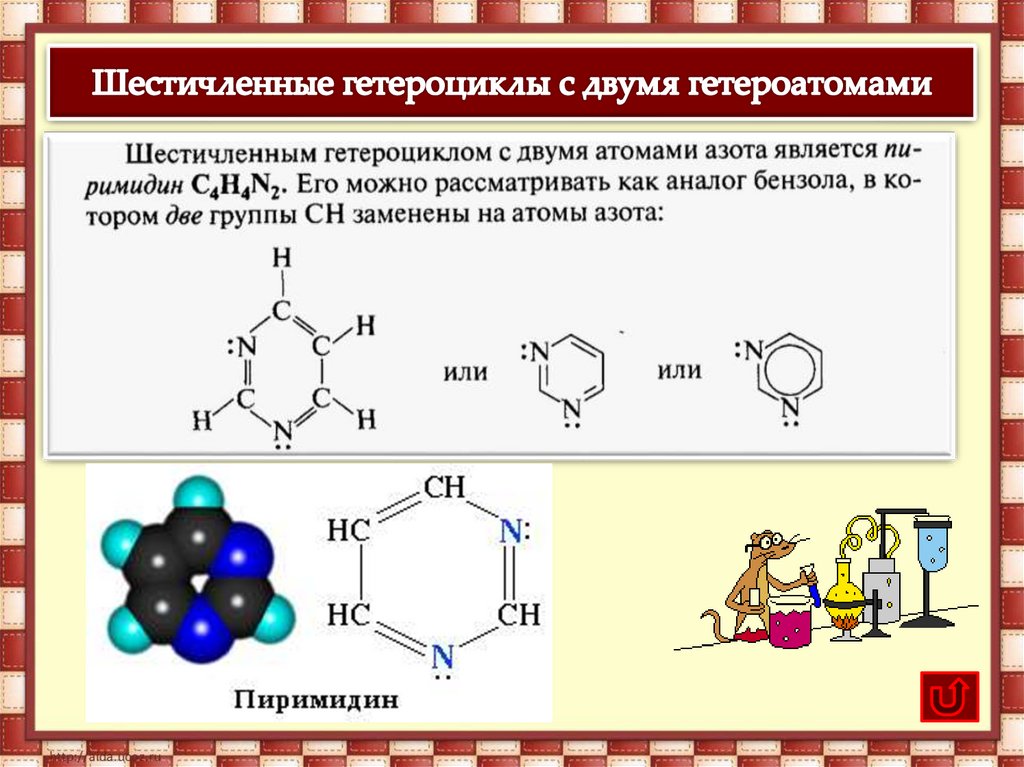
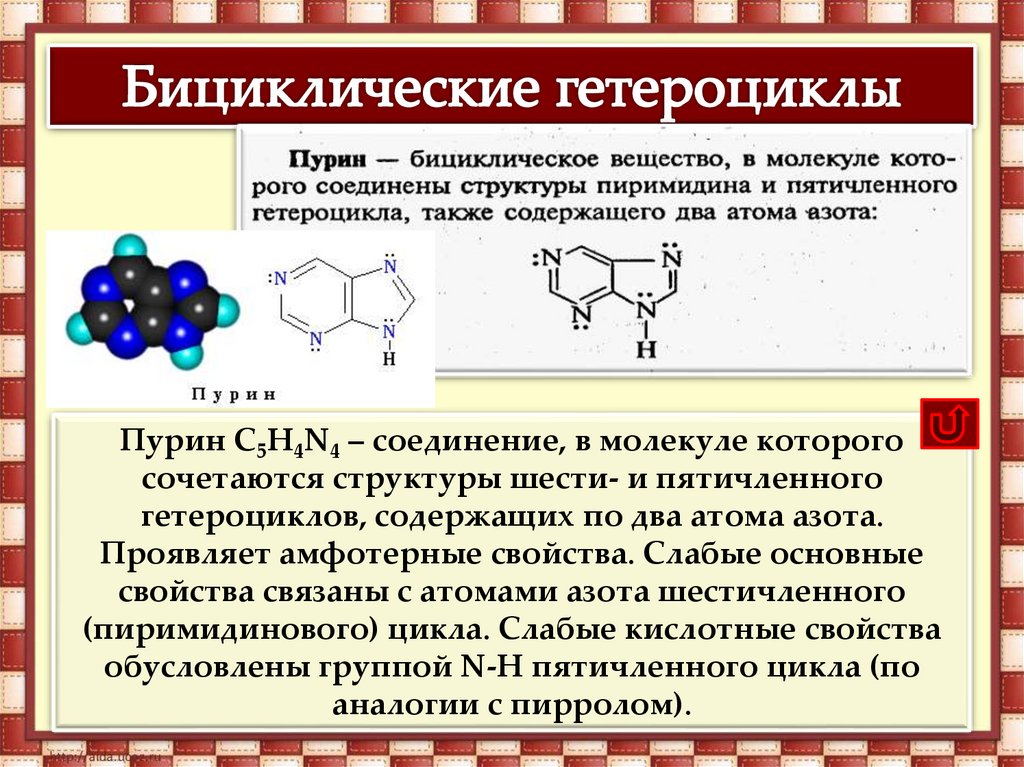
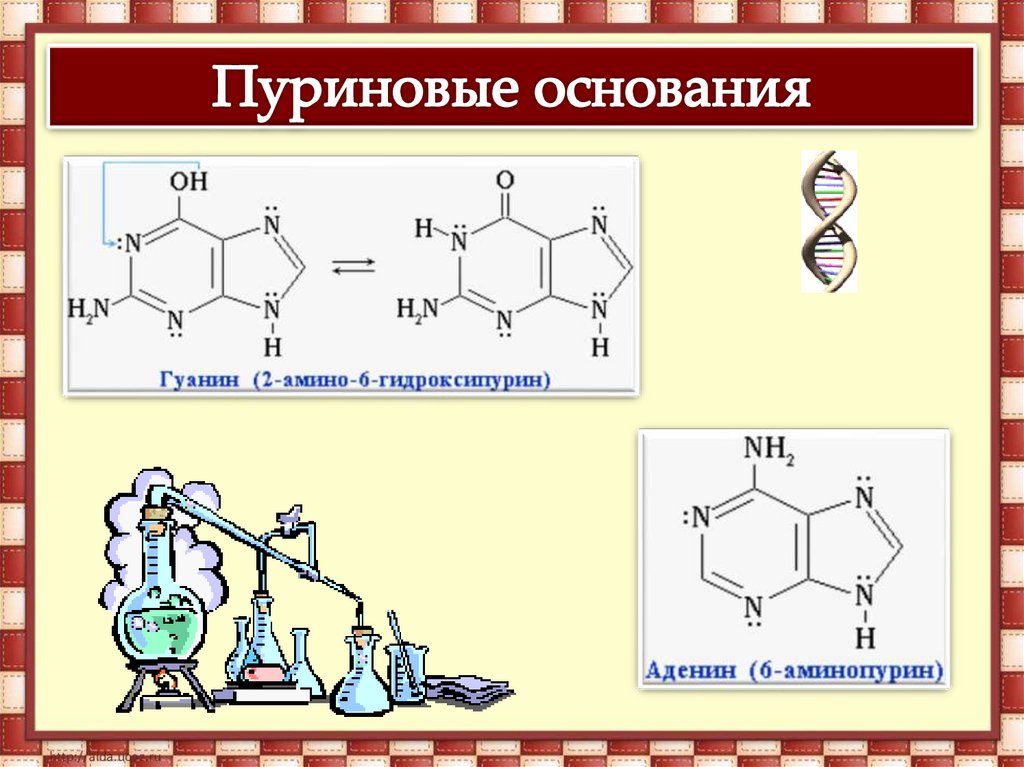
Пурин С5H4N4 – соединение, в молекуле которогосочетаются структуры шести- и пятичленного
гетероциклов, содержащих по два атома азота.
Проявляет амфотерные свойства. Слабые основные
свойства связаны с атомами азота шестичленного
(пиримидинового) цикла. Слабые кислотные свойства
обусловлены группой N-H пятичленного цикла (по
аналогии с пирролом).
32.
33.
34.
35.
36.
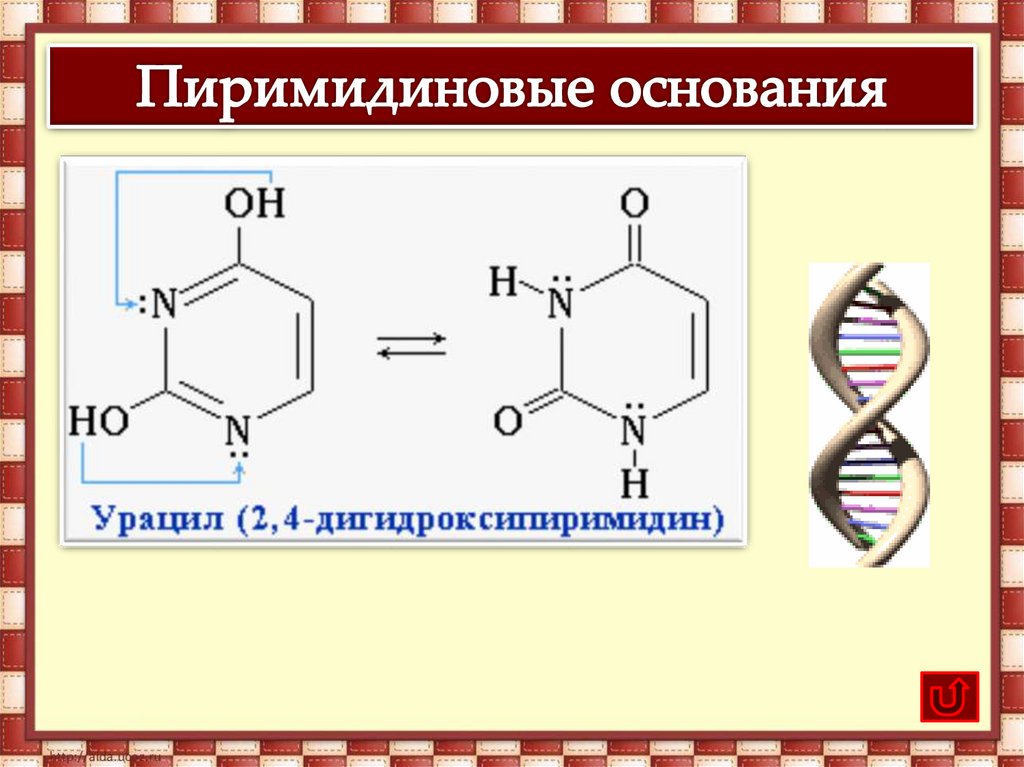
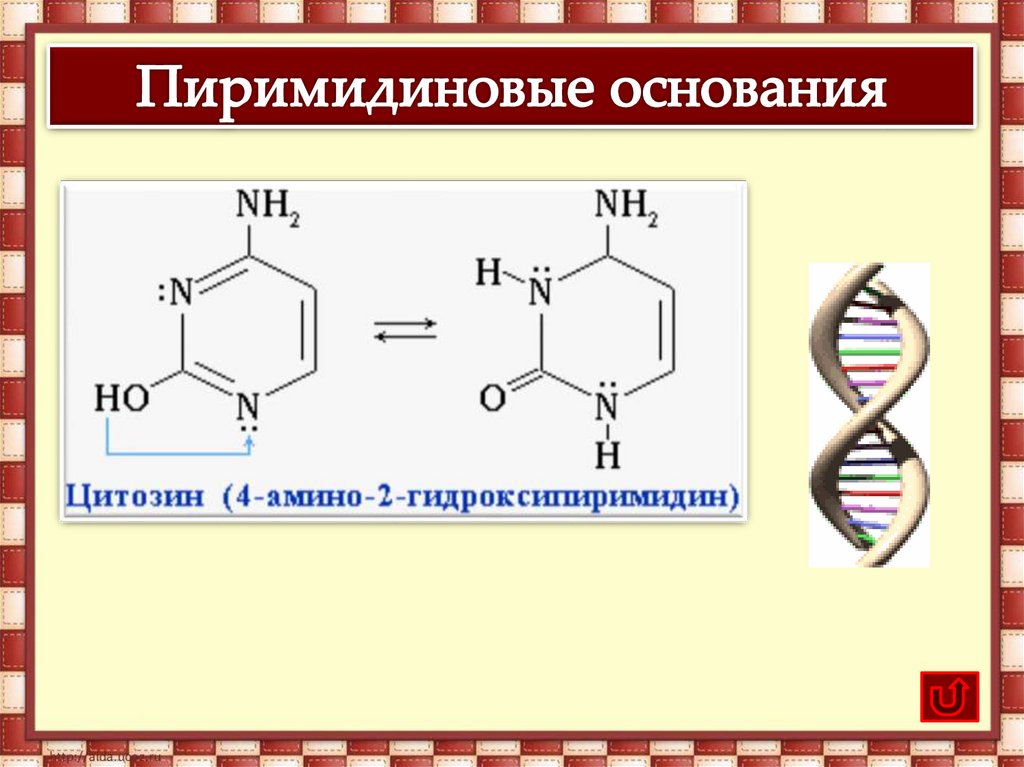
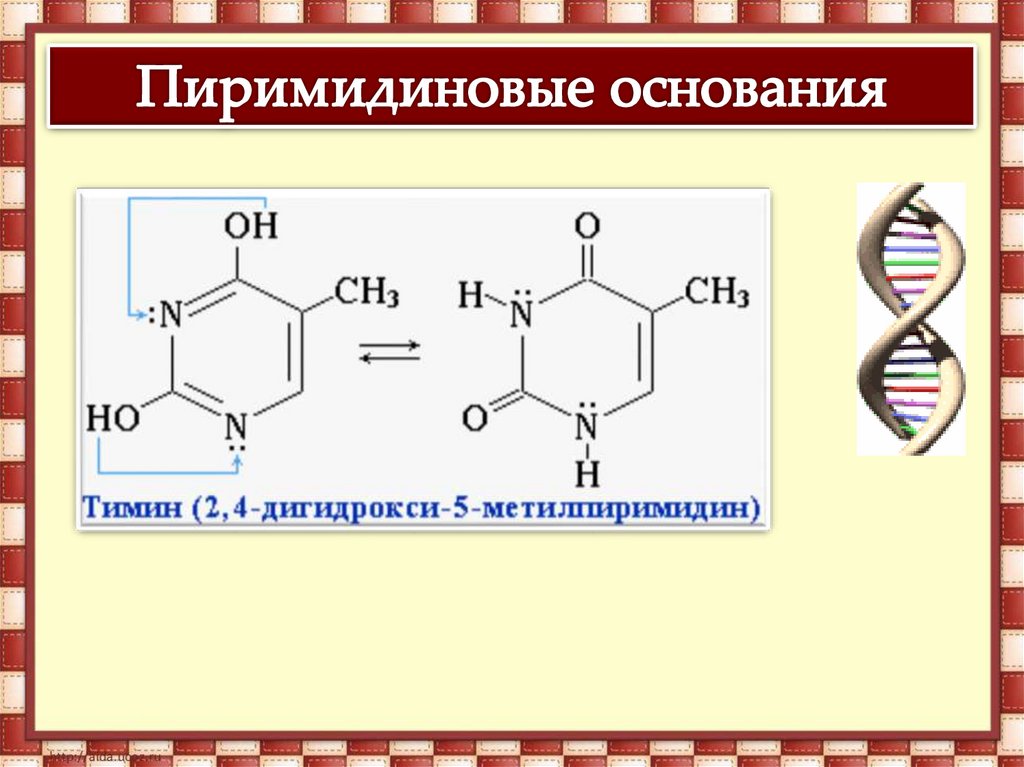
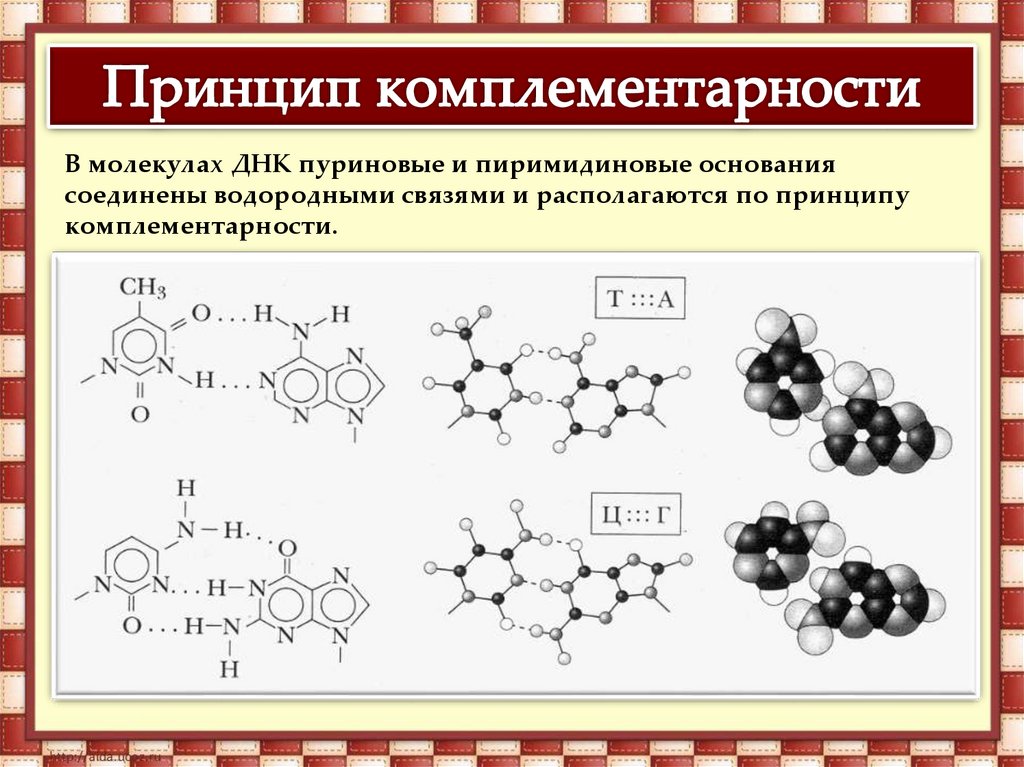
В молекулах ДНК пуриновые и пиримидиновые основаниясоединены водородными связями и располагаются по принципу
комплементарности.
















 chemistry
chemistry








