Similar presentations:
Основы химической термодинамики
1.
Основы химическойтермодинамики
КАФ.908 «ФИЗИЧЕСКАЯ ХИМИЯ»
1
2.
ТЕМА: «ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ.ТЕРМОХИМИЯ».
ЛЕКЦИЯ № 3
Основы химической термодинамики. Энергетика и
направленность химических процессов.
2
3.
План:1. Энергетические
эффекты
химических
реакций.
Внутренняя
энергия.
Энтальпия. Закон Гесса. Термохимические расчеты.
2. Химическое сродство. Свободная энергия Гиббса. Направление химических
реакций. Энтропия. Энтальпийный и энтропийный факторы энергии Гиббса.
3
4.
Физическая химия применяет физические теории и методы кхимическим явлениям.
Она объясняет, ПОЧЕМУ и КАК происходят превращения веществ:
химические реакции и фазовые переходы.
ПОЧЕМУ – химическая термодинамика
КАК – химическая кинетика
Химическая термодинамика
Изучает зависимость:
1) направления,
2) пределов превращений веществ от условий, в которых эти вещества
находятся.
Химическая термодинамика – наука о химическом и фазовом равновесии.
Переменные, которые химия внесла в термодинамику, – количество вещества
и число фаз.
В основе термодинамики – три закона и два постулата
4
5.
Химическая термодинамикаВопросами изменения энергии занимается термодинамика. Коротко её определяют как
науку о теплоте, работе и температуре.
Химическая термодинамика изучает следующие вопросы:
1. Переходы энергии из одной формы в другую.
2. Энергетические эффекты, сопровождающие различные физические и химические
процессы, зависимость их от условий протекания.
3. Возможность, направление и пределы самопроизвольного протекания процессов в
заданных условиях.
5
6.
Особенности химической термодинамики1. Нет времени. В химических превращениях рассматриваются только
исходные (реагенты) и конечные (продукты) состояния.
2. Не рассматривается внутренняя структура химических систем.
3. Небольшое число существенных переменных.
4. Огромное число надежных выводов при минимальном числе исходных
предпосылок (Эйнштейн).
Задачи химической термодинамики
• Получение термодинамических данных для новых соединений.
• Изучение стабильности соединений и фаз.
• Предсказание направления химической реакции.
• Расчет состава реакционной смеси и выхода химических реакций.
• Изучение возможности получения энергии из химических реакций в виде теплоты и
работы.
• Применение термодинамических подходов в химической кинетике.
6
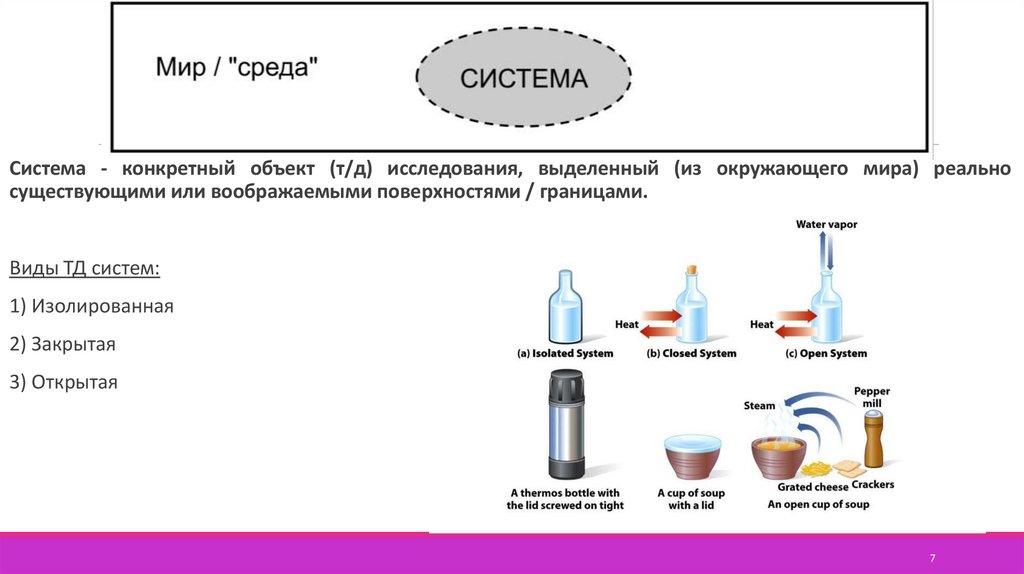
7.
Система - конкретный объект (т/д) исследования, выделенный (из окружающего мира) реальносуществующими или воображаемыми поверхностями / границами.
Виды ТД систем:
1) Изолированная
2) Закрытая
3) Открытая
7
8.
ТДСОткрытая
Закрытая
Изолированная
От крыт ая ТДС – система, которая обменивается с
окружающей средой и веществом, и энергией
Закрыт ая ТДС – система, которая обменивается с
окружающей средой только энергией
Изолированная ТДС – система, которая не
обменивается
с
окружающей
средой
веществом, ни энергией (тепло- и массообмена нет)
ни
8
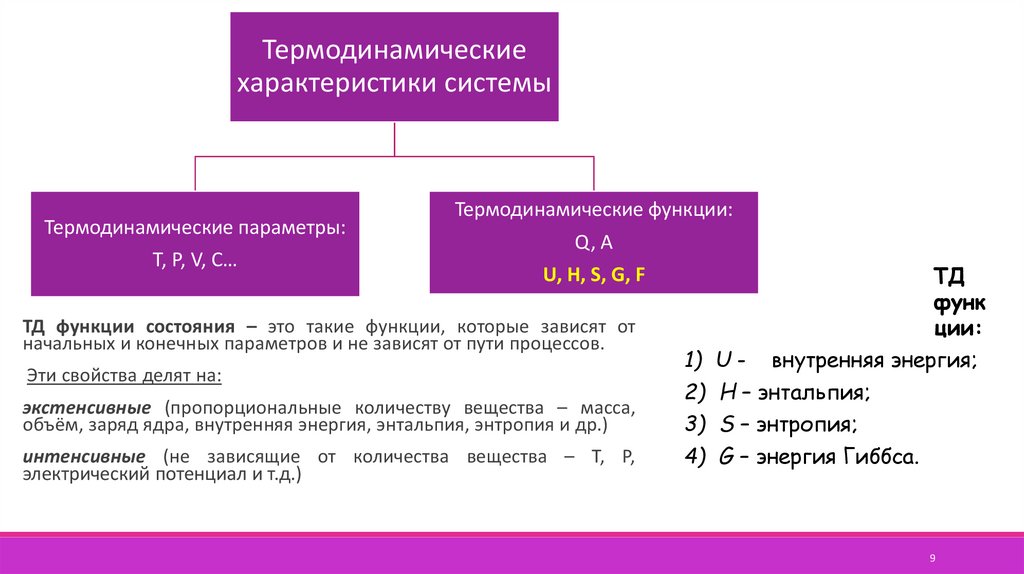
9.
Термодинамическиехарактеристики системы
Термодинамические параметры:
Т, Р, V, С…
Термодинамические функции:
Q, A
U, H, S, G, F
ТД функции состояния – это такие функции, которые зависят от
начальных и конечных параметров и не зависят от пути процессов.
Эти свойства делят на:
экстенсивные (пропорциональные количеству вещества – масса,
объём, заряд ядра, внутренняя энергия, энтальпия, энтропия и др.)
интенсивные (не зависящие от количества вещества – Т, Р,
электрический потенциал и т.д.)
ТД
функ
ции:
1) U - внутренняя энергия;
2) Н – энтальпия;
3) S – энтропия;
4) G – энергия Гиббса.
9
10.
ТД переменные характеризуют состояние термодинамическойсистемы. Подразделяются на ТД параметры и ТД функции
Параметры состояния -это свойства системы. Изменение
параметров ведет к изменению состояния системы
(P, T, V, C)
Функции состояния - т/д величины, характеризующие
энергетические изменения системы
Функции состояния:
внутренняя энергия (U)
энтальпия (Н)
энтропия (S)
свободная энергия (G)
10
11.
Компоненты – вещества, образующие систему, количества которыхможно менять независимо. Так, в растворе NaCI компоненты – NaCI и
Н2О. Количества Na+ и Cl- менять независимо нельзя, поэтому они не
являются полноценными компонентами.
Фаза – часть системы, которая отделена от других частей
поверхностью раздела. Внутри фазы свойства меняются непрерывно,
на поверхности раздела – скачком. В зависимости от числа фаз
система может быть гомогенной (1 фаза) и гетерогенной (несколько).
Процесс – изменение состояния системы, т.е. ее параметров.
Внешняя среда – все, что находится вне системы.
11
12.
I. Основные понятияхимической термодинамики
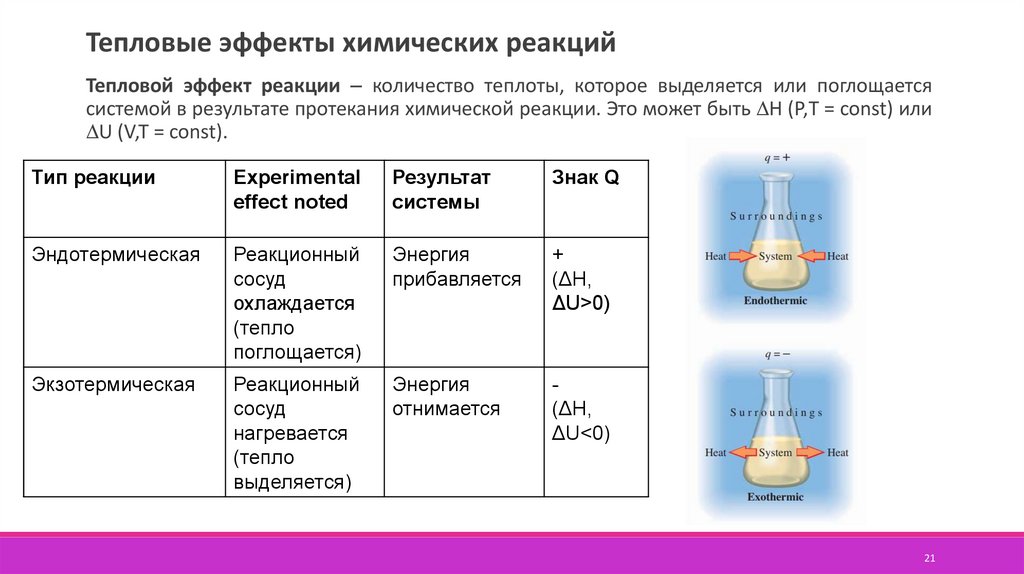
Термохимия
–
раздел
термодинамики,
изучающий тепловые эффекты химических
реакций, зависимость их от состава и
строения реагентов и от условий проведения
реакций
12
13.
"Нулевой закон термодинамики" (Фаулер, 1931, после II и I з.т.!)- закон термическогоравновесия: "две системы, находящиеся в" термическом равновесии* c третьей
системой, состоят в термическом равновесии друг с другом".
Система B играет роль термометра.
Температура – параметр,
характеризующий ТЕПЛОВОЕ
равновесие. Ее значение зависит от
свойств системы B (эмпирическая
температура).
13
14.
Смысл измерения температуры медицинским термометром заключается в«нулевом законе» термодинамики (Фаулер, 1931, сформулирован после II и I
законов, по-другому он называется законом термического равновесия): «две
системы, находящиеся в термическом равновесии c третьей системой, состоят в
термическом равновесии друг с другом». По сути закон описывает транзитивность
термодинамического равновесия, которая и позволяет измерить температуру у
разных людей и получить сопоставимые цифры (термометр – малая измерительная
система, она малая для того, чтобы не повлиять на температуру
измеряемого человека, при этом сама она меняет свою температуру значительно)
14
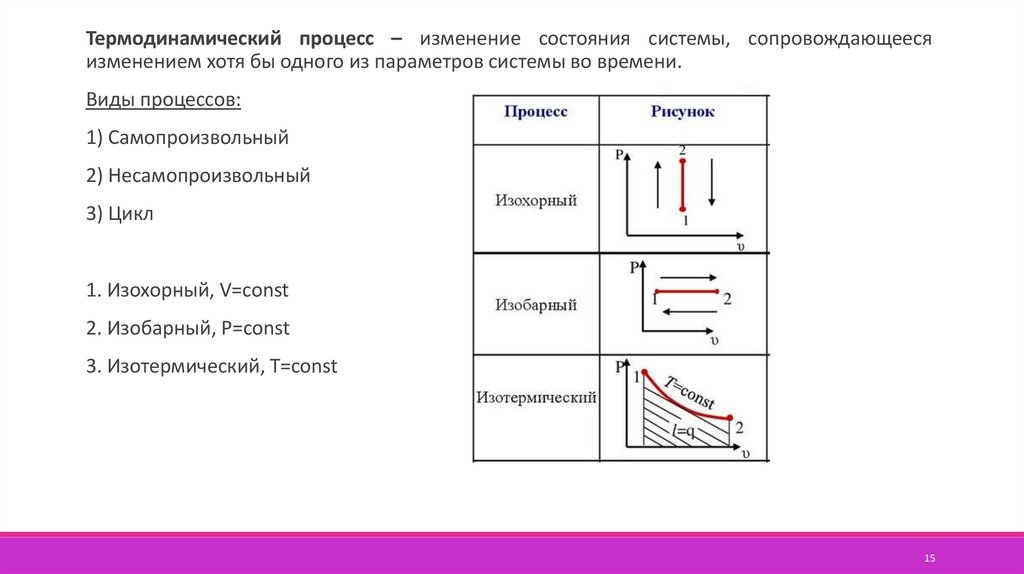
15.
Термодинамический процесс – изменение состояния системы, сопровождающеесяизменением хотя бы одного из параметров системы во времени.
Виды процессов:
1) Самопроизвольный
2) Несамопроизвольный
3) Цикл
1. Изохорный, V=const
2. Изобарный, P=const
3. Изотермический, T=const
15
16.
1617.
Разница понятий «теплота» и «работа» на примере аккумулятора. Если его поместить в термос, онавзорвется, а энергия, которая была в нем запасена, рассеется в виде тепла. Если же подключить его к
некой машине, созданной людьми, энергия перейдет в полезную работу
17
18.
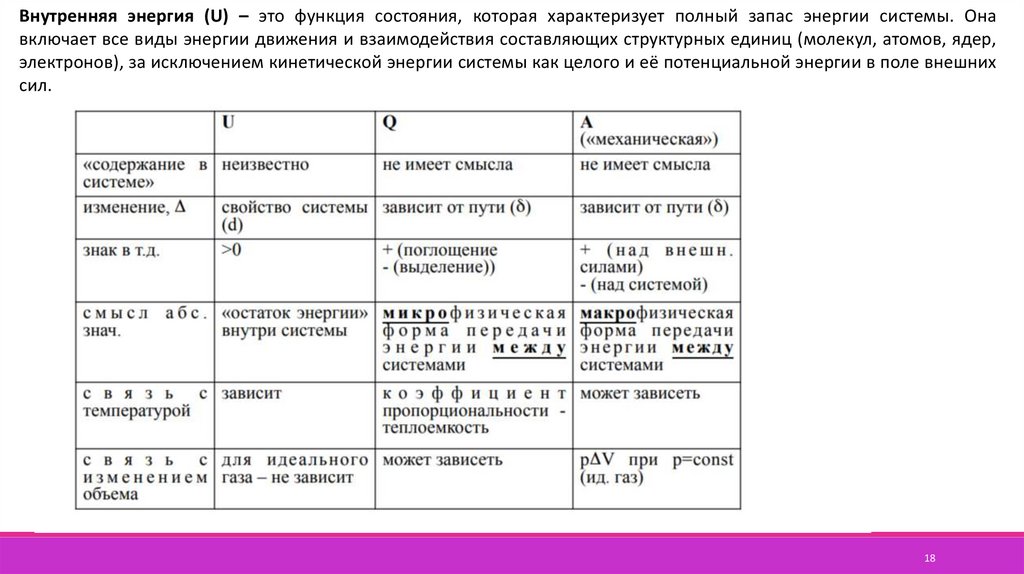
Внутренняя энергия (U) – это функция состояния, которая характеризует полный запас энергии системы. Онавключает все виды энергии движения и взаимодействия составляющих структурных единиц (молекул, атомов, ядер,
электронов), за исключением кинетической энергии системы как целого и её потенциальной энергии в поле внешних
сил.
18
19.
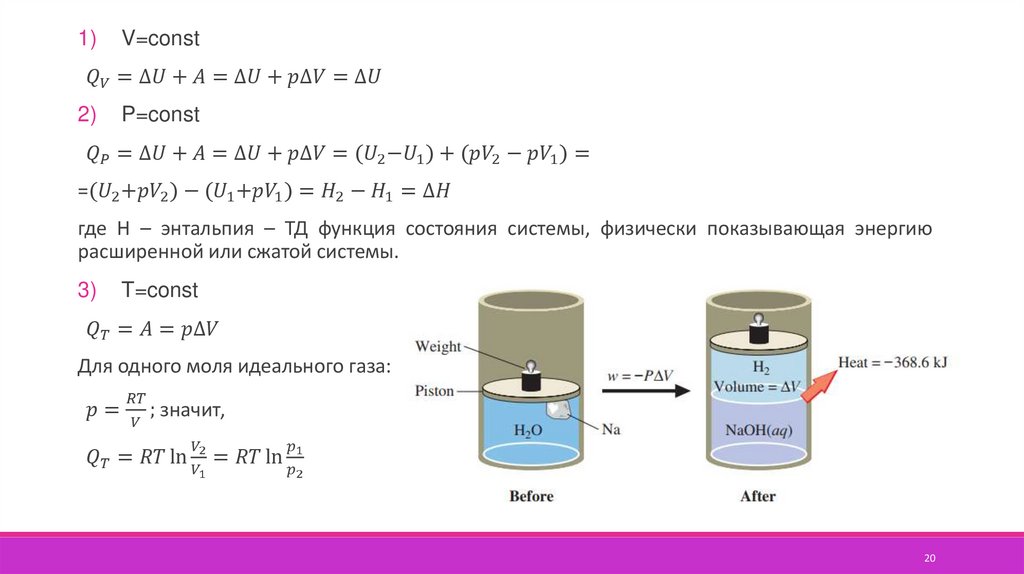
Количественное соотношение между изменением внутренней энергии,теплотой и работой устанавливает первый закон термодинамики –
тепловая энергия системы Q расходуется на изменение внутренней энергии
U и на работу системы против внешних сил или на работу внешних сил над
системой А.


















 chemistry
chemistry








