Similar presentations:
Алюминий. Электронное строение атома
1.
АЛЮМИНИЙРаботу выполнила ученица 11 м класса попова Арианна
2.
aluminium происходит от весьма узкоспециализированного слова alumen,.◦ Название
означающего «квасцы» — соли на основе алюминия, которые широко применялись
в медицине и выделке шкур и тканей с античных времен. «Алюминием» новый металл
в 1808 году назвал английский химик Гемфри Дэви.
3.
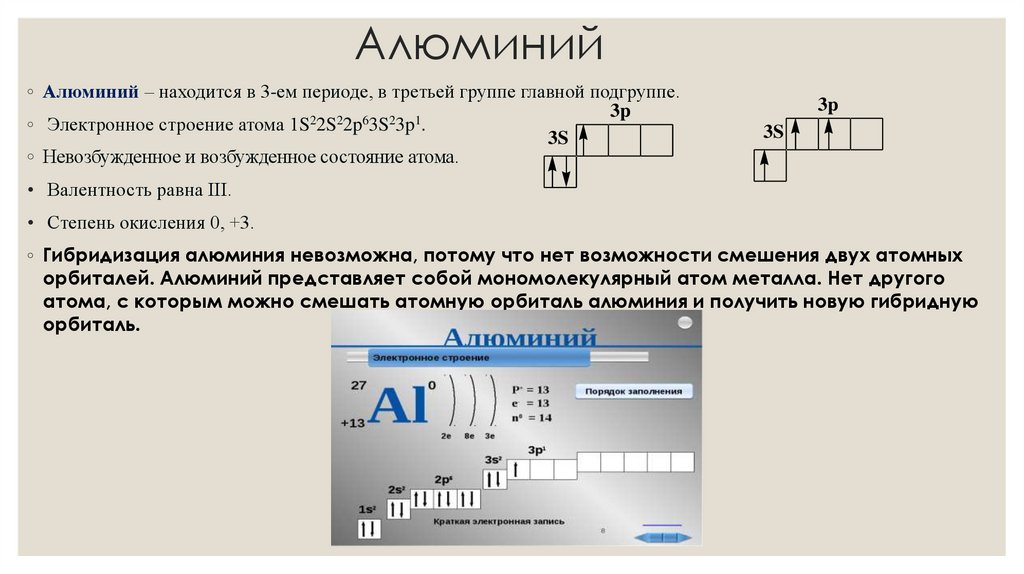
Алюминий◦ Алюминий – находится в 3-ем периоде, в третьей группе главной подгруппе.
3p
◦ Электронное строение атома 1S22S22p63S23p1.
3S
◦ Невозбужденное и возбужденное состояние атома.
3p
3S
• Валентность равна ІІІ.
• Степень окисления 0, +3.
◦ Гибридизация алюминия невозможна, потому что нет возможности смешения двух атомных
орбиталей. Алюминий представляет собой мономолекулярный атом металла. Нет другого
атома, с которым можно смешать атомную орбиталь алюминия и получить новую гибридную
орбиталь.
4.
История алюминия◦ Впервые алюминий получен Х. К. Эрстедом в 1825 г. действием амальгамы калия
на хлорид алюминия с последующей отгонкой ртути. Первый промышленный
способ производства алюминия – восстановлением Na 3 AlCl 6 металлическим
натрием – предложил в 1854 г. А. Э. Сент-Клер Девиль. Современный
электролитический способ получения алюминия разработан в 1886 г.
одновременно и независимо друг от друга Ч. Холлом в США и П. Эру во Франции.
5.
Нахождение в природе◦ По распространённости в земной коре занимает 1-е место среди металлов и 3-е место среди
элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре,
по данным различных исследователей, оценивается от 7,45 до 8,14 %.
6.
7.
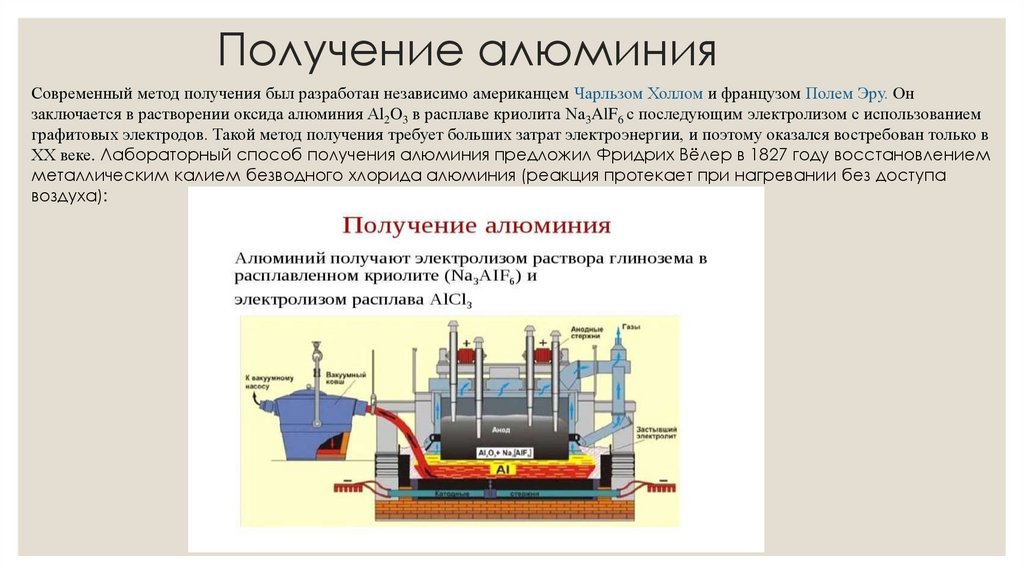
Получение алюминияСовременный метод получения был разработан независимо американцем Чарльзом Холлом и французом Полем Эру. Он
заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием
графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в
XX веке. Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году восстановлением
металлическим калием безводного хлорида алюминия (реакция протекает при нагревании без доступа
воздуха):
8.
.9.
.10.
11.
12.
13.
Применение алюминия14.
.15.
16.
Алюминий в организме человека◦ Отличается слабым токсическим действием (намного меньшим, чем у «тяжёлых» металлов), но
многие растворимые в воде неорганические соединения алюминия сохраняются в растворённом
состоянии длительное время и могут оказывать вредное воздействие на человека и теплокровных
животных через питьевую воду. Наиболее ядовиты хлориды, нитраты, ацетаты, сульфаты, фосфиды
◦ Алюминий играет в организме важную физиологическую роль: участвует в образовании
фосфатных и белковых комплексов; процессах регенерации костной, соединительной и
эпителиальной ткани; оказывает, в зависимости от концентрации, тормозящее или активирующее
действие на пищеварительные ферменты; способен влиять на функцию паращитовидных желез.
◦ Содержание алюминия в организме взрослого человека – 30 - 50 мг. Депонируется алюминий в
костях, печени, лёгких и в сером веществе головного мозга. С возрастом содержание этого
элемента в лёгких и в головном мозге увеличивается.
◦ Основные способы выведения поступившего в кровь алюминия – с мочой и желчью. Нарушение
функции почек приводит к повышенному накоплению алюминия.
◦ Алюминий легко переходит в кровь и накапливается в головном мозге, костях, клетках эритроидного ростка.
Поражение ЦНС проявляется недомоганием , снижением памяти , подергиваниями мышц , эпилептическими
припадками ; возможен летальный исход.
◦ Другие симптомы включают остеомаляцию, переломы, миалгию, слабость, анемию.















 chemistry
chemistry








