Similar presentations:
Строение электронных оболочек атомов
1.
2.
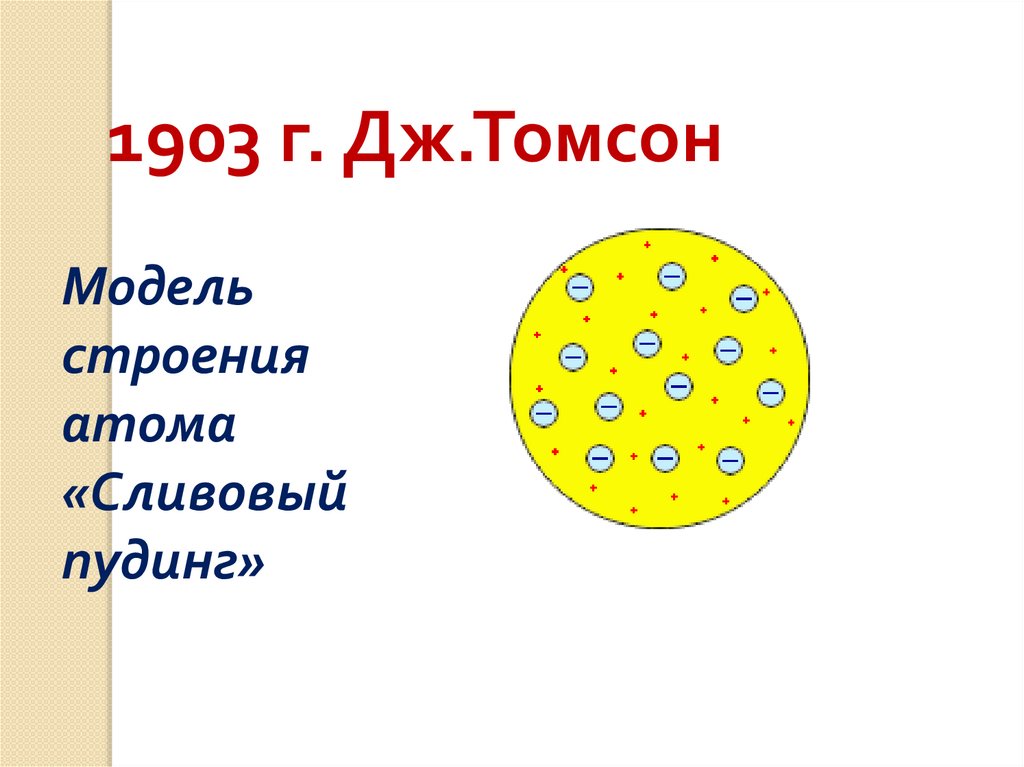
1903 г. Дж.ТомсонМодель
строения
атома
«Сливовый
пудинг»
1924
3.
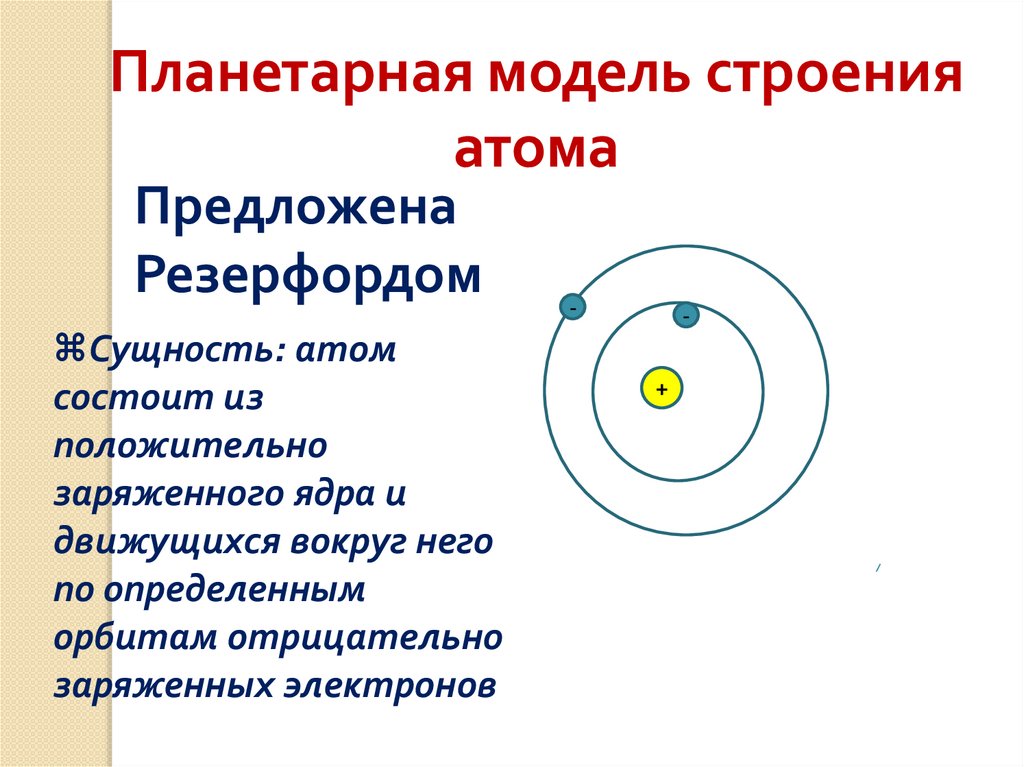
Планетарная модель строенияатома
Предложена
Резерфордом
Сущность: атом
состоит из
положительно
заряженного ядра и
движущихся вокруг него
по определенным
орбитам отрицательно
заряженных электронов
-
+-
4.
1924 г. Л.де Бройль◦ Дуализм (двойственность)
электрона:
Электрон – это частица и
волна одновременно
5.
Дуализм электронаКак волна:
Как частица:
При движении не
Имеет массу и
заряд
оставляет
траектории, можно
говорить лишь о
вероятности
нахождения
электрона в той или
иной точке
пространства
6.
Электроны располагаются вокругядра по энергетическим уровням (э.у.)
Число электронов на энергетическом
2
уровне вычисляют по формуле 2n
1 э.у. 2 • 1 = 2
2 э.у. 2 • 4 = 8
3 э.у. 2 • 9 = 18 и т.д.
7.
Строение электронных оболочекатомов элементов 1, 2,и 3 периодов
+1Н 1е
+3Li 2e1e
+4Be2e2e
+5B 2e3e …
+2Не2е
+10Ne2e8e
+11Na 2e8e1e +12Mg2e8e2e +13AI 2e8e3e … +Ar2e8e8e
Электроны расположенные на крайнем (внешнем)
энергетическом уровне называются внешними
Число внешних электронов совпадает с
номером группы в которой находится элемент
(для элементов главных подгрупп)
8.
Задание: Определите числовнешних электронов у элементов
теллура, бария, олова
Теллура - 6е
Бария - 2е
Олова - 4е
9.
Число энергетических уровней ватоме совпадает с номером
периода в котором находится
элемент
На скольки энергетических уровнях
расположены электроны в атомах кальция, серы,
бария?
Кальция - на 4
Серы - на 3
Бария - на 6
10.
Домашнее задание:§8, записи в тетради








 physics
physics








