Similar presentations:
Карбонильные соединения
1.
КАРБОНИЛЬНЫЕСОЕДИНЕНИЯ
2.
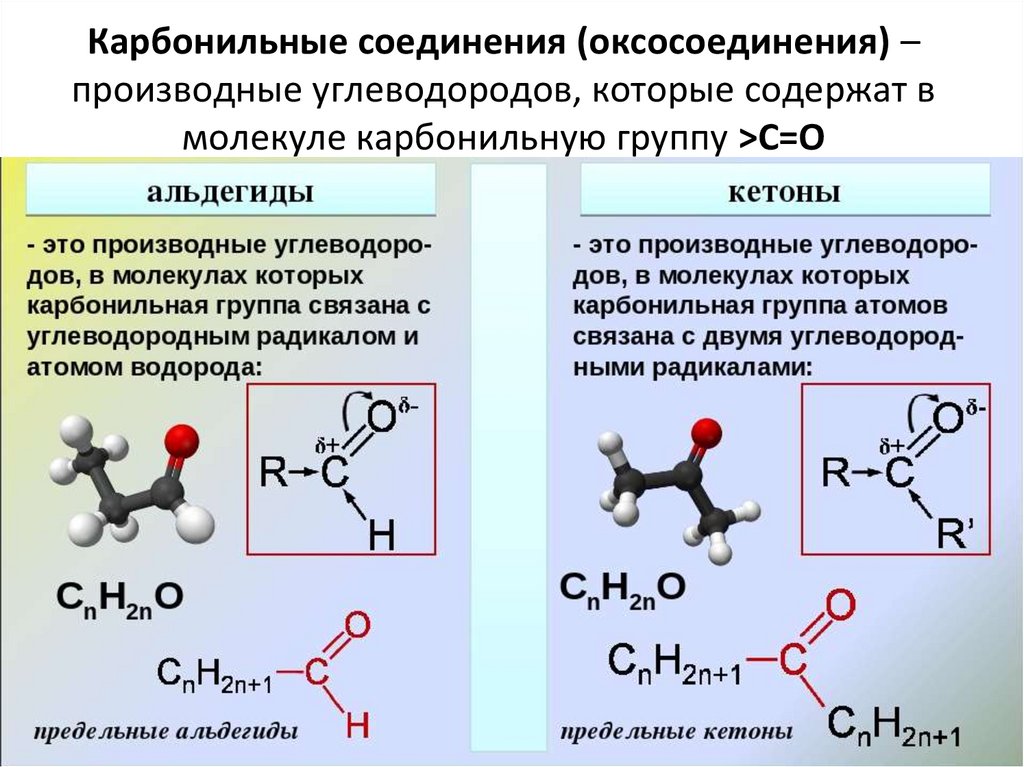
Карбонильные соединения (оксосоединения) –производные углеводородов, которые содержат в
молекуле карбонильную группу >С=О
3.
СтруктураАтомы углерода и кислорода в карбонильной группе находятся в
состоянии sp2-гибридизации. Углерод своими sp2-гибридными
орбиталями образует три σ-связи (одна из них — связь С–О),
которые располагаются в одной плоскости под углом
около 120° друг к другу.
Связь
С=О
сильно
поляризована. Электроны кратной связи С=О,
особенно более подвижные π-электроны,
смещены к более электроотрицательному
атому кислорода, что приводит к появлению
на нем частичного отрицательного заряда
Одна из трех sp2-орбиталей
кислорода участвует в σ-связи С–О, δ¯. Карбонильный углерод приобретает+ при
этом частичный положительный заряд (δ ).
две другие содержат
неподеленные электронные пары.
4.
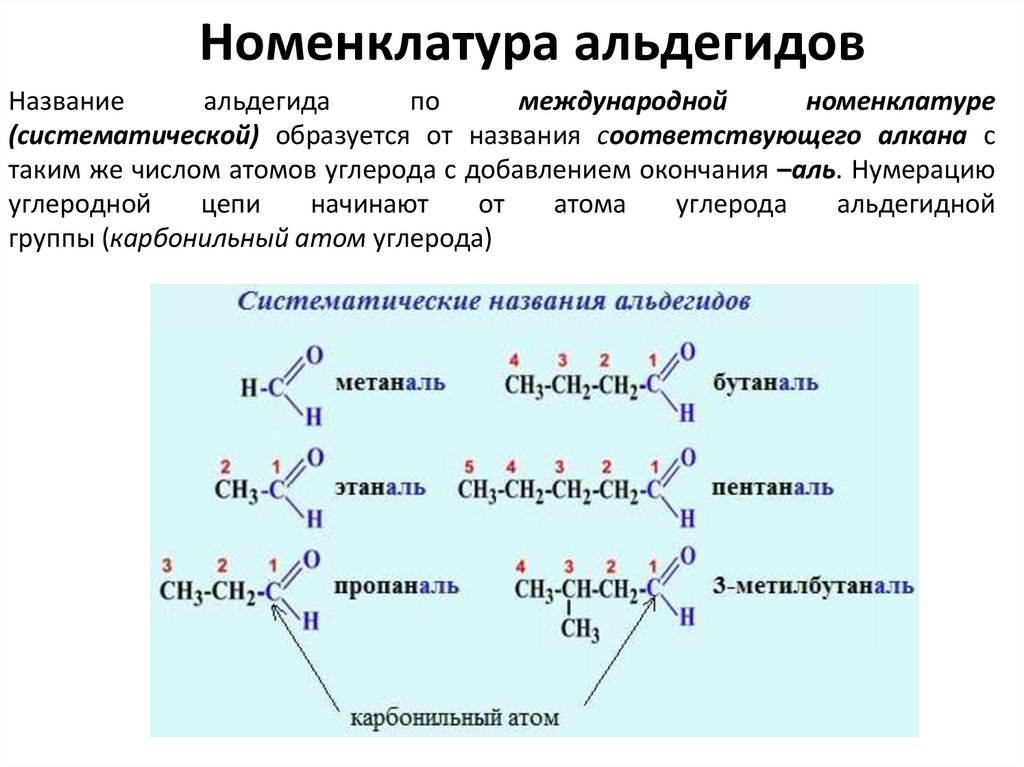
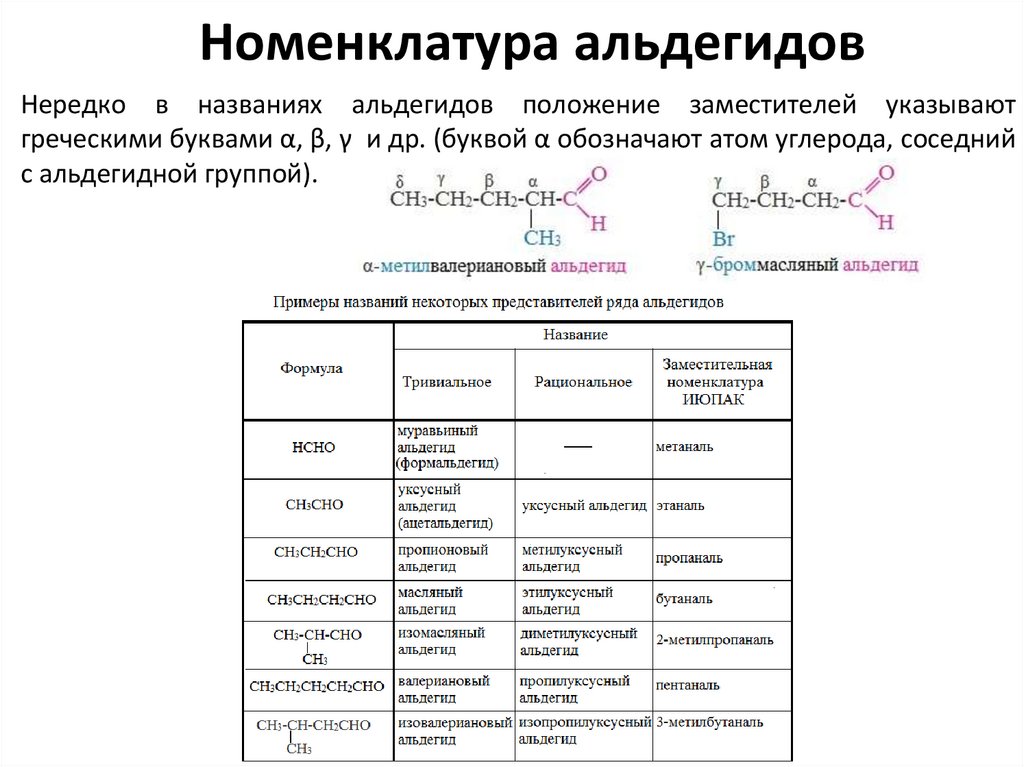
Номенклатура альдегидовНазвание
альдегида
по
международной
номенклатуре
(систематической) образуется от названия соответствующего алкана с
таким же числом атомов углерода с добавлением окончания –аль. Нумерацию
углеродной
цепи
начинают
от
атома
углерода
альдегидной
группы (карбонильный атом углерода)
5.
Номенклатура альдегидовНередко в названиях альдегидов положение заместителей указывают
греческими буквами α, β, γ и др. (буквой α обозначают атом углерода, соседний
с альдегидной группой).
6.
Номенклатура кетоновКетоны
этого
ряда
называют
как
по
радикало-функциональной
номенклатуре (для кетонов простого строения), так и по систематической
международной номенклатуре. В последнем случае выбирается наиболее
длинная цепь, несущая карбонильную группу и кратную связь.
К названию соответствующего алкена добавляется окончание «он» и цифрами
указывается положение кратной связи и карбонильной группы, которая в этом
случае должна получить наименьший номер.
7.
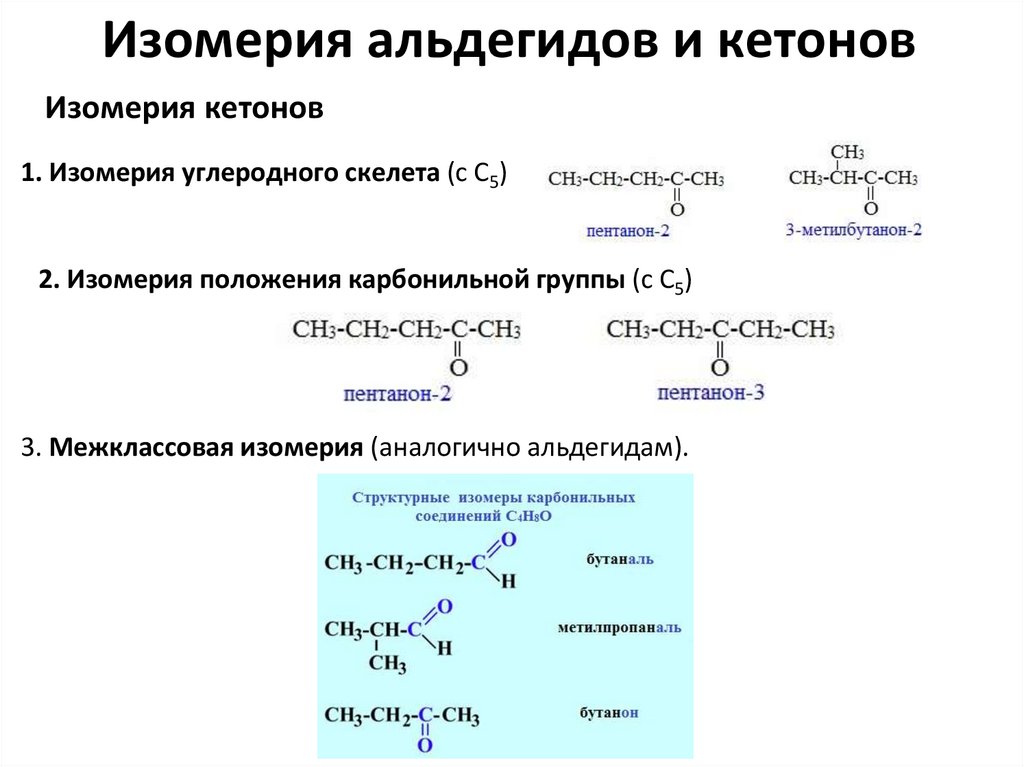
Изомерия альдегидов и кетоновИзомерия альдегидов
1.Изомерия углеродного скелета, начиная с С4
2. Межклассовая изомерия
с кетонами, начиная с С3
с циклическими оксидами (с С2)
с непредельными спиртами и простыми
эфирами (с С3)
8.
Изомерия альдегидов и кетоновИзомерия кетонов
1. Изомерия углеродного скелета (c C5)
2. Изомерия положения карбонильной группы (c C5)
3. Межклассовая изомерия (аналогично альдегидам).
9.
Физические свойства альдегидов и кетоновВ молекулах альдегидов и кетонов отсутствуют атомы водорода,
способные к образованию водородных связей. Поэтому их температуры
кипения ниже, чем у соответствующих спиртов. В то же время температура
кипения альдегидов выше, чем у соответствующих по молекулярной массе
углеводородов, что связано с высокой полярностью альдегидов.
Температуры кипения кетонов несколько выше, чем у изомерных им
альдегидов.
Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 —
жидкости, высшие карбонильные соединения — твердые вещества. Низшие
гомологи растворимы в воде,с увеличением углеводородного радикала
растворимость в воде падает. Ароматические карбонильные соединения в
воде плохо растворимы.
Отличительной чертой многих альдегидов является их запах.
Низшие альдегиды имеют резкий запах (хотя при сильном разведении
запах становится приятным и напоминает аромат плодов), у альдегидов,
содержащих С4-С6 – неприятный запах, высшие альдегиды и кетоны
обладают цветочными запахами. Альдегиды и кетоны хорошо
растворяются в органических растворителях.
10.
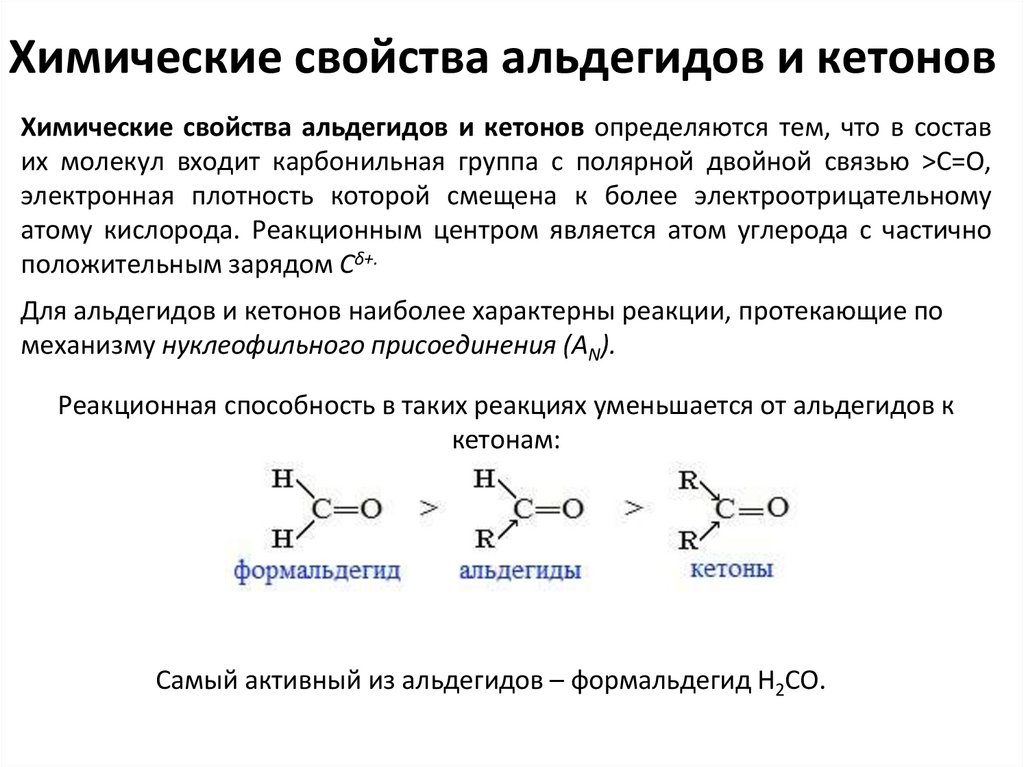
Химические свойства альдегидов и кетоновХимические свойства альдегидов и кетонов определяются тем, что в состав
их молекул входит карбонильная группа с полярной двойной связью >C=O,
электронная плотность которой смещена к более электроотрицательному
атому кислорода. Реакционным центром является атом углерода с частично
положительным зарядом Cδ+.
Для альдегидов и кетонов наиболее характерны реакции, протекающие по
механизму нуклеофильного присоединения (AN).
Реакционная способность в таких реакциях уменьшается от альдегидов к
кетонам:
Самый активный из альдегидов – формальдегид Н2СО.
11.
I. Реакции с разрывом π- связи С=О1. Гидрирование
Реакцию восстановления альдегидов и кетонов широко используют для
получения спиртов. Присоединение водорода по кратной связи С=О
происходит при нагревании в присутствии катализаторов (Ni, Pt, Pd).
В результате образуются спирты соответствующего строения. Гидрирование
альдегидов приводит к образованию первичных спиртов, гидрирование
кетонов – ко вторичным.
12.
I. Реакции с разрывом π- связи С=О2. Присоединение циановодородной (синильной) кислоты НСN
Альдегиды и кетоны, взаимодействуя с синильной кислотой, образуют
циангидрины – органические соединения, молекулы которых содержат две
функциональные группы: циано-группу и гидроксильную –ОН.
Присоединение идет в соответствии с распределением электронной
плотности в молекулах:
Образовавшееся соединение содержит на один атом углерода больше, чем
исходный альдегид или кетон, поэтому подобные реакции используют для
удлинения углеродной цепи.
Циангидрин CH3— CH(CN) — OH — яд! Он содержится в ядрах косточек
вишен, слив, персика.
Циангидрины используют как промежуточные соединения в синтезах окси- и
аминокислот. Некоторые циангидрины встречаются в растениях. Употребление
таких растений в пищу может привести к тяжелым отравлениям вследствие
высвобождения синильной кислоты в организме.
13.
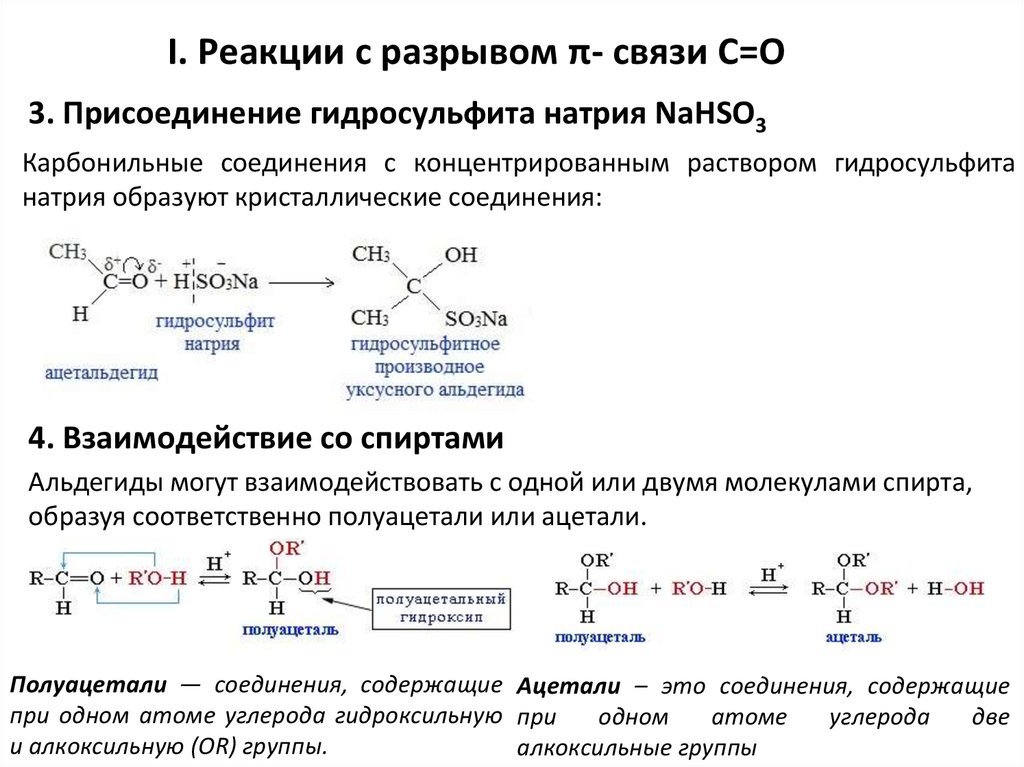
I. Реакции с разрывом π- связи С=О3. Присоединение гидросульфита натрия NaHSO3
Карбонильные соединения с концентрированным раствором гидросульфита
натрия образуют кристаллические соединения:
4. Взаимодействие со спиртами
Альдегиды могут взаимодействовать с одной или двумя молекулами спирта,
образуя соответственно полуацетали или ацетали.
Полуацетали — соединения, содержащие Ацетали – это соединения, содержащие
при одном атоме углерода гидроксильную при
одном
атоме
углерода
две
и алкоксильную (ОR) группы.
алкоксильные группы
14.
I. Реакции с разрывом π- связи С=О5. Гидратация (присоединение воды)
Альдегиды в водных растворах существуют в виде гидратных форм,
образующихся в результате присоединения воды к карбонильной группе:
Эта
реакция
возможна
только
для формальдегида и уксусного альдегида.
Кетоны не реагируют с водой.
6. Присоединение реактива Гриньяра — образование спиртов
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой
стружке легко происходит экзотермическая реакция, магний переходит в
раствор и образуется реактив Гриньяра
15.
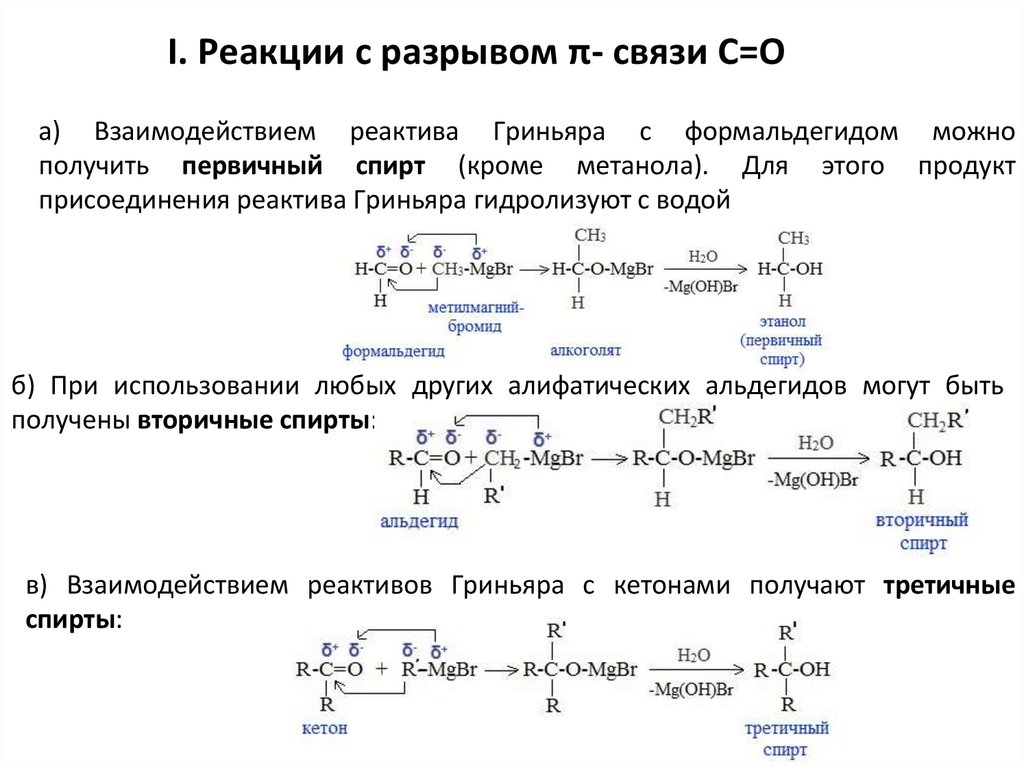
I. Реакции с разрывом π- связи С=Оа) Взаимодействием реактива Гриньяра с формальдегидом можно
получить первичный спирт (кроме метанола). Для этого продукт
присоединения реактива Гриньяра гидролизуют с водой
б) При использовании любых других алифатических альдегидов могут быть
получены вторичные спирты:
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные
спирты:
16.
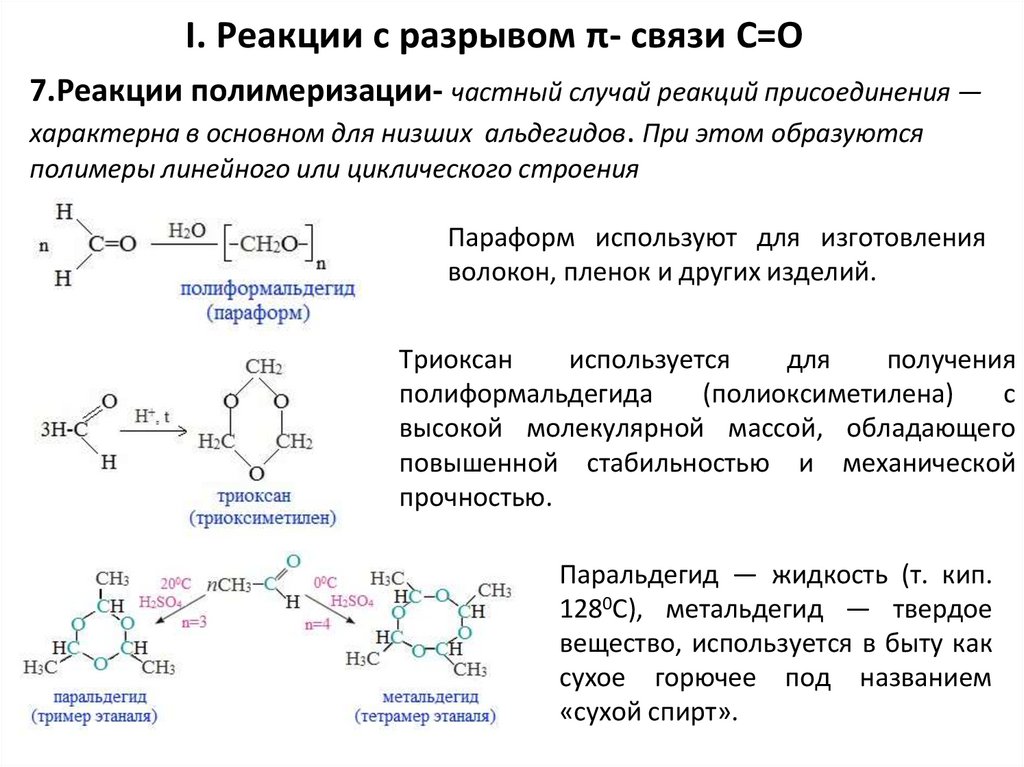
I. Реакции с разрывом π- связи С=О7.Реакции полимеризации- частный случай реакций присоединения —
характерна в основном для низших альдегидов. При этом образуются
полимеры линейного или циклического строения
Параформ используют для изготовления
волокон, пленок и других изделий.
Триоксан
используется
для
получения
полиформальдегида
(полиоксиметилена)
с
высокой молекулярной массой, обладающего
повышенной стабильностью и механической
прочностью.
Паральдегид — жидкость (т. кип.
1280С), метальдегид — твердое
вещество, используется в быту как
сухое горючее под названием
«сухой спирт».
17.
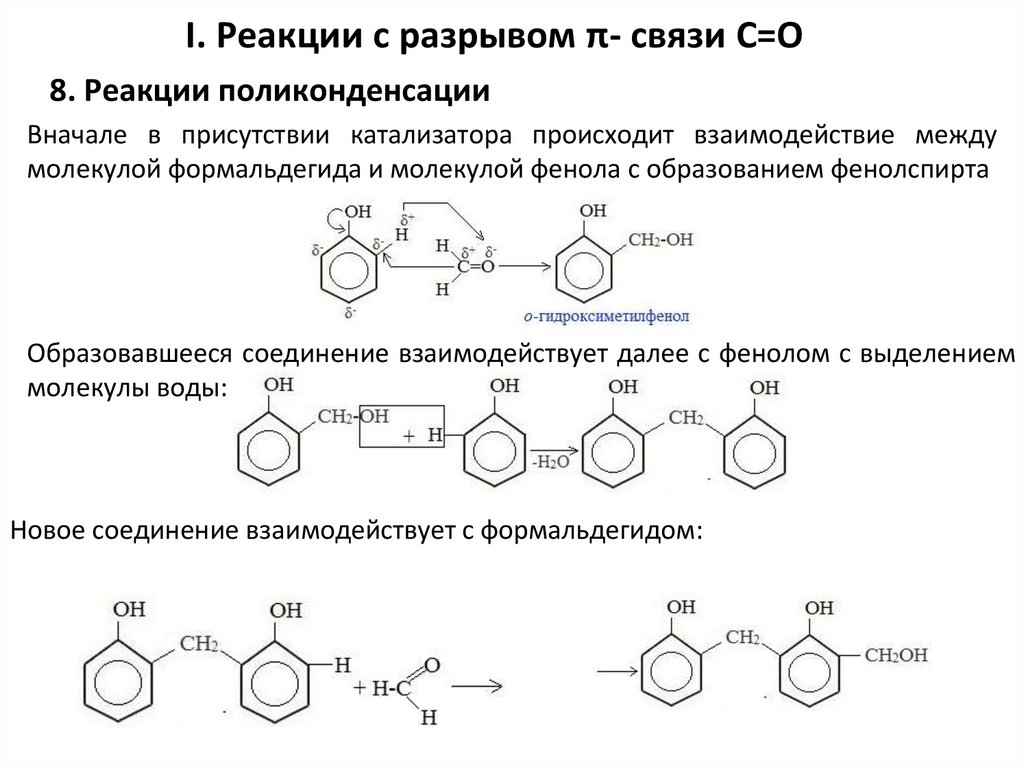
I. Реакции с разрывом π- связи С=О8. Реакции поликонденсации
Вначале в присутствии катализатора происходит взаимодействие между
молекулой формальдегида и молекулой фенола с образованием фенолспирта
Образовавшееся соединение взаимодействует далее с фенолом с выделением
молекулы воды:
Новое соединение взаимодействует с формальдегидом:
18.
II. Реакции с разрывом связи С(О)-Н(реакции окисления)В молекулах альдегидов атом углерода карбонильной группы, имеющий
избыточный положительный заряд, притягивает к себе электроны связи С-Н.
Вследствие этого атом водорода приобретает большую реакционную активность,
что проявляется в способности альдегидов к окислению.
Альдегиды легко окисляются в соответствующие карбоновые кислоты под
действием таких мягких окислителей, как оксид серебра и гидроксид меди (II).
Окисление происходит по связи С-Н в альдегидной группе –СН=О, которая
превращается при этом в карбоксильную группу –С(ОН)=О.
19.
II. Реакции с разрывом связи С(О)-Н(реакции окисления)1. Реакция «серебряного зеркала» - окисление аммиачным
раствором оксида серебра
Качественная реакция на альдегидную группу!
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя,
образуя зеркальную поверхность.
Реакцию «серебряного зеркала» широко используют для изготовления зеркал,
серебрения украшений и елочных игрушек.
Кетоны не вступают в эту реакцию
20.
II. Реакции с разрывом связи С(О)-Н(реакции окисления)2. Окисление гидроксидом меди (II)
Качественная реакция на альдегидную группу!
Для реакции используют свежеприготовленный Cu (ОН)2, образующийся при
взаимодействии растворимой соли меди (II) со щелочью.
Голубая суспензия гидроксида меди (II) при нагревании с альдегидом приобретает окраску оранжево-красного осадка оксида меди (I):
Кетоны в эту реакцию не вступают.
21.
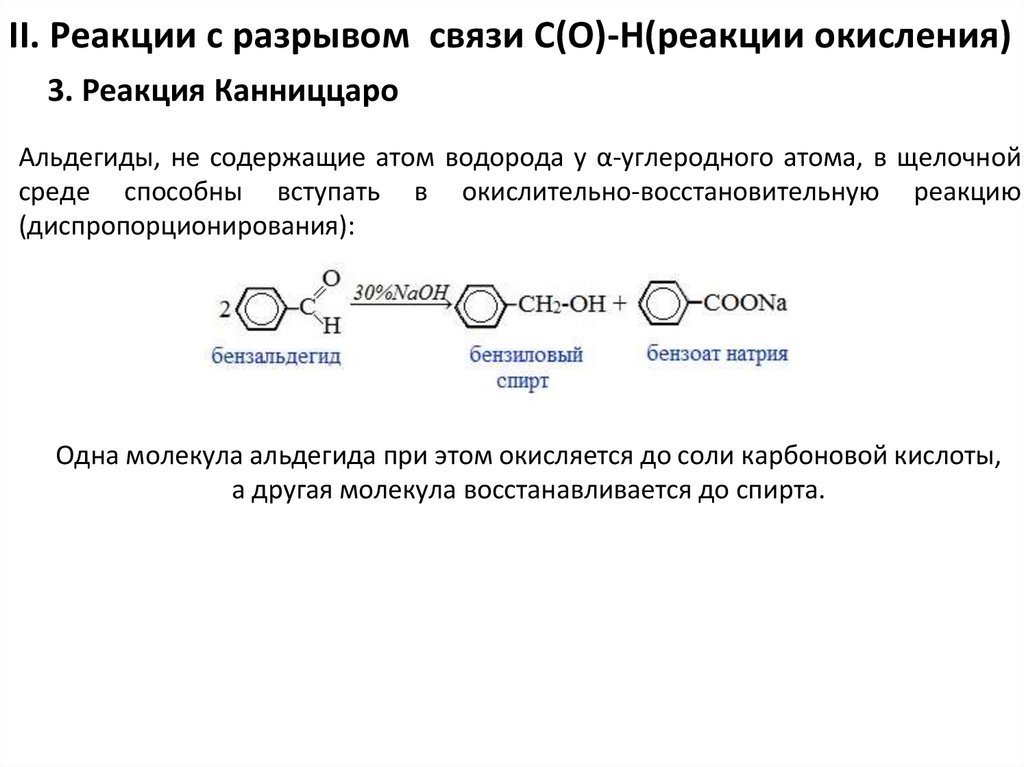
II. Реакции с разрывом связи С(О)-Н(реакции окисления)3. Реакция Канниццаро
Альдегиды, не содержащие атом водорода у α-углеродного атома, в щелочной
среде способны вступать в окислительно-восстановительную реакцию
(диспропорционирования):
Одна молекула альдегида при этом окисляется до соли карбоновой кислоты,
а другая молекула восстанавливается до спирта.
22.
II. Реакции с разрывом связи С(О)-Н(реакции окисления)4. Окисление перманганатом калия
Альдегиды можно окислить подкисленным раствором перманганат калия КMnO4 при
нагревании:
Происходит обесцвечивание раствора. Альдегидная группа окисляется до
карбоксильной, т.е. альдегид окисляется до соответствующей ему карбоновой
кислоты.
Муравьиный альдегид (формальдегид) окисляется до углекислого газа, потому
что соответствующая ему муравьиная кислота неустойчива к действию сильных
окислителей:
Для кетонов эта реакция не имеет практического значения, так как
происходит разрушение молекулы и в результате получается смесь продуктов.
23.
III. Реакции с разрывом связи С=О или С-Н(реакции замещения)
1. α -Галогенирование
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2, Br2, I2) с
образованием ɑ-галогенпроизводных.
Такой эффект наблюдается только для ɑ-атома углерода, т.е атома, следующего
за альдегидной группой, независимо от длины углеродного радикала.
При избытке галогена замещению подвергаются все атомы водорода при ɑуглеродном атоме:
Хлораль
обладает
снотворным
действием. На основе хлораля
получают
средства
борьбы
с
насекомыми (инсектициды), в том
числе
хлорофос,
а
также
различные гербициды.
24.
III. Реакции с разрывом связи С=О или С-Н(реакции замещения)
2. Замещение атомов О на атом галогена
R-CH=O + PCl5 → R-CHCl2 + POCl3
IV. Реакции с разрывом всех связей
Горение
Альдегиды и кетоны сгорают до углекислого газа и воды:














 chemistry
chemistry