Similar presentations:
Водород. Нахождение в природе. Физические и химические свойства. Применение
1. Водород. Нахождение в природе. Физические и химические свойства. Применение.
Цель:• Познакомиться с распространением водорода в
природе
• Изучить физические и химические свойства
водорода в сравнении с кислородом
• Рассмотреть основные области применения
водорода
2.
Используя оксид ртути (II) напишитеуравнения реакций, при которых
возможны следующие превращения:
3. Общая характеристика газообразных веществ
КислородХимический знак
О
Относительная
атомная масса
16
Химическая формула
О2
Относительная
молекулярная масса
32
Валентность
II
Водород
4. Общая характеристика газообразных веществ
КислородВодород
Химический знак
О
Н
Относительная
атомная масса
Молекула
16
1
О2
Н2
Относительная
молекулярная масса
32
2
Валентность
II
I
5.
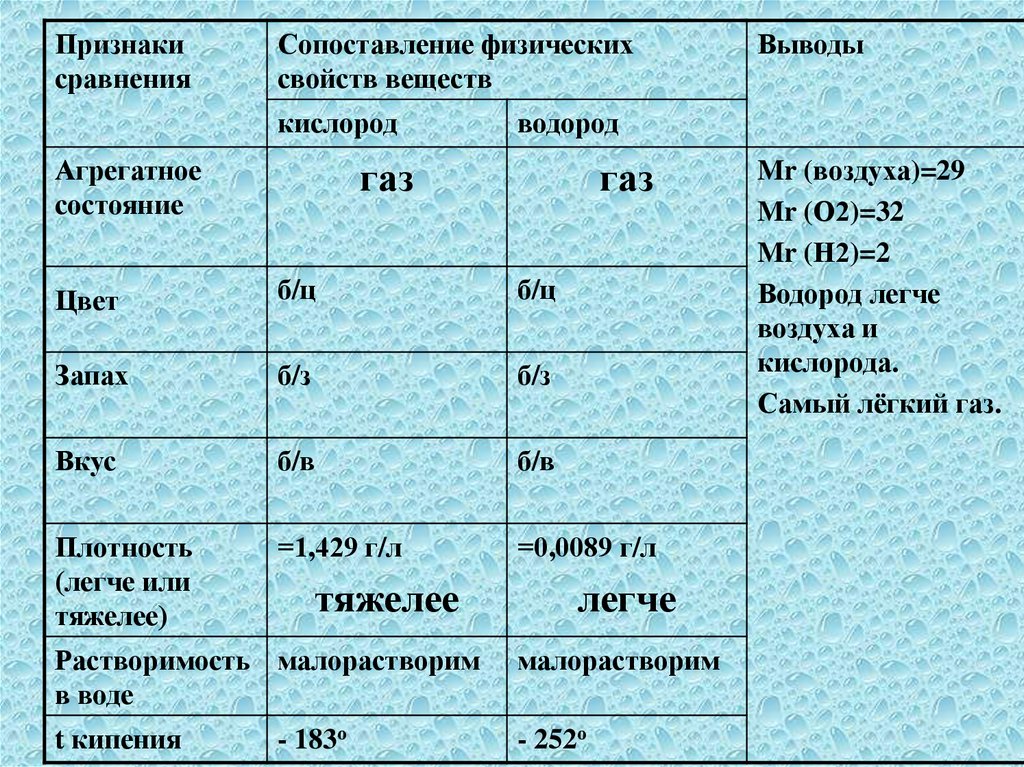
Признакисравнения
Сопоставление физических
свойств веществ
кислород
Агрегатное
состояние
водород
газ
газ
Цвет
б/ц
б/ц
Запах
б/з
б/з
Вкус
б/в
б/в
Плотность
(легче или
тяжелее)
=1,429 г/л
=0,0089 г/л
тяжелее
Растворимость малорастворим
в воде
t кипения
- 183о
Выводы
легче
малорастворим
- 252о
Mr (воздуха)=29
Mr (О2)=32
Mr (Н2)=2
Водород легче
воздуха и
кислорода.
Самый лёгкий газ.
6.
11,0079
1 S
7.
На долюводорода
приходится
50 % массы
Солнца и других
звезд
8.
9.
Земная кора(массовая доля)
1%
Другие
элементы
Водород
99 %
10.
В составе атмосферного воздухаприсутствие водорода менее 0,0001 %
11.
1766 г. ГенриКавендиш
12. Получение водорода.
В промышленности:Разложение воды электрическим током:
2H2O=2H2+O2
В лаборатории:
1. Взаимодействие цинка с соляной кислотой:
Zn+2H Cl=ZnCl2+ H2
хлорид цинка
2. Взаимодействие калия с водой:
2К+2H2O=2KOH+H2
гидроксид
калия
13.
Признакисравнения
Соединения с
простыми
веществами:
а)с металлами
б)
неметаллами
Сравнение химических свойств
газообразных веществ
Водород
Кислород
Взаимодействие
с кальцием
Са+Н2=СаН2
Взаимодействие
с кальцием
2Са+О2=2СаО
Взаимодействие с
серой
Н2+S=H2S
Взаимодействие с
серой: S+O2=SO2
гидрид кальция
сероводород
оксид кальция
Оксид
серы(IV)
Взаимодействие
кислорода с
водородом
2Н2+О2=2Н2О
Взаимодействи Взаимодействие с
е со сложными оксидом меди (II)
H2+CuO=Cu+H2O
веществами.
черный красный
Взаимодействие с
метаном(СН4)
СН4+2О2=СО2
+2Н2О+Q
Выводы
Водород и
кислород
взаимодей
ствуют с
простыми
и
сложным
и
вещества
ми.
14.
Для полученияаммиака
NH3
Для получения
соляной кислоты
HCl
Для получения
метилового
спирта СH3OH
H2
Восстановитель
металлов и оксидов
Как
топливо
15.
читать параграф 62; 63практическая работа №4;
Творческое задание: составить кроссворд
на тему «Водород»
16.
1. В лаборатории водород получают:а) кипячением воды;
б) сжижением воздуха;
в) взаимодействием неметаллов с водой;
г) взаимодействием металлов с HCl
2. Плотность газообразного водорода:
а) больше, чем у воздуха
б) равна плотности воздуха
в) меньше, чем у воздуха
г) больше, чем у кислорода
3. В промышленности водород получают:
а) разложением воды под действием электрического тока;
б) взаимодействием воды с метаном при высокой
температуре;
в) взаимодействием металлов с кислотами;
г) разложением сероводорода
4. Первооткрывателем водорода является:
а) Кавендиш
б) Шееле
в) Дьюар
г) Пристли
17. Проверь себя:
1–г2–в
3–а
4-а

















 chemistry
chemistry








