Similar presentations:
Ивлизи и Тенексиа - новое слово в современных подходах к терапии
1.
Ивлизи и Тенексиа –новое слово в
современных
подходах к терапии
ПИТРС
Договор №
ФИО Исполнителя: Токарева М.В..
Подпись: ______________/_______________
Токарева М.В.
врач-невролог отд.неврологии ККБ
г.Петропавловск-Камчатский 24.01.24
RU.DIVO.00015_17.02.2023_v2
2.
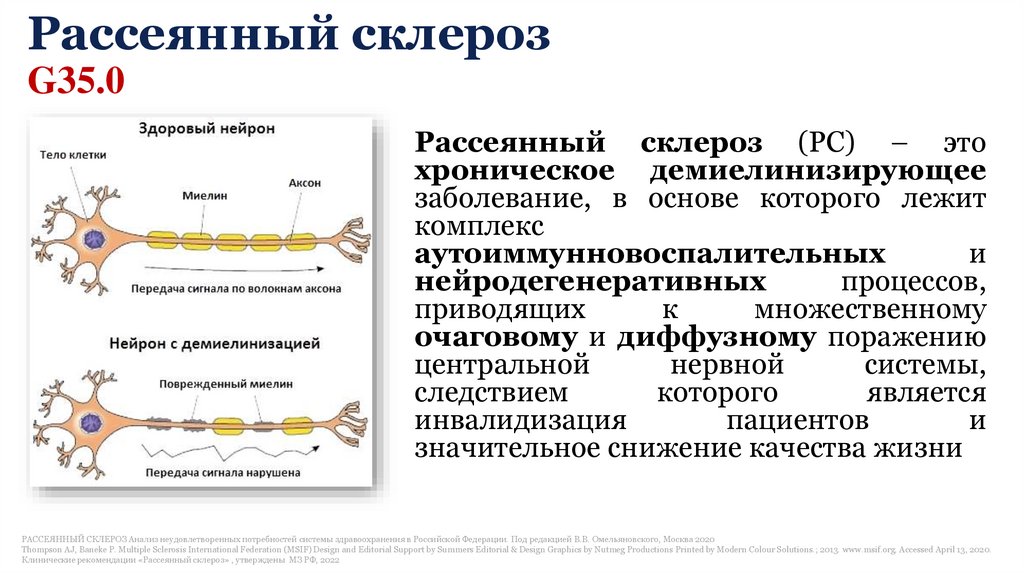
Рассеянный склерозG35.0
Рассеянный склероз (РС) – это
хроническое демиелинизирующее
заболевание, в основе которого лежит
комплекс
аутоиммунновоспалительных
и
нейродегенеративных
процессов,
приводящих
к
множественному
очаговому и диффузному поражению
центральной
нервной
системы,
следствием
которого
является
инвалидизация
пациентов
и
значительное снижение качества жизни
РАССЕЯННЫЙ СКЛЕРОЗ Анализ неудовлетворенных потребностей системы здравоохранения в Российской Федерации. Под редакцией В.В. Омельяновского, Москва 2020
Thompson AJ, Baneke P. Multiple Sclerosis International Federation (MSIF) Design and Editorial Support by Summers Editorial & Design Graphics by Nutmeg Productions Printed by Modern Colour Solutions.; 2013. www.msif.org. Accessed April 13, 2020.
Клинические рекомендации «Рассеянный склероз» , утверждены МЗ РФ, 2022
3.
Два основных повреждаюших компонентапри РС – воспаление и нейродегенерация
Обострение
Прогрессирование
Наиболее хорошо при РС изучено воспаление.
Именно с активацией воспалительного процесса в
тканях головного мозга связывают обострение. Это
происходит в связи с проникновением в ткани
головного или спинного мозга аутоантител,
которые воспринимают миелин ЦНС как нечто
чужеродное, запуская воспалительный процесс и
приводя к повреждению миелиновой оболочки.
Т.е. появление неврологических симптомов в
данном случае связано с воспалением в отдельных
областях ЦНС.
Второй повреждающий компонент —
нейродегенеративный. Происходит постепенная
гибель нейронов и аксонов в головном и/или
спинном мозге, что ведет к aтрофии (уменьшению
объема) мозга.
Цикл брошюр «Библиотека рассеянного склероза» БЕТАЛАЙФ «Жизнь с рассеянным склерозом»
4.
Рассеянный склероз: актуализация90000 пациентов: 98.2% - взр; 83.7% - трудоспособные
Средний возраст дебюта – 30 лет
ж/м – 3 к 1
Рост заболеваемости :
10% (2003-2008);
3,3% (2016-2017)
Инвалидизация:
10 лет – 50% трудности с выполнением профессиональных обязанностей
15 лет – 50% трудности с самостоятельным передвижением
20 лет - проблемы с самообслуживанием
25% пациентов с РС задержка диагностики более 5 лет
10% - более 10 лет
Задержка в назначении ПИТРС до 3 лет
РАССЕЯННЫЙ СКЛЕРОЗ Анализ неудовлетворенных потребностей системы здравоохранения в Российской Федерации. Под редакцией В.В. Омельяновского, Москва 2020
Thompson AJ, Baneke P. Multiple Sclerosis International Federation (MSIF) Design and Editorial Support by Summers Editorial & Design Graphics by Nutmeg Productions Printed by Modern Colour Solutions.; 2013. www.msif.org. Accessed April 13, 2020.
Клинические рекомендации «Рассеянный склероз» , утверждены МЗ РФ, 2022
5.
Наиболее часто встречающиесяСимптомы РС
Цикл брошюр «Библиотека рассеянного склероза» БЕТАЛАЙФ «Жизнь с рассеянным склерозом»
6.
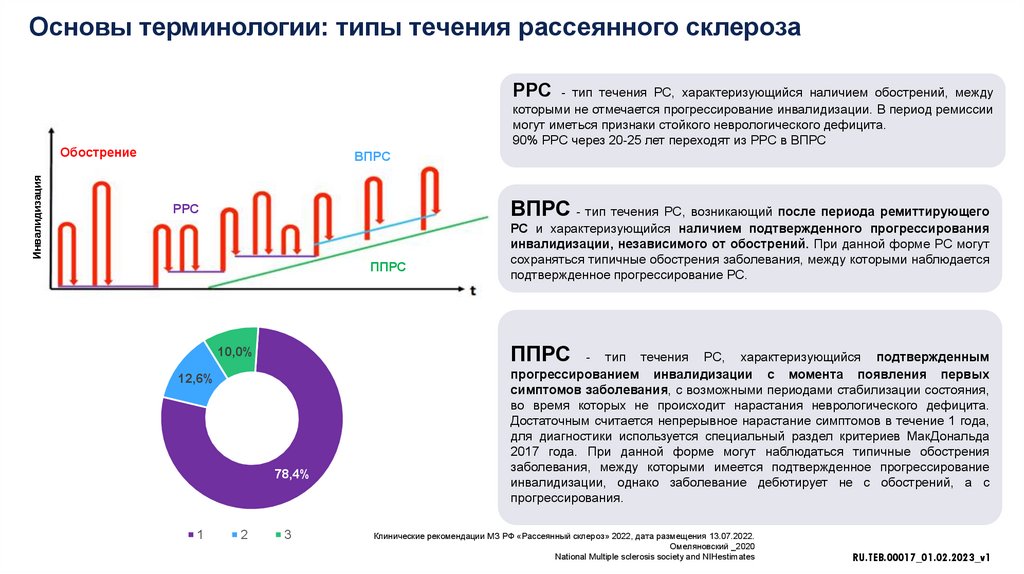
Основы терминологии: типы течения рассеянного склерозаРРС - тип течения РС, характеризующийся наличием обострений, между
которыми не отмечается прогрессирование инвалидизации. В период ремиссии
могут иметься признаки стойкого неврологического дефицита.
90% РРС через 20-25 лет переходят из РРС в ВПРС
Инвалидизация
Обострение
ВПРС
ВПРС - тип течения РС, возникающий после периода ремиттирующего
РРС
ППРС
ППРС
10,0%
12,6%
78,4%
1
2
РС и характеризующийся наличием подтвержденного прогрессирования
инвалидизации, независимого от обострений. При данной форме РС могут
сохраняться типичные обострения заболевания, между которыми наблюдается
подтвержденное прогрессирование РС.
3
- тип течения РС, характеризующийся подтвержденным
прогрессированием инвалидизации с момента появления первых
симптомов заболевания, с возможными периодами стабилизации состояния,
во время которых не происходит нарастания неврологического дефицита.
Достаточным считается непрерывное нарастание симптомов в течение 1 года,
для диагностики используется специальный раздел критериев МакДональда
2017 года. При данной форме могут наблюдаться типичные обострения
заболевания, между которыми имеется подтвержденное прогрессирование
инвалидизации, однако заболевание дебютирует не с обострений, а с
прогрессирования.
Клинические рекомендации МЗ РФ «Рассеянный склероз» 2022, дата размещения 13.07.2022.
Омеляновский _2020
National Multiple sclerosis society and NIHestimates
RU.TEB.00017_01.02.2023_v1
7.
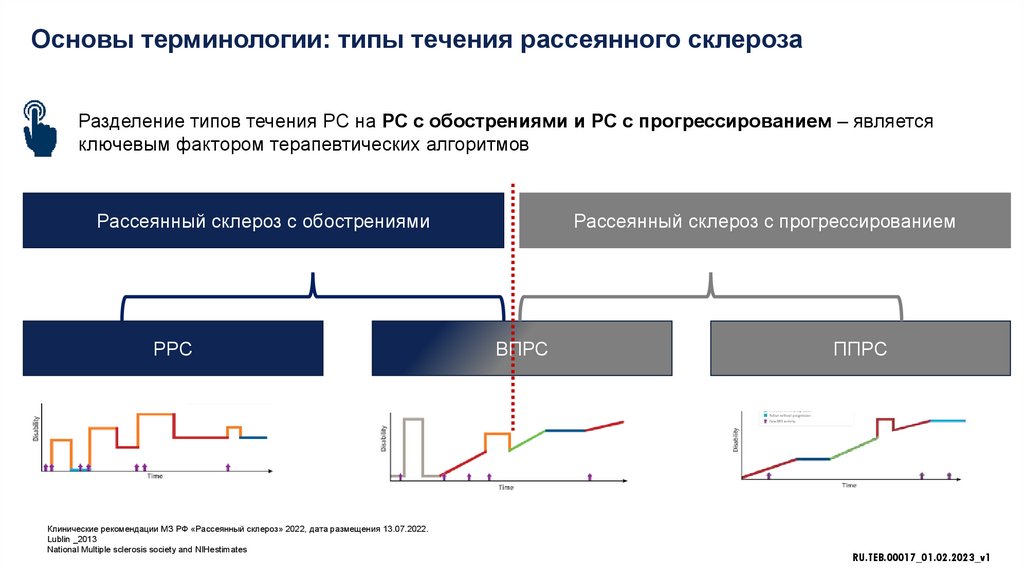
Основы терминологии: типы течения рассеянного склерозаРазделение типов течения РС на РС с обострениями и РС с прогрессированием – является
ключевым фактором терапевтических алгоритмов
Рассеянный склероз с обострениями
РРС
Клинические рекомендации МЗ РФ «Рассеянный склероз» 2022, дата размещения 13.07.2022.
Lublin _2013
National Multiple sclerosis society and NIHestimates
Рассеянный склероз с прогрессированием
ВПРС
ППРС
RU.TEB.00017_01.02.2023_v1
8.
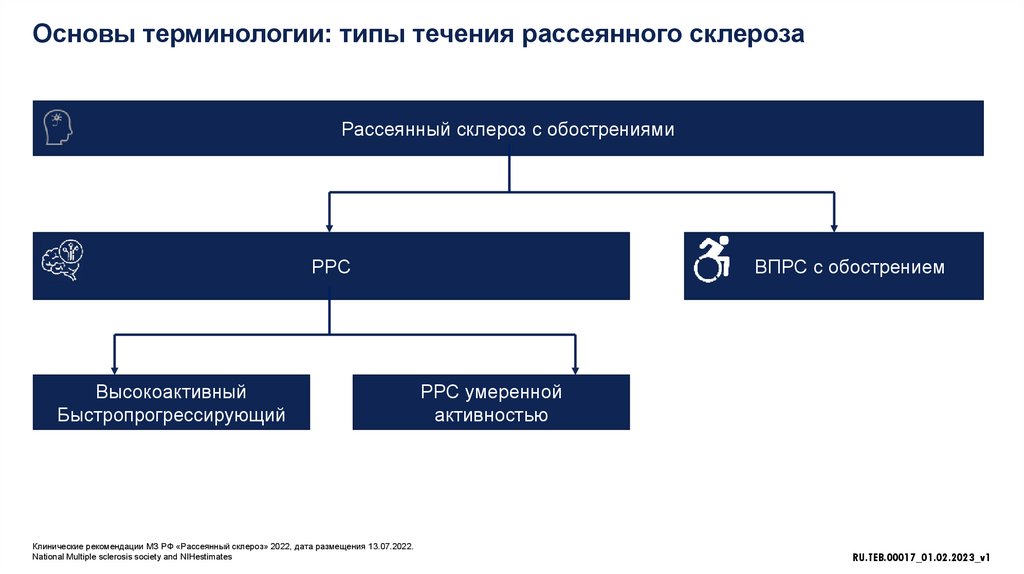
Основы терминологии: типы течения рассеянного склерозаРассеянный склероз с обострениями
РРС
Высокоактивный
Быстропрогрессирующий
Клинические рекомендации МЗ РФ «Рассеянный склероз» 2022, дата размещения 13.07.2022.
National Multiple sclerosis society and NIHestimates
ВПРС с обострением
РРС умеренной
активностью
RU.TEB.00017_01.02.2023_v1
9.
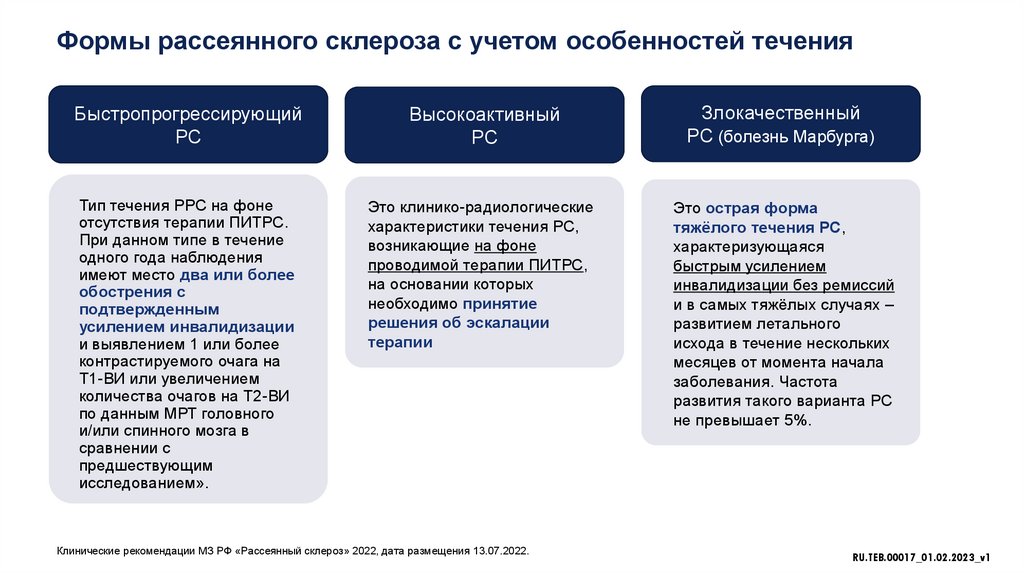
Формы рассеянного склероза с учетом особенностей теченияБыстропрогрессирующий
РС
Высокоактивный
РС
Злокачественный
РС (болезнь Марбурга)
Тип течения РРС на фоне
отсутствия терапии ПИТРС.
При данном типе в течение
одного года наблюдения
имеют место два или более
обострения с
подтвержденным
усилением инвалидизации
и выявлением 1 или более
контрастируемого очага на
Т1-ВИ или увеличением
количества очагов на Т2-ВИ
по данным МРТ головного
и/или спинного мозга в
сравнении с
предшествующим
исследованием».
Это клинико-радиологические
характеристики течения РС,
возникающие на фоне
проводимой терапии ПИТРС,
на основании которых
необходимо принятие
решения об эскалации
терапии
Это острая форма
тяжёлого течения РС,
характеризующаяся
быстрым усилением
инвалидизации без ремиссий
и в самых тяжёлых случаях –
развитием летального
исхода в течение нескольких
месяцев от момента начала
заболевания. Частота
развития такого варианта РС
не превышает 5%.
Клинические рекомендации МЗ РФ «Рассеянный склероз» 2022, дата размещения 13.07.2022.
RU.TEB.00017_01.02.2023_v1
10.
Принципы назначения ПИТРС – препаратов, изменяющих течениерассеянного склероза
•в соответствии с типом течения РС
с уровнем инвалидизации по EDSS
с учетом возраста пациента
с учетом показаний, противопоказаний, потенциальных НЛР, сопутствующих заболеваний при
длительной терапии
раннее начало терапии
Клинические рекомендации МЗ РФ «Рассеянный склероз» 2022, дата размещения 13.07.2022.
RU.TEB.00017_01.02.2023_v1
11.
Варианты ответа на терапию ПИТРСОптимальный ответ на терапию (нет данных за активность заболевания, НДАЗ):
• отсутствие обострений,
• отсутствие прогрессирования неврологического дефицита в течение периода наблюдения,
• отсутствие активности по данным МРТ.
Субоптимальный ответ на терапию - это клинико-радиологические характеристики
течения РС и лабораторные показатели на фоне проводимой терапии, на основании
которых необходимо принятие решения о смене терапии на препарат с иным механизмом
действия в рамках той же линии ПИТРС.
Резистентность к терапии – это клинико-радиологические характеристики течения РС,
возникающие на фоне проводимой терапии, на основании которых необходимо принятие
решения об эскалации терапии.
Клинические рекомендации МЗ РФ «Рассеянный склероз» 2022, дата размещения 13.07.2022.
RU.TEB.00017_01.02.2023_v1
12.
Место анти-В-клеточной терапии в клинических рекомендацияхРекомендуется пациентам (с 18 лет) с
быстропрогрессирующим РРС или с высокоактивным РРС
с целью предотвращения обострений и радиологической
активности заболевания по данным МРТ головного/спинного
мозга и инвалидизации, вызванной данными событиями
Рекомендуется пациентам с ВПРС с обострениями и уровнем
EDSS≤ 6,5 баллов (с 18 лет) с целью предотвращения обострений
и радиологической активности заболевания по данным МРТ
головного/спинного мозга и инвалидизации, вызванной данными
событиями
Рекомендуется пациентам с ППРС с 18 лет с уровнем EDSS
≤6,5 баллов с целью предотвращения прогрессирования РС
Рассеянный склероз. Проект клинических рекомендаций. 2022
RU.DIVO.00015_17.02.2023_v2
13.
Регистрация препарата ИВЛИЗИ® (дивозилимаб)Показание к применению:
Препарат
ИВЛИЗИ
применяется
у
взрослых
пациентов старше 18 лет для лечения рассеянного
РУ от
24.04.23
склероза
с
обострениями,
который
включает
ремиттирующий рассеянный склероз и вторично-
прогрессирующий
обострениями,
рассеянный
с
склероз
признаками
с
активности
заболевания по данным клинического обследования
или
данным
визуализирующих
методов
обследования
Противопоказания:
Гиперчувствительность к дивозилимабу и/или к
любому из вспомогательных веществ
Жизнеугрожающие инфузионные реакции в
анамнезе
Инфекционные заболевания в активной фазе
Иммуносупрессия
Злокачественные новообразования
Детский возраст до 18 лет
Беременность и период грудного вскармливания
РУ – регистрационное удостоверение
1. Листок-вкладыш лекарственного препарата ТЕНЕКСИА®
2. Общая характеристика лекарственного препарата ТЕНЕКСИА®
14.
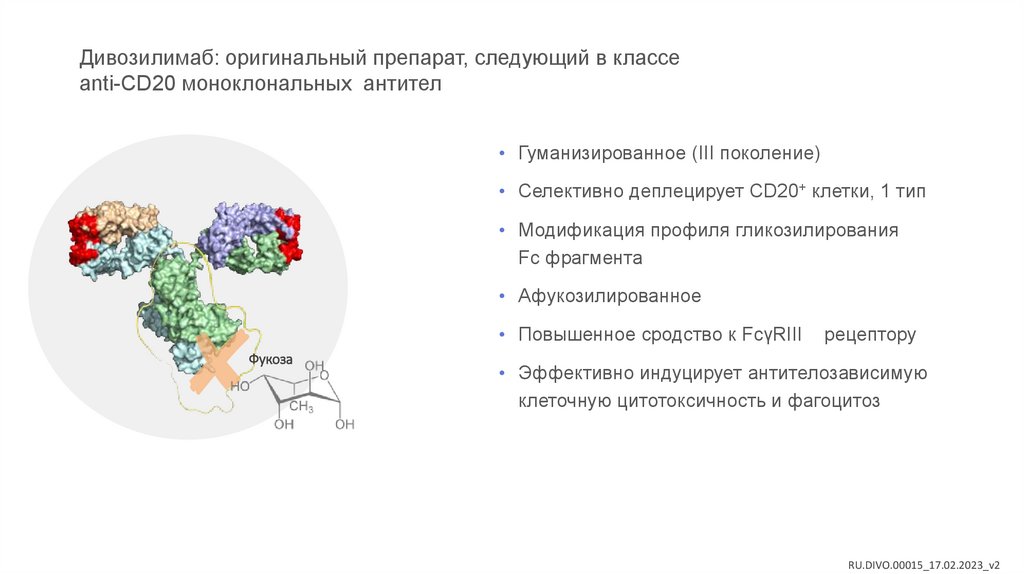
Дивозилимаб: оригинальный препарат, следующий в классеanti-CD20 моноклональных антител
• Гуманизированное (III поколение)
• Селективно деплецирует CD20+ клетки, 1 тип
• Модификация профиля гликозилирования
Fc фрагмента
• Афукозилированное
• Повышенное сродство к FcγRIII
Фукоза
рецептору
• Эффективно индуцирует антителозависимую
клеточную цитотоксичность и фагоцитоз
RU.DIVO.00015_17.02.2023_v2
15.
ИВЛИЗИ® (дивозилимаб) 3 фаза: дизайн исследованияМногоцентровое рандомизированное двойное слепое, двойное маскированное клиническое исследование (КИ) 3
фазы
338 пациентов с РCО
26 клинических центров
РРС
ВПРС с обострениями
Общая продолжительность терапии - 2 года
Оценка ПКТ – 1 год терапии
2 цикла терапии МАТ
Терифлуномид
14 мг per os
Дивозилимаб 500 мг
в/в кап
Ввиду различий в путях введения исследуемых препаратов, с целью маскирования все субъекты в группе ДИВ ежедневного получали препарат плацебо (ПБО) в
таблетированной форме. Субъектам группы ТРФ выполнялись внутривенные инфузии ПБО с частотой и режимом дозирования, аналогичными таковым в группе
исследуемого препарата ДИВ.
Бойко АН и др. Эффективность и безопасность 48 недель применения дивозилимаба (моноклонального антитела против CD20) среди пациентов с рассеянным склерозом в рамках рандомизированного двойного слепого плацебо-контролируемого
клинического исследования BCD-132-4. Журнал неврологии и психиатрии им. С.С. Корсакова. 2023 ( в печати)
16.
ИВЛИЗИ® (дивозилимаб) 3 фаза: дизайн исследованияПервичная конечная точка
эффективности через 48 недель
Среднегодовая частота
обострений
МРТ
Дополнительные конечные точки
эффективности
EDSS
Timed 25-Foot walk
9-HPT
SDMT
CUA (combined unique active)*
Доля пациентов без очагов, накапливающих контраст;
Количество новых или увеличившихся очагов в Т2-режиме;
Доля пациентов без новых или увеличившихся очагов в Т2- режиме;
Изменение объема очагов в Т2-режиме;
Изменение объема гипоинтенсивных очагов в Т1-режиме.
Изменение объема ГМ
Клиническая картина
Неврологический статус
ARR (СЧО – среднегодовая частота обострений)
Доля пациентов без подтвержденных обострений
Время до развития первого обострения
Оценка безопасности
НЯ
СНЯ 3-4 степени
Досрочное
прекращение в связи с
НЯ
CUA (combined unique active)* - совокупное количество новых накапливающих контраст очагов на МРТ в T1-режиме и новых очагов в T2-режиме или случаев увеличения очагов в T2- режиме, без двойного сложения
EDSS - Расширенная шкала инвалидизации
Timed 25-Foot walk - Тест оценки времени прохождения 7,62 метра (25 футов)
9 НРТ- Тест с 9-ю отверстиями и стержнями
SDMT - Символьно-цифровой тест
Бойко АН и др. Эффективность и безопасность 48 недель применения дивозилимаба (моноклонального антитела против CD20) среди пациентов с рассеянным склерозом в рамках рандомизированного двойного слепого плацебо-контролируемого клинического
исследования BCD-132-4. Журнал неврологии и психиатрии им. С.С. Корсакова. 2023 ( в печати)
17.
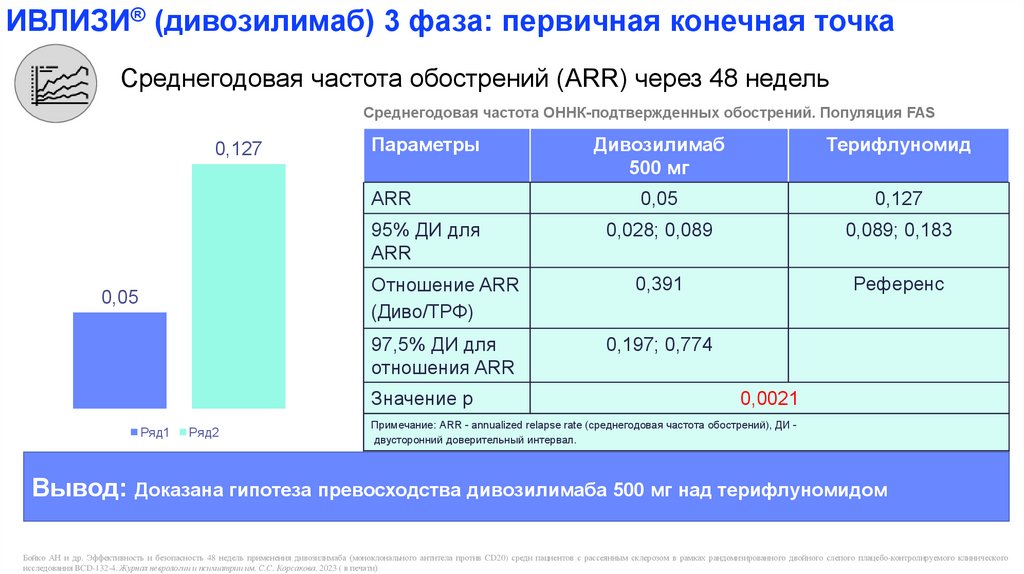
ИВЛИЗИ® (дивозилимаб) 3 фаза: первичная конечная точкаСреднегодовая частота обострений (ARR) через 48 недель
Среднегодовая частота ОННК-подтвержденных обострений. Популяция FAS
0,127
Параметры
Дивозилимаб
Терифлуномид
500 мг
Среднегодовая частота ОННК-подтвержденных обострений. Популяция FAS
ARR
0,05
0,127
0,028; 0,089
0,089; 0,183
Отношение ARR
(Диво/ТРФ)
0,391
Референс
97,5% ДИ для
отношения ARR
0,197; 0,774
95% ДИ для
ARR
0,05
Значение р
Ряд1
Ряд2
0,0021
Примечание: ARR - annualized relapse rate (среднегодовая частота обострений), ДИ двусторонний доверительный интервал.
Вывод: Доказана гипотеза превосходства дивозилимаба 500 мг над терифлуномидом
Бойко АН и др. Эффективность и безопасность 48 недель применения дивозилимаба (моноклонального антитела против CD20) среди пациентов с рассеянным склерозом в рамках рандомизированного двойного слепого плацебо-контролируемого клинического
исследования BCD-132-4. Журнал неврологии и психиатрии им. С.С. Корсакова. 2023 ( в печати)
18.
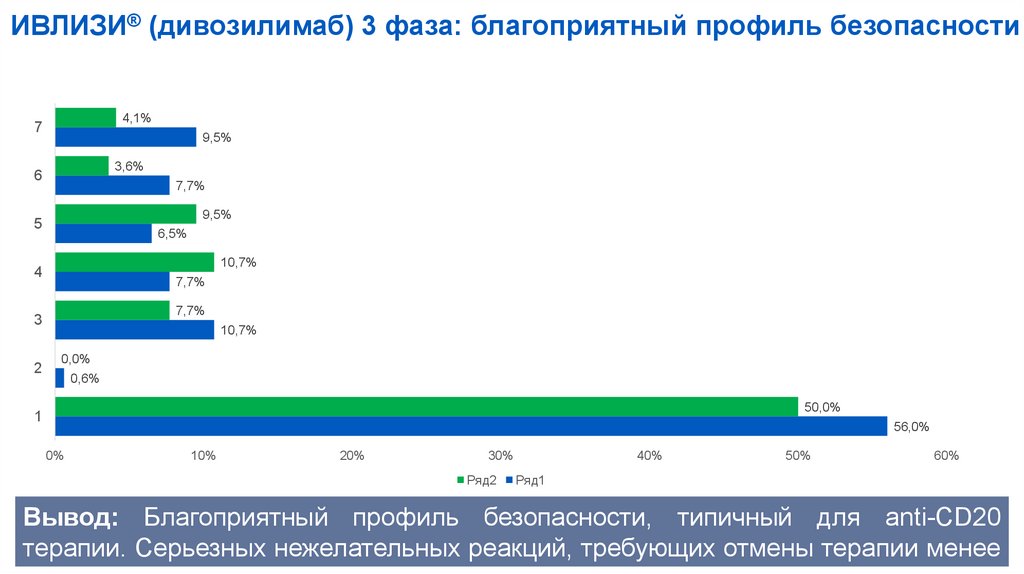
ИВЛИЗИ® (дивозилимаб) 3 фаза: благоприятный профиль безопасности4,1%
7
9,5%
3,6%
6
7,7%
9,5%
5
6,5%
10,7%
4
7,7%
7,7%
3
2
10,7%
0,0%
0,6%
50,0%
1
56,0%
0%
10%
20%
30%
Ряд2
40%
50%
60%
Ряд1
Вывод: Благоприятный профиль безопасности, типичный для anti-СD20
терапии. Серьезных нежелательных реакций, требующих отмены терапии менее
19.
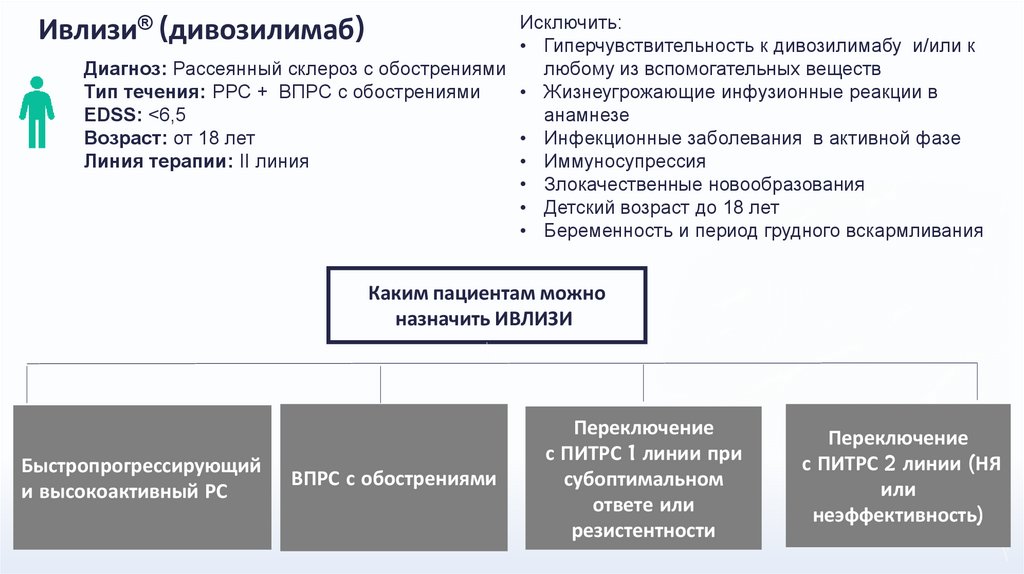
Ивлизи® (дивозилимаб)Исключить:
• Гиперчувствительность к дивозилимабу и/или к
любому из вспомогательных веществ
Диагноз: Рассеянный склероз c обострениями
• Жизнеугрожающие инфузионные реакции в
Тип течения: РРС + ВПРС с обострениями
анамнезе
EDSS: <6,5
• Инфекционные заболевания в активной фазе
Возраст: от 18 лет
• Иммуносупрессия
Линия терапии: II линия
• Злокачественные новообразования
• Детский возраст до 18 лет
• Беременность и период грудного вскармливания
Каким пациентам можно
назначить ИВЛИЗИ®
Быстропрогрессирующий
и высокоактивный РС
ВПРС с обострениями
Переключение
с ПИТРС 1 линии при
субоптимальном
ответе или
резистентности
Переключение
с ПИТРС 2 линии (НЯ
или
неэффективность)
20.
Регистрация препарата ТЕНЕКСИА® (сампэгинтерферон бета-1а)РУ от
13.04.23
Показание к применению:
препарат
показан
для
лечения
взрослых
пациентов старше 18 лет с ремиттирующим
рассеянным склерозом.
Противопоказания:
• повышенная чувствительность к природному
или рекомбинантному интерферону бета и/или
к любому из вспомогательных веществ
• тяжелые
депрессивные
нарушения
и/или
суицидальные мысли на текущий момент
• детский возраст до 18 лет
• беременность
вскармливания
РУ – регистрационное удостоверение
1. Листок-вкладыш лекарственного препарата ТЕНЕКСИА®
2. Общая характеристика лекарственного препарата ТЕНЕКСИА®
и
период
грудного
21.
СамПЭГ-ИФНβ1а (сампегинтерферон – бета- 1а)NEXT in
class
Bio-better
Оригинальный, следующий в классе пегилированный интерферон для внутримышечного введения
Конъюгация с молекулой ПЭГ большей
молекулярной массой 30 кДа.
Увеличение молекулярной массы ПЭГ
приводит к улучшению фармакокинетических
характеристик препарата:
Снижает почечный клиренс
Увеличивает период полувыведения,
Увеличивает продолжительность действия
интерферона на организм
Внутримышечный путь введения
Поддержание устойчивых
высоких плазменных
концентраций
Более редкий режим
дозирования
1 раз в 14 дней
Меньшее число
местных НЯ
Бойко А.Н., Бахтиярова К.З., Дудин В.А., Заславский Л.Г., Малкова Н.А., Паршина Е.В., Федулов А.С., Зинкина-Орихан А.В., Линькова Ю.Н., Иванов Р.А., Черновская Т.В. Новый пегилированный интерферон бета-1а (сампэгинтерферон бета-1а, BCD-054
тераRU.SB.1.00016_01.02.2023_v1
22.
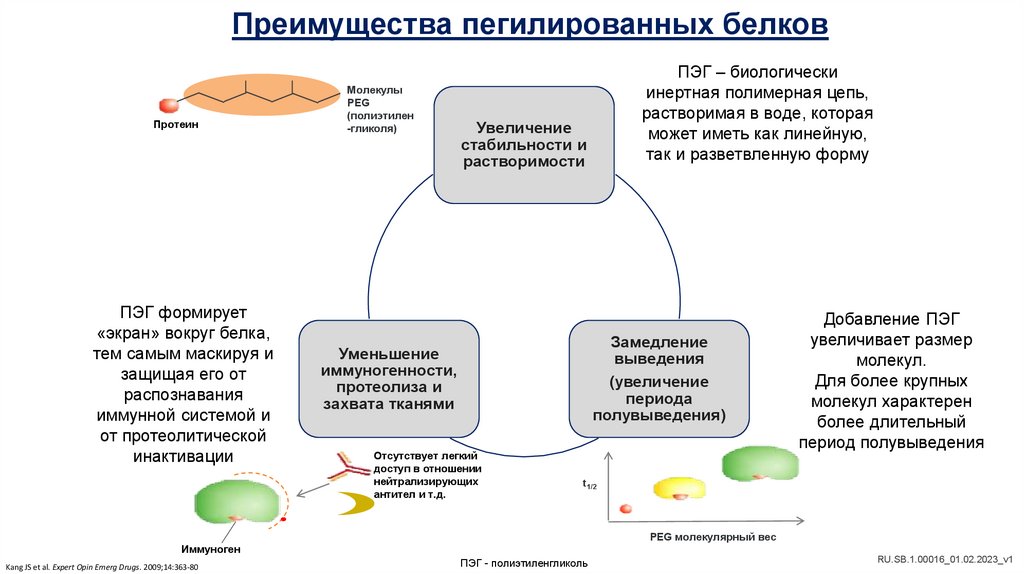
Преимущества пегилированных белковПротеин
ПЭГ формирует
«экран» вокруг белка,
тем самым маскируя и
защищая его от
распознавания
иммунной системой и
от протеолитической
инактивации
Молекулы
PEG
(полиэтилен
-гликоля)
ПЭГ – биологически
инертная полимерная цепь,
растворимая в воде, которая
может иметь как линейную,
так и разветвленную форму
Увеличение
стабильности и
растворимости
Замедление
выведения
(увеличение
периода
полувыведения)
Уменьшение
иммуногенности,
протеолиза и
захвата тканями
Отсутствует легкий
доступ в отношении
нейтрализирующих
антител и т.д.
Добавление ПЭГ
увеличивает размер
молекул.
Для более крупных
молекул характерен
более длительный
период полувыведения
t1/2
PEG молекулярный вес
Иммуноген
Kang JS et al. Expert Opin Emerg Drugs. 2009;14:363-80
ПЭГ - полиэтиленгликоль
RU.SB.1.00016_01.02.2023_v1
23.
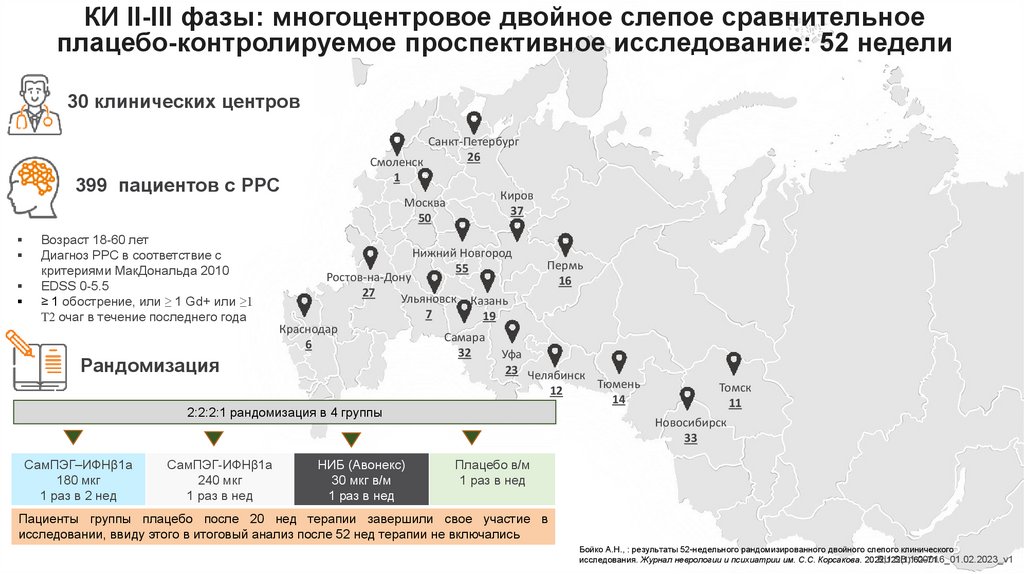
КИ II-III фазы: многоцентровое двойное слепое сравнительноеплацебо-контролируемое проспективное исследование: 52 недели
30 клинических центров
Санкт-Петербург
26
Смоленск
1
399 пациентов с РРС
Киров
37
Москва
50
Возраст 18-60 лет
Диагноз РРС в соответствие с
критериями МакДональда 2010
EDSS 0-5.5
≥ 1 обострение, или ≥ 1 Gd+ или ≥1
T2 очаг в течение последнего года
Нижний Новгород
55
Ростов-на-Дону
27
Ульяновск
7
Краснодар
6
Рандомизация
Пермь
16
Казань
19
Самара
32
Уфа
23 Челябинск
12
2:2:2:1 рандомизация в 4 группы
СамПЭГ–ИФНβ1а
180 мкг
1 раз в 2 нед
СамПЭГ-ИФНβ1а
240 мкг
1 раз в нед
НИБ (Авонекс)
30 мкг в/м
1 раз в нед
Тюмень
14
Томск
11
Новосибирск
33
Плацебо в/м
1 раз в нед
Пациенты группы плацебо после 20 нед терапии завершили свое участие в
исследовании, ввиду этого в итоговый анализ после 52 нед терапии не включались
Бойко А.Н., : результаты 52-недельного рандомизированного двойного слепого клинического
исследования. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022;122(1):62–71.
RU.SB.1.00016_01.02.2023_v1
24.
КИ II-III фазы: многоцентровое двойное слепое сравнительноеплацебо-контролируемое проспективное исследование: 52 недели
Первичная конечная точка эффективности
TTF (time to the first relapse) –
время до первого обострения
Вторичные конечные точки эффективности
CUA (combined unique active)*
Доля пациентов без очагов, накапливающих контраст;
Количество новых или увеличившихся очагов в Т2-режиме;
Доля пациентов без новых или увеличившихся очагов в Т2- режиме;
Изменение объема очагов в Т2-режиме;
Изменение объема гипоинтенсивных очагов в Т1-режиме.
ARR (СЧО – среднегодовая частота обострений)
Доля пациентов без подтвержденных обострений
Неврологический статус
EDSS
Timed 25-Foot walk
9-HPT
SDMT
Оценка безопасности
НЯ
СНЯ 3-4 степени
Досрочное
прекращение в связи с
НЯ
CUA (combined unique active)* - совокупное количество новых накапливающих контраст очагов на МРТ в T1-режиме и новых очагов в T2-режиме или случаев увеличения очагов в T2- режиме, без двойного сложения
EDSS - Расширенная шкала инвалидизации
Timed 25-Foot walk - Тест оценки времени прохождения 7,62 метра (25 футов)
9 НРТ- Тест с 9-ю отверстиями и стержнями
SDMT - Символьно-цифровой тест
Препарат не зарегистрирован на территории РФ
Бойко А.Н., : результаты 52-недельного рандомизированного двойного слепого клинического исследования. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022;122(1):62–71.
RU.SB.1.00016_01.02.2023_v1
25.
Первичная конечная точка эффективности:TTF (time to the first relapse) – время до развития первого обострения (52 недели)
Популяция mITT
Группа СамПЭГ–ИФНβ1а
Группа СамПЭГ–ИФНβ1а
180 мкг (113 пациентов)
240 мкг (114 пациентов)
vs
vs
Группа НИБ -Авонекс (113 пациентов)
Отношение рисков (95% ДИ)
0,539 (0,297; 0,977)
Группа НИБ -Авонекс (113 пациентов)
Отношение рисков (95% ДИ)
0,39 (0,203; 0,748)
Гипотеза неменьшей эффективности
Неменьшая эффективность доказана
Гипотеза превосходства
Превосходство доказано
Результат
Неменьшая эффективность доказана
Результат
Превосходство не доказано
Выявленные статистически значимые различия по показателю «Время до развития первого обострения»
между исследуемым препаратом СамПЭГ–ИФНβ1а и препаратом сравнения свидетельствуют о большей
эффективности исследуемого препарата. Дополнительная проверка гипотезы превосходства для каждой
из дозовых групп самПЭГ-ИФН-β1a, проведенная в соответствии с руководством EMEA,
продемонстрировала достоверное превосходство самПЭГ-ИФН-β1a в дозе 240 мкг над препаратом НИБ
(Авонекс) по оцениваемой первичной конечной точке.
Бойко А.Н., : результаты 52-недельного рандомизированного двойного слепого клинического исследования. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022;122(1):62–71.
RU.SB.1.00016_01.02.2023_v1
26.
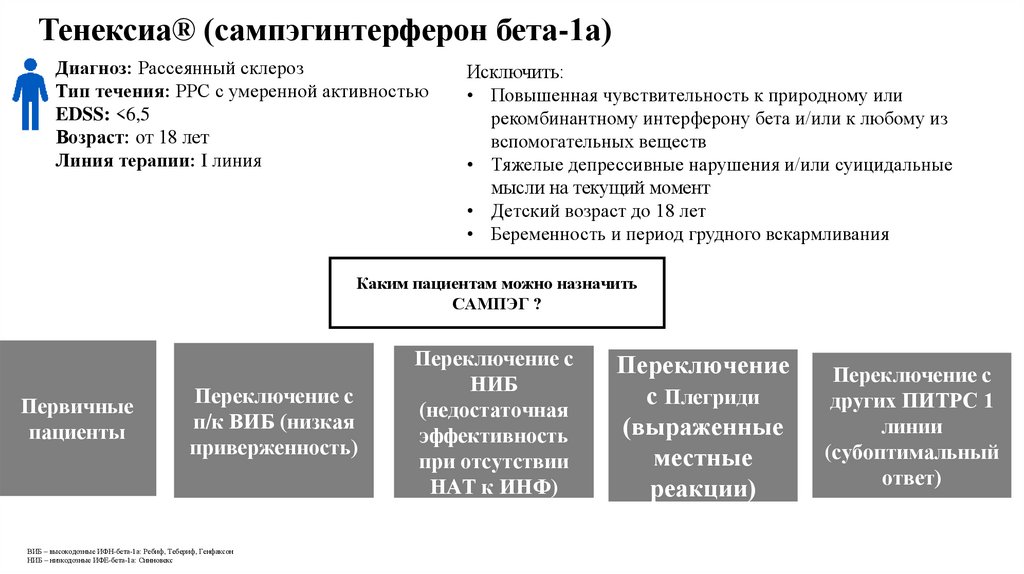
Тенексиа® (сампэгинтерферон бета-1а)Диагноз: Рассеянный склероз
Тип течения: РРС с умеренной активностью
EDSS: <6,5
Возраст: от 18 лет
Линия терапии: I линия
Исключить:
• Повышенная чувствительность к природному или
рекомбинантному интерферону бета и/или к любому из
вспомогательных веществ
• Тяжелые депрессивные нарушения и/или суицидальные
мысли на текущий момент
• Детский возраст до 18 лет
• Беременность и период грудного вскармливания
Каким пациентам можно назначить
САМПЭГ ?
Первичные
пациенты
Переключение с
п/к ВИБ (низкая
приверженность)
ВИБ – высокодозные ИФН-бета-1а: Ребиф, Тебериф, Генфаксон
НИБ – низкодозные ИФЕ-бета-1а: Синновекс
Переключение с
НИБ
(недостаточная
эффективность
при отсутствии
НАТ к ИНФ)
Переключение
с Плегриди
(выраженные
местные
реакции)
Переключение с
других ПИТРС 1
линии
(субоптимальный
ответ)
27.
Спасибоза внимание!
RU.DIVO.00015_17.02.2023_v2















 medicine
medicine








