Similar presentations:
Основные сведения о строении атома
1. « Основные сведения о строении атома».
2. Выполни задание.
• Запишите формулы веществ, укажите, какое из этихвеществ является простым, а какое сложным ,
вычислите относительные молекулярные массы,
если известно, что в состав молекулы входят:
1 вариант
2 атома фосфора и
5 атомов
кислорода
2 атома водорода
2 вариант
3 вариант
4 вариант
2 атома натрия и 1 1 атом водорода, 1 2 атома водорода,
атом кислорода
атом азота, 3
1 атом кремния, 3
атома кислорода
атома кислорода
2 атома азота
2 атома кислорода
. 2 атома хлора
3. Вставьте пропущенные слова
Физическое телоАтом
Атом
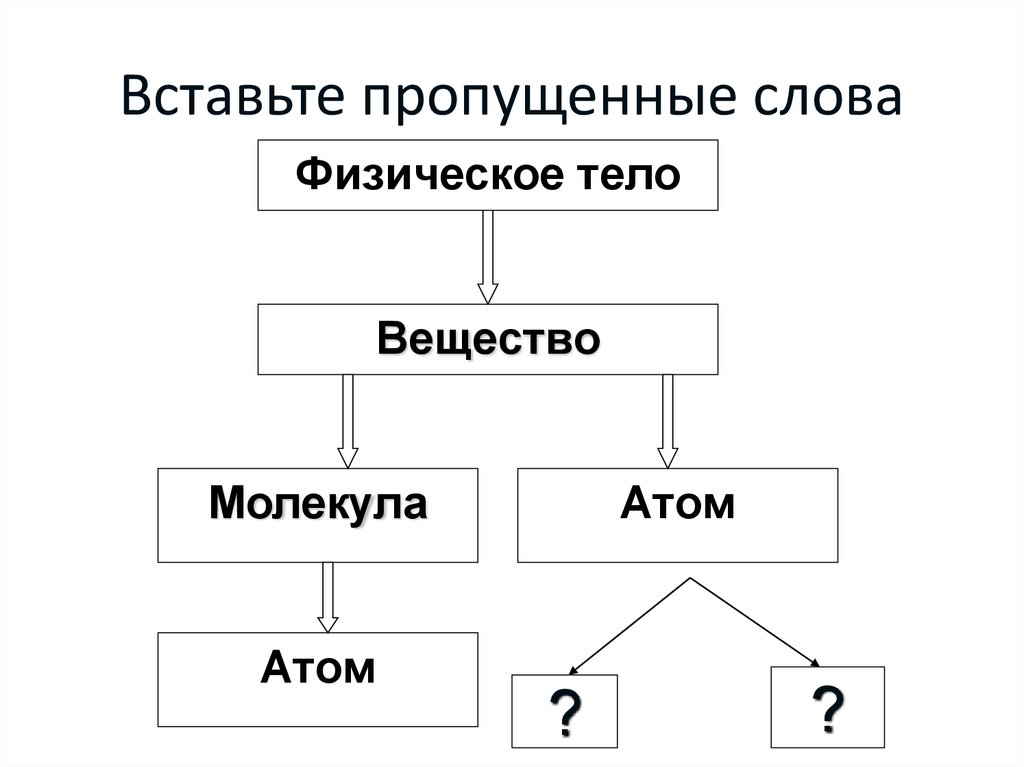
4. Вставьте пропущенные слова
Физическое телоВещество
Молекула
Атом
Атом
?
?
5. Джозеф Томсон, Жан Перрен. Открытие катодных лучей ( потока электронов).
• электроны – этоотрицательно
заряженные частицы;
• Заряд электрона = -1;
• Масса равна 1/1840 массы
атома водорода;
• Скорость движения –
300000 км/с.
6. Антуан Анри Беккерель. Открытие явления радиоактивности.
Различают 3 видарадиоактивных лучей:
1.α– лучи, состоящие из альфа
частиц с зарядом + 2 и
массой 4;
2. β – лучи – поток электронов;
3. y- лучи- электромагнитные
волны
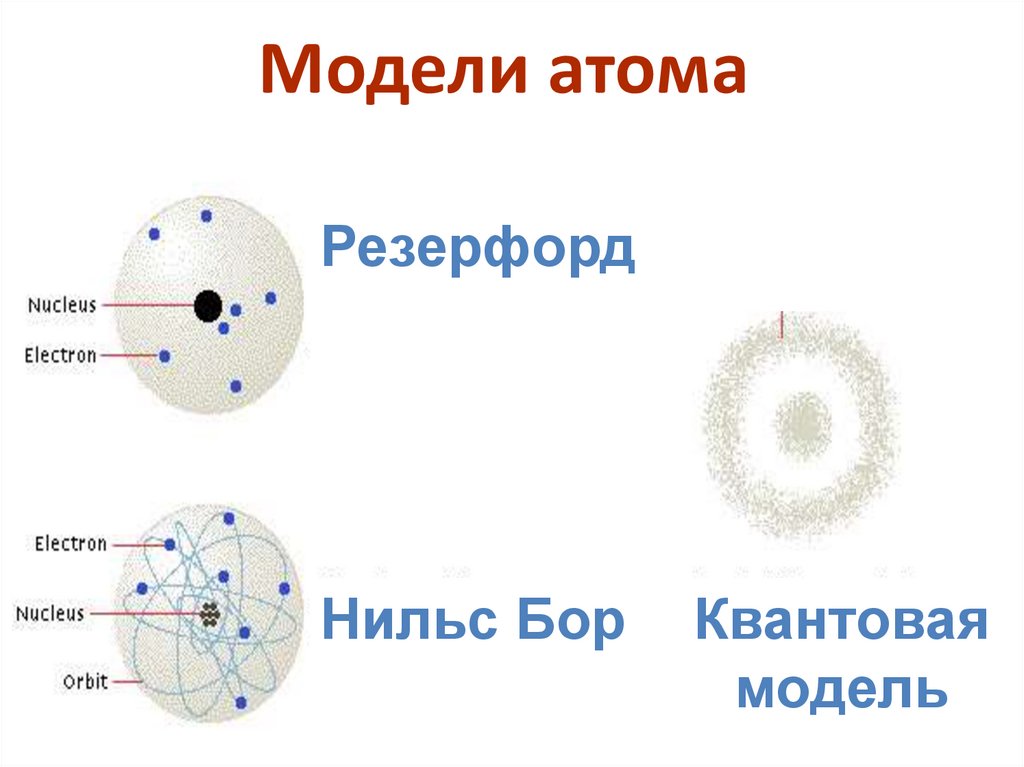
7. Модели атома
РезерфордНильс Бор
Квантовая
модель
8. 1903г. Джозеф Томсон предложил одну из первых модель строения атома.
Атом – шар, по всему.
объёму которого
равномерно
распределён
положительный заряд.
Внутри шара
находятся электроны.
9. Модель атома Томсона
Каждый электронможет совершать
колебательные
движения около
своего положения
равновесия.
Положительный заряд
шара равен по модулю
суммарному заряду
электронов, поэтому
заряд атома в целом
равен нулю.
10.
Модель Томсона нуждалась вэкспериментальной проверке.
Важно было проверить,
действительно ли положительный
заряд распределён по всему
объёму атома с постоянной
плотностью.
11. Идея опыта Резерфорда
• Зондировать атом альфа–частицами.• Альфа-частицы возникают при распаде радия.
• Масса альфа-частицы в 8000 раз больше массы
электрона.
• Электрический заряд альфа-частицы в 2 раза
больше заряда электрона.
• Скорость альфа-частицы около 15 000 км/с.
• Альфа-частицы является ядром атома гелия.
12. Схема экспериментальной установки Резерфорда. Вся установка помещается в вакуум.
13. В ходе эксперимента обнаружили:
• В отсутствии фольги – на экране появлялсясветлый кружок напротив канала с
радиоактивным веществом.
• 2. Когда на пути пучка альфа-частиц поместили
фольгу, площадь пятна на экране увеличилась.
• 3. Помещая экран сверху и снизу установки,
Резерфорд обнаружил, что небольшое число
альфа-частиц отклонилось на углы около 900.
• 4. Единичные частицы были отброшены назад.
14. Процесс прохождения альфа-частиц сквозь атомы фольги в опыте Резерфорда с точки зрения ядерной модели
На этом рисунке показано, какменяется траектория полёта
альфа-частиц в зависимости
от расстояния от ядра атома.
15. Выводы из опыта по рассеиванию альфа-частиц Резерфорда:
Выводы из опыта по рассеиванию альфачастиц Резерфорда:1. Существует атомное ядро,
т.е. тело малых размеров, в
котором сконцентрирована
почти вся масса атома и весь
положительный заряд.
2. В ядре сконцентрирована
почти вся масса атома.
3. Вокруг ядра по замкнутым
орбитам вращаются
отрицательные частицыэлектроны.
4. отрицательный заряд всех
электронов распределён по
всему объёму атома.
16. Выводы
Направление полетаα-частиц зависит от
того, на каком
расстоянии от ядра
они пролетают. Оно
сильно меняется
только в том случае,
если частица
проходит очень
близко к ядру.
17.
Исходя из этих соображений, Резерфордпредложил ядерную (планетарную) модель
атома, и сумел оценить размеры атомных ядер.
В зависимости от массы атома его ядро имеет
диаметр порядка:
10
14
10
15
м
т.е. оно в десятки
или даже в сотни
тысяч раз меньше
атома.
18. Выводы
Т.о., в результате опытов по рассеянию αчастиц была доказана несостоятельностьмодели атома Томсона, выдвинута ядерная
модель строения атома и определен порядок
диаметров атомных ядер.
19. Недостаток планетарной модели атома:
Нельзя объяснить фактсуществования атома;
• Нельзя объяснить устойчивость
атома.
20. Атом
Ядронуклоны
Протоны – p+
Электронная
оболочка
Электроны – е
Нейтроны – n0
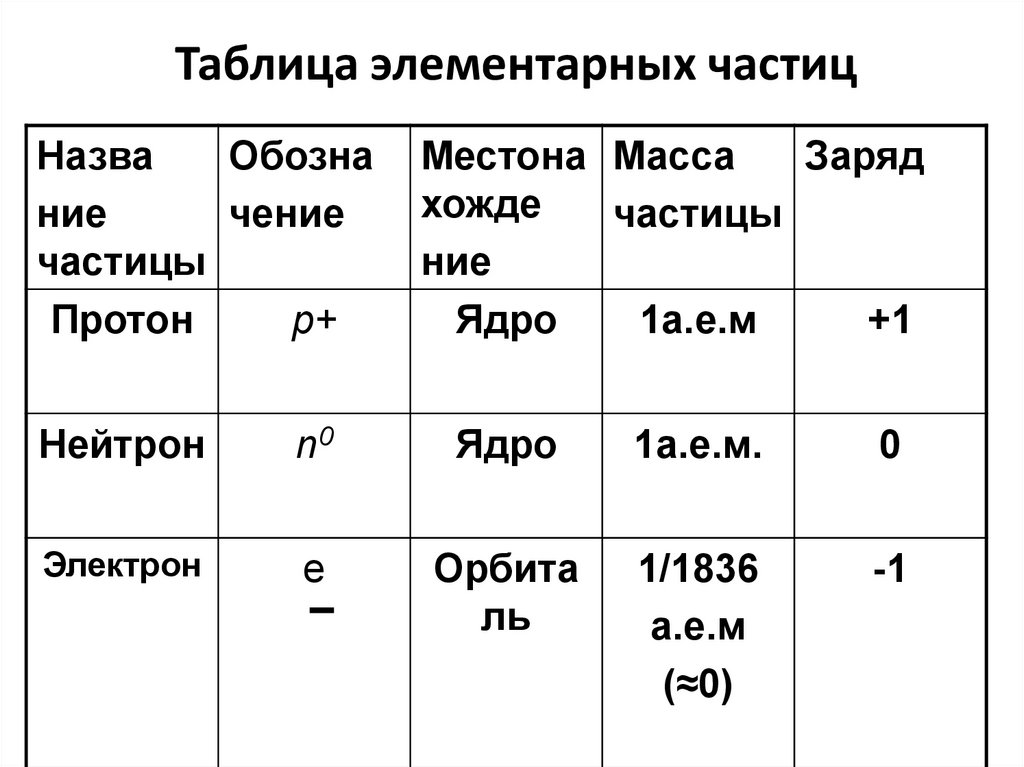
21. Таблица элементарных частиц
НазваОбозна
ние
чение
частицы
Протон
р+
Местона Масса
Заряд
хожде
частицы
ние
Ядро
1а.е.м
+1
Нейтрон
n0
Ядро
1а.е.м.
0
Электрон
е
Орбита
ль
1/1836
а.е.м
(≈0)
-1
22.
Z – порядковый номер химического элемента
М – массовое число, М =Ar
N – число нейтронов
Z – указывает на заряд ядра, а следовательно на число
протонов, а так как атом нейтрален, то число
протонов равно числу электронов.
М – сумма протонов и нейтронов в ядре атома
М=Z+N
1) Z = заряд ядра (+), число электронов и
протонов;
2) N= М- Z или n0= Ar- Z
23.
––
–
–
–
–
Атом – это микрочастица, которая имеет форму шара.
Атом – это сложная система, состоящая из ядра и
электронов.
Ядро находится в центре атома и имеет очень
маленький размер, но почти вся масса сосредоточена в
ядре.
Ядро имеет положительный заряд, величина которого
определяется числом протонов в нём.
Электроны движутся вокруг ядра, имеют ничтожно
малую массу и размеры, обладают отрицательным
зарядом.
Атом электронейтрален, поэтому число протонов и
нейтронов в атоме одинаково.
24.
АтомЭлектронная
оболочка
Ядро
Протон Нейтрон Электрон
=Z
=Ar-Z
=Z
m=1
m=1
m 0
g=+1
g=0
g=-1
25. Заполни таблицу
ЭлементыЧисло
протонов и
электронов
p+, eЧисло
нейтронов
n0
K
Ca
S
Mn
Si
Al
26. Заполни таблицу
ЭлементыK
Ca
S
Mn
Si
Al
Число
протонов и
электронов
p+, eЧисло
нейтронов
n0
19
20
16
25
14
13
20
20
16
30
14
14
27.
Спасибо заурок!
























 physics
physics








