Similar presentations:
Сущность и значение фотосинтеза. Пигментные системы фотосинтетического аппарата
1. Сущность и значение фотосинтеза Пигментные системы фотосинтетического аппарата
Лекция 3Сущность и значение
фотосинтеза
Пигментные системы
фотосинтетического
аппарата
2. Вопросы
1. Основные стадии фотосинтеза.2. Структурная организация
фотосинтетического аппарата.
3. Хлорофиллы, их строение, химические,
физические свойства и функции.
4. Биосинтез хлорофилла.
5. Каротиноиды, билихромопротеины
(фикобилины), их строение, классификация и
функции.
6. Электронно-возбужденное состояние
пигментов и типы дезактивации
возбужденных состояний.
3.
Фотосинтезпроцесс создания
органических веществ из
неорганических с помощью
световой энергии
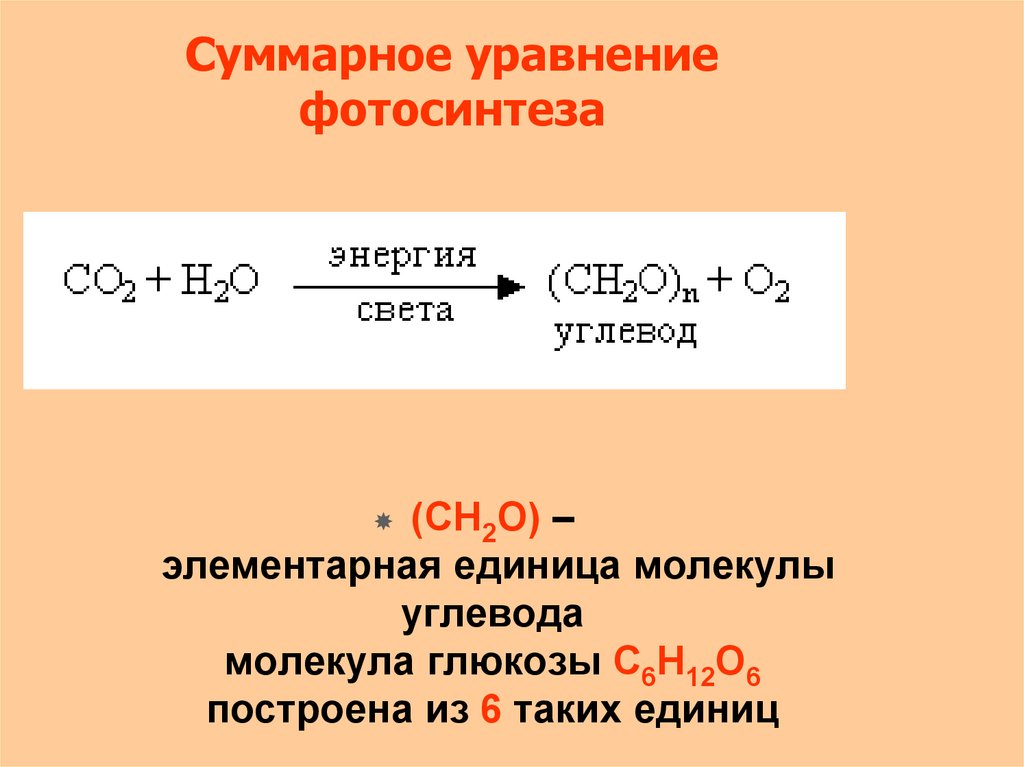
4. Суммарное уравнение фотосинтеза
(СН2О) –элементарная единица молекулы
углевода
молекула глюкозы С6Н12О6
построена из 6 таких единиц
5. Откуда берется выделяемый при фотосинтезе О2: из СО2 или Н2О?
энергияСО2 + 2Н218О
света
(СН2О) + 18О2 + Н2О
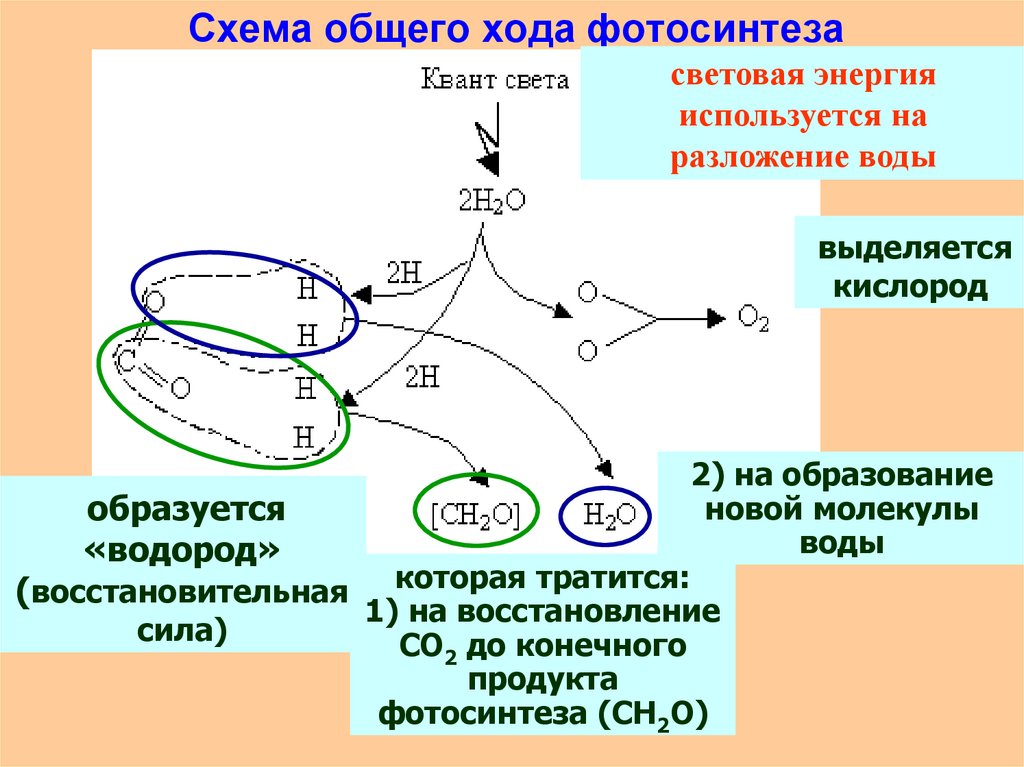
6. которая тратится: 1) на восстановление СО2 до конечного продукта фотосинтеза (СН2О)
Схема общего хода фотосинтезасветовая энергия
используется на
разложение воды
выделяется
кислород
2) на образование
новой молекулы
образуется
воды
«водород»
(восстановительная которая тратится:
1) на восстановление
сила)
СО2 до конечного
продукта
фотосинтеза (СН2О)
7. Основные стадии фотосинтеза
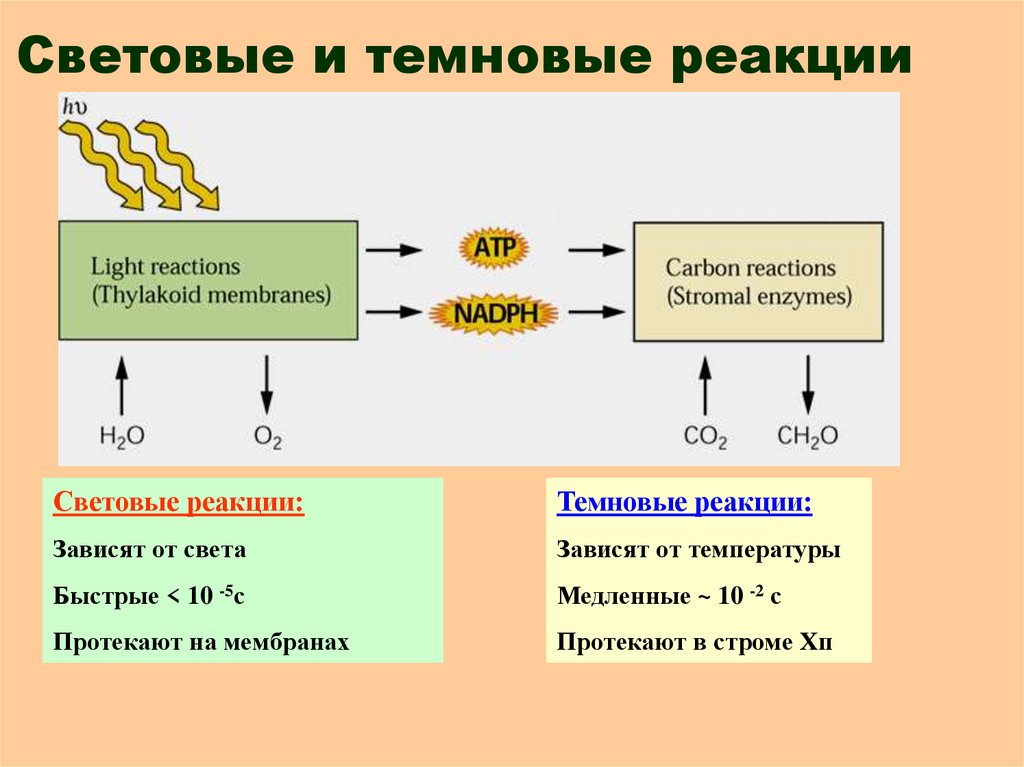
8. Световые и темновые реакции
Световые реакции:Темновые реакции:
Зависят от света
Зависят от температуры
Быстрые < 10 -5с
Медленные ~ 10 -2 с
Протекают на мембранах
Протекают в строме Хп
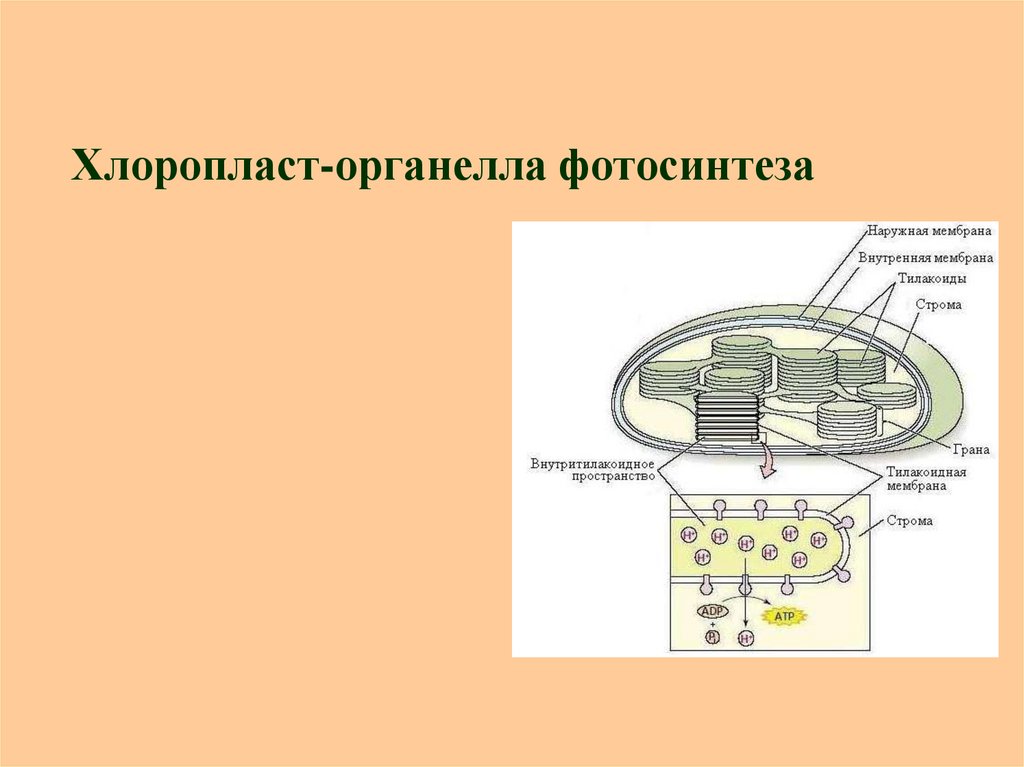
9. Структурная организация фотосинтетического аппарата
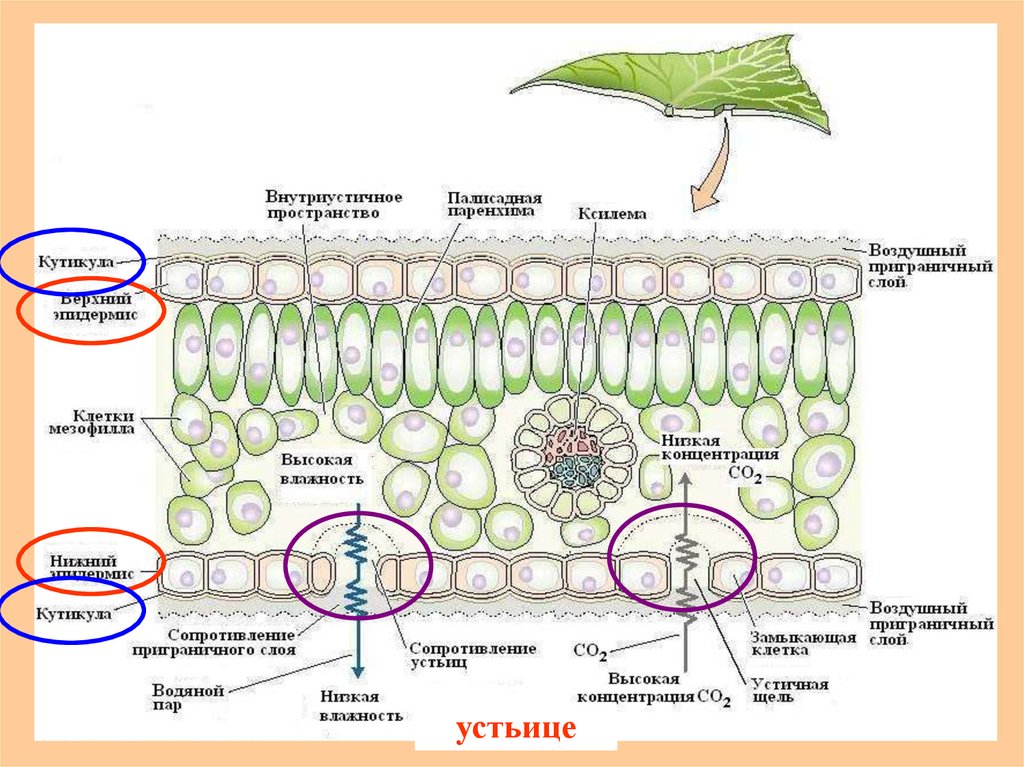
10. Лист как орган фотосинтеза
Выполнение листом этой функциисвязано с содержанием в хлоропластах
фотосинтетических пигментов
11.
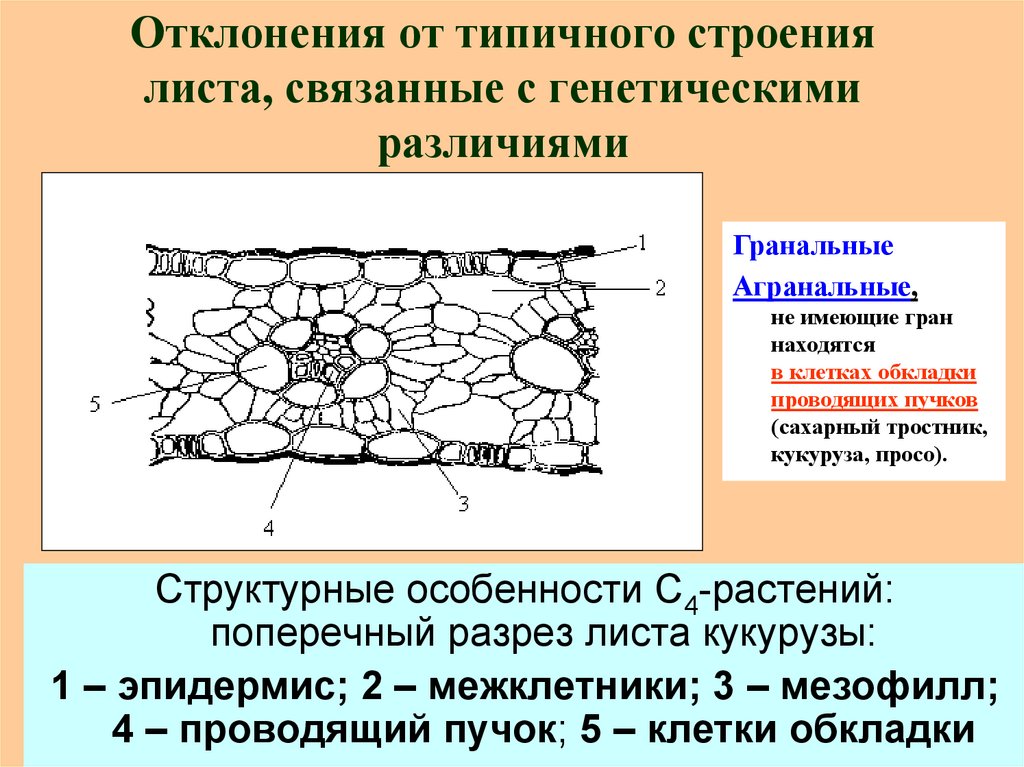
устьице12. (С4-растения) кукуруза, сахарный тростник
каждый проводящий пучококружен одним слоем крупных
клеток хлорофиллоносной
паренхимы, образующих
обкладку проводящего пучка.
Фотосинтез идет и в клетках
мезофилла и в клетках
обкладки проводящего пучка
13. Отклонения от типичного строения листа, связанные с генетическими различиями
ГранальныеАгранальные,
не имеющие гран
находятся
в клетках обкладки
проводящих пучков
(сахарный тростник,
кукуруза, просо).
Структурные особенности С4-растений:
поперечный разрез листа кукурузы:
1 – эпидермис; 2 – межклетники; 3 – мезофилл;
4 – проводящий пучок; 5 – клетки обкладки
14. Хлоропласт-органелла фотосинтеза
15. Пигменты
это вещества, избирательно поглощающие свет ввидимой части спектра.
При освещении белым светом их цвет определяется
только лучами, которые они отражают или пропускают.
Способность пигментов поглощать свет, связана:
1. наличие в молекулах правильно чередующихся
двойных и одинарных связей - сопряженные или
коньюгированные связи.
2. между двумя атомами, связанными двойными
связями, находится 4 электрона - половина этих
электронов может свободно перемещаться вдоль
системы (делокализованные электроны).
Поглотив квант света, электрон может оторваться
от молекулы пигмента, которая становится донором
электронов для восстановления веществ.
16.
е-А (акцептор)
хл +
«дырка»
h
17. высшие растения содержат
2 формы зеленых пигментовхла
хлb
2 формы желтых пигментов
(каротиноиды):
каротины
ксантофиллы
Фикобилины
Криптофитовые
Красные
Сине-зеленые водоросли
18. Классификация пигментов
По функции1) фотосинтетические (зеленые, желтые)
2) нефотосинтетические (уч. в ОВР, антоцианы,
меланины)
основные –хл а (1%, роль РЦ),
вспомогательные-хл а (99%), хл в, каротиноиды
По структуре
1) порфиринового ряда
(тетрапиррольная циклическая структура-хл,
открытая тетрапиррольная структурафикобилины)
тетрапиррольная циклическая структураMg-порфирины
2) полиизопреноидной природы (каротиноиды )
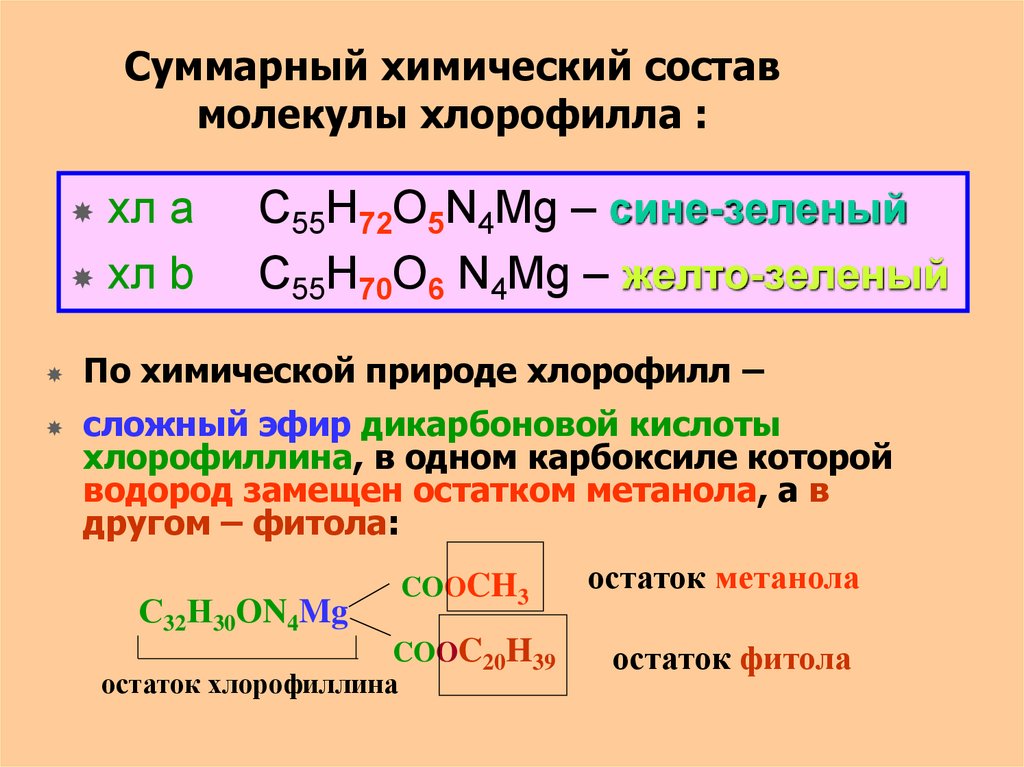
19. Суммарный химический состав молекулы хлорофилла :
хл ахл b
С55Н72О5N4Mg – сине-зеленый
С55Н70О6 N4Mg – желто-зеленый
По химической природе хлорофилл –
сложный эфир дикарбоновой кислоты
хлорофиллина, в одном карбоксиле которой
водород замещен остатком метанола, а в
другом – фитола:
С32Н30ON4Mg
COOCH3
COOC20H39
остаток хлорофиллина
остаток метанола
остаток фитола
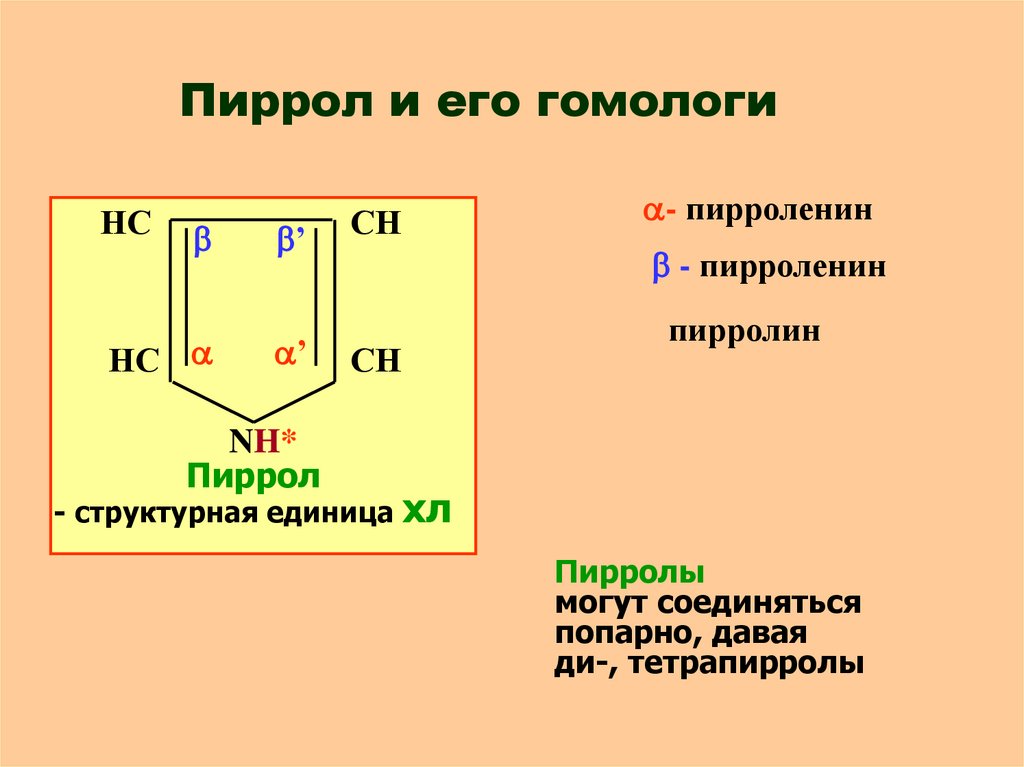
20. Пиррол и его гомологи
НС’
НС
’
СН
- пирроленин
- пирроленин
СН
пирролин
NH*
Пиррол
- структурная единица хл
Пирролы
могут соединяться
попарно, давая
ди-, тетрапирролы
21.
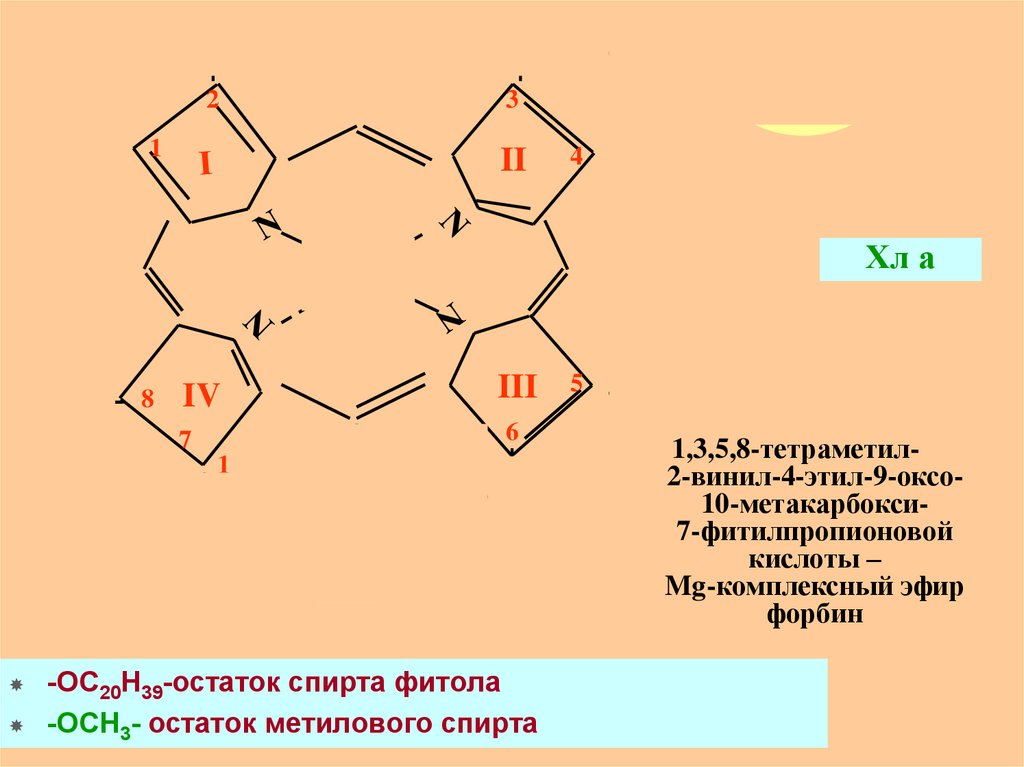
В основе молекулыхл - порфирин,
который состоит из 4 пиррольных колец
(пронумерованы римскими цифрами),
соединенных метиновыми мостиками
(–СН=).
В центре порфиринового ядра находится
атом Mg, связанный с N
- Хл - Mg-порфирин.
Порфирины входят также в состав гема
крови и являются важным компонентом
систем, принимающих участие в дыхании;
в этом случае вместо Mg они содержат Fe.
22.
H2C=CH2
H3C
O
CH3
3
1
II
H
4
C2H5
Хл а
Mg
H3C
8
IV
III
7
6
1
(CH2)2
10
V
5
9
COOCH3
COOC20H39
Хл в
C
-OC20H39-остаток спирта фитола
-OCH3- остаток метилового спирта
O
CH3
1,3,5,8-тетраметил2-винил-4-этил-9-оксо10-метакарбокси7-фитилпропионовой
кислоты –
Mg-комплексный эфир
форбин
23.
циклопентановоекольцо (V)
содержит высокоактивную кетогруппу
и участвует в окислении воды.
24.
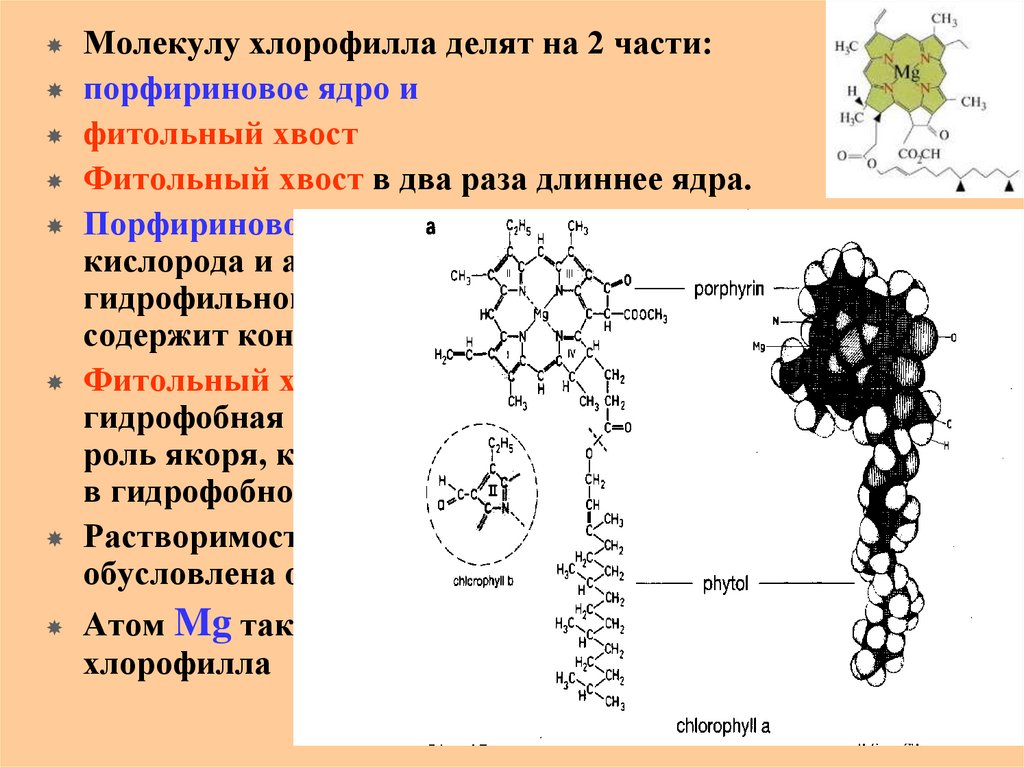
Молекулу хлорофилла делят на 2 части:порфириновое ядро и
фитольный хвост
Фитольный хвост в два раза длиннее ядра.
Порфириновое ядро благодаря наличию атомов
кислорода и азота гидрофильно - размещается в
гидрофильной части мембраны тилакоида;
содержит коньюгированные связи -поглощает свет
Фитольный хвост – это углеводородная, а значит
гидрофобная часть молекулы хлорофилла –
роль якоря, который удерживает молекулу хлорофилла
в гидрофобной части мембраны тилакоида
Растворимость пигмента в бензине, его гидрофобность
обусловлена остатком фитола.
Атом Mg также влияет на поглощение света молекулой
хлорофилла
-
25.
Роль Mg в поглощении света связана:1. изменяет симметрию молекулы
хлорофилла - все сопряженные связи и сама
молекула находятся в одной плоскости.
Когда молекула принимает другую форму взаимодействие π-электроновых облаков
нарушается-цепь сопряжения разъединяетсяцвет пигментов изменяется или пропадает
2. придает молекуле хлорофилла
способность соединяться с другими
молекулами этого пигмента
3. необходим для сохранения
возбужденного состояния
молекулой хлорофилла
(тетрапирролы, содержащие
Fe,быстро рассеивают свет
26.
Феофитинизация ХлMg на Н– феофитин
- красно-бурый цвет
вместо зеленого
В природных условиях происходит осенью,
при старении листьев, под воздействием
неблагоприятных факторов - листья желтеют.
При влиянии различных факторов
(низкие и высокие температур,
дефицит и избыток воды) –
увеличение проницаемости мембран –
кислый вакуолярный сок - в хлоропласты преобразует Хл в феофитин –
листья желтеют.
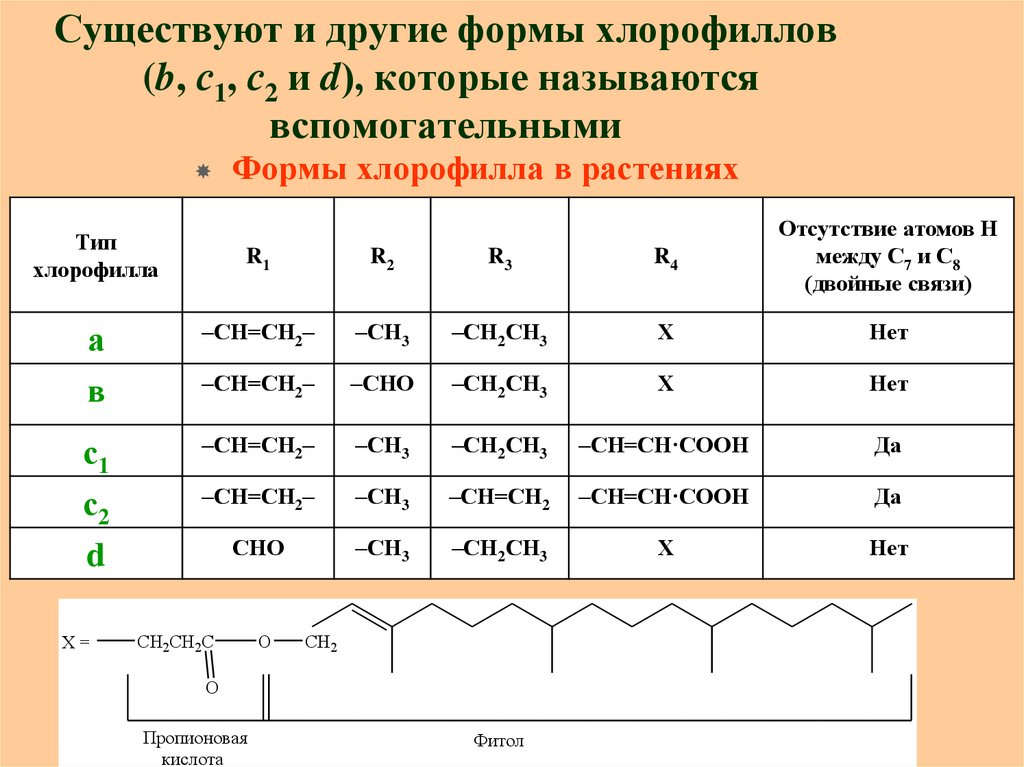
27. Существуют и другие формы хлорофиллов (b, с1, с2 и d), которые называются вспомогательными
Формы хлорофилла в растенияхR1
R2
R3
R4
Отсутствие атомов Н
между С7 и С8
(двойные связи)
а
в
–СН=СН2–
–СН3
–СН2СН3
Х
Нет
–СН=СН2–
–СНО
–СН2СН3
Х
Нет
с1
–СН=СН2–
–СН3
–СН2СН3
–СН=СН·СООН
Да
с2
d
–СН=СН2–
–СН3
–СН=СН2
–СН=СН·СООН
Да
СНО
–СН3
–СН2СН3
Х
Нет
Тип
хлорофилла
Х=
CH2CH2C
O
CH2
О
Пропионовая
кислота
Фитол
28. Биосинтез хлорофилла
Многоступенчатый процесс, который делятна 2 фазы: темновую и световую.
В темноте происходит синтез
протохлорофиллидаотличается от хлорофилла отсутствием
остатка фитола и 2 атомов Н.
На свету протохлорофиллид присоединяет
2 атома Н к 7-мому и 8-мому углеродным
атомам и образует хлорофиллид.
К хлорофиллиду присоединяется фитол превращается в хлорофилл (фермент
хлорофиллаза).
29. Ферменты биосинтеза хлорофилла локализованы в хлоропластах
Этапы биосинтеза хлорофилла:2 молекулы
Глутаминовая к-та → δ-Аминолевулиновая к-та →
4 молекулы
т
Порфобилиноген →
Ферменты
е
Уропорфириноген I и III →
биосинтеза
копропорфириноген III →
м
хлорофилла
протопорфириноген IХ →
локализованы
н
Mg
в хлоропластах
протопорфирин IХ →
о
Mg-протопорфирин IХ →
т
метиловый эфир
а
Mg-протопорфирина →
2Н
протохлорофиллид →
с
протохлорофиллид голохром →
в
е
хлорофиллид а голохром →
фитол
т
хлорофиллид а →
хлорофилл
30. Каротиноиды
жирорастворимые пигменты желтого, оранжевого икрасного цветов.
входят в состав хлоропластов и хромопластов, незеленых
частей растений (цветов, плодов, корнеплодов).
В зеленых листьях их окраска маскируется хлорофиллом.
Разрушение хлорофилла осенью или при воздействии
неблагоприятных факторов приводит к пожелтению
листьев.
Каротиноиды являются тетратерпеноидами
(8 остатков изопрена) и содержат 40 атомов С.
представляют собой цепи, которые имеют, как и
хлорофилл, двойные сопряженные связи. На одном или
двух концах цепи находятся иононовые кольца.
Каротиноиды делят на две группы: каротины и
ксантофиллы.
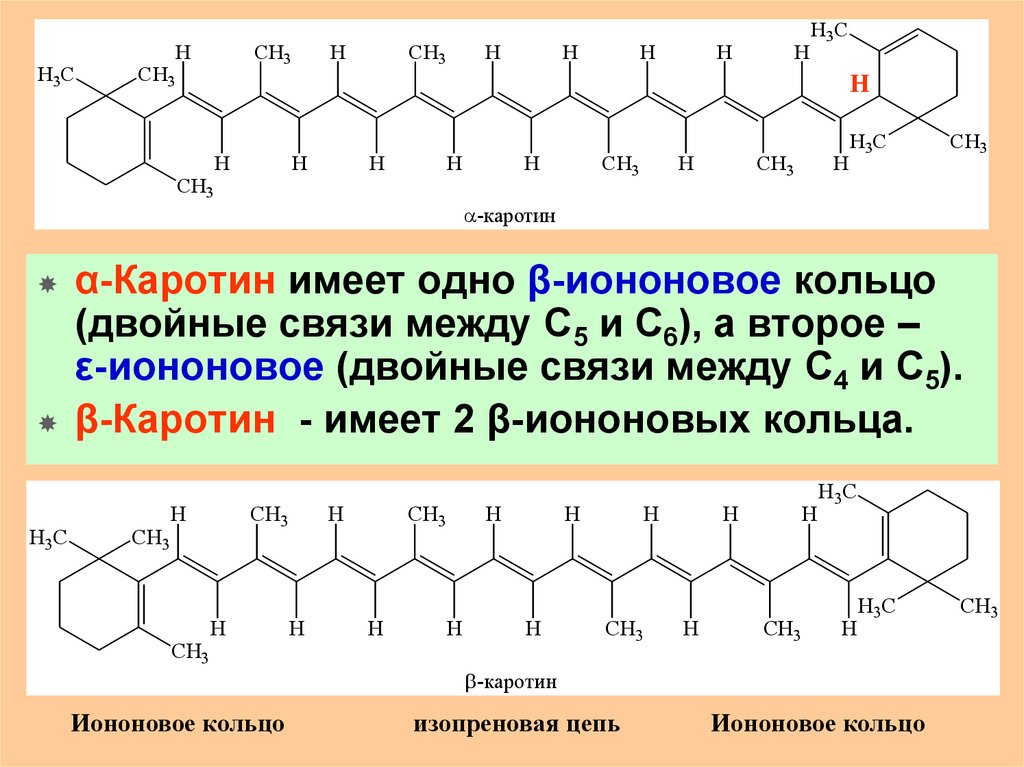
Каротины, например α-каротин (С40Н56) представляет
собой чистые углеводороды (тетратерпены):
31.
H3CCH3
H
CH3
H
CH3
H
H
H
H
H
H3C
Н
CH3
H
H
H
H
H
CH3
H
CH3
H
H3C
CH3
-каротин
α-Каротин имеет одно β-иононовое кольцо
(двойные связи между С5 и С6), а второе –
ε-иононовое (двойные связи между С4 и С5).
β-Каротин - имеет 2 β-иононовых кольца.
H3C
CH3
H
CH3
CH3
H
Иононовое кольцо
H
H
CH3
H
H
H
H
H
H
CH3
H
H
H
CH3
H3C
H
H3C
-каротин
изопреновая цепь
Иононовое кольцо
CH3
32.
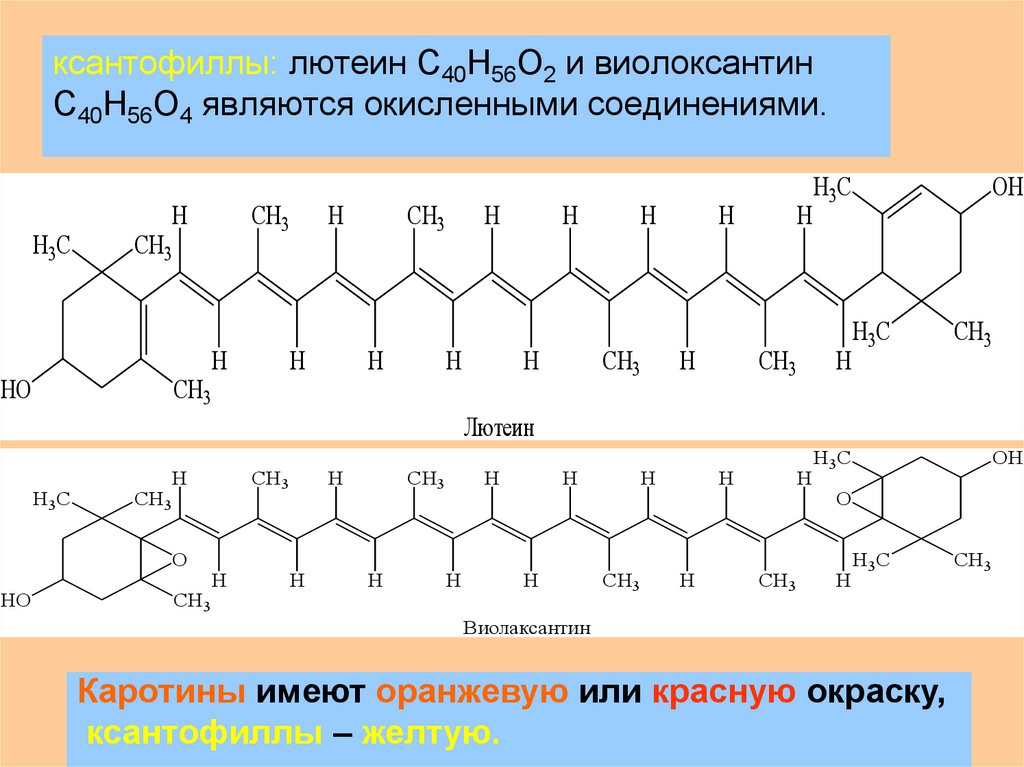
ксантофиллы: лютеин С40Н56О2 и виолоксантинС40Н56О4 являются окисленными соединениями.
H3C
CH3
HO
H
CH3
CH3
H
H
H
CH3
H
H
H
H
H
H
CH3
H
H
H
CH3
H3C
H
OH
H3C
CH3
Лютеин
H3C
CH3
H
O
HO
CH3
CH3
H
H
H
CH3
H
H
H
H
H
H
CH3
H
H
H
CH3
H3C
OH
O
H
H3C
Виолаксантин
Каротины имеют оранжевую или красную окраску,
ксантофиллы – желтую.
CH3
33. Функции каротиноидов
Расширяют спектральную областьпоглощаемого света
Вспомогательные пигменты («светосборщики»)
Участвуют в миграции энергии на
Защищают
хл при ф-зе
хл от фотодеструкции
Участвуют непосредственно в фотоокислении
Н2О при ф-зе
34. Около 40–45 % излучаемой солнцем энергии приходится на область от 380 до 720 нм. Эта часть спектра воспринимается как видимый
свет.Тут располагаются известные цвета:
фиолетовый, синий, голубой, зеленый,
желтый, оранжевый, красный.
Пигменты хлоропластов поглощают
видимый свет,
поэтому эта область была названа
физиологически активной радиацией
(ФАР)
35. Законы поглощения света
Пигменты зеленого листа поглощают свет:1. Только свет, который поглощается, может
производить химическое действие.
2. Каждый квант активирует только одну
молекулу.
3. Вся энергия кванта поглощается одним
электроном, который подымается на
более высокий энергетический уровень.
36.
Поглощение светаодноквантовый,
одноэлектронный
физический процесс
37. Спектры поглощения
1- хл а2- хл в
3- β-каротин;
4- фикоэритробилин
2
4
1
1
3
2
Спектры поглощения некоторых
фотосинтетических пигментов (Avers, 1985):
38. Спектры поглощения
ХлорофиллыВ случае
хл наиболее полно
поглощаются красные и
сине-фиолетовые лучи.
Небольшая разница в строении
молекулы хл а и b
обуславливает некоторую
Спектры поглощения некоторых
фотосинтетических пигментов (Avers, 1985) разницу в поглощении ими света.
1- хл а; 2- хл в; 3- β-каротин;
4- фикоэритробилин
Какие длины волн будет
Хл
а более полно поглощает
свет с длиною волны 670, 680,
поглощать пигмент, зависит от
700 и 435 нм
количества и расположения
двойных связей в молекуле
Хл b – 650 и 480 нм.
присутствия ароматических колец
Хл b полоса поглощения в
присутствия атома металла
Хл а образует 8–10 форм, которые
химически одинаковы, но
отличаются по поглощению света
красной части спектра смещена в
сторону коротковолновых лучей,
а в сине-фиолетовой – в сторону
длинноволновых.
39. Спектры поглощения
Желтые пигментыпоглощают те лучи, которые
плохо поглощают зеленые
пигменты
Максимально они поглощают
сине-фиолетовые
хуже – голубые
Спектры поглощения некоторых
фотосинтетических пигментов (Avers, 1985)
1- хл а; 2- хл в; 3- β-каротин;
немного - зеленые
4- фикоэритробилин
не поглощают -красные,
желтые, оранжевые
Спектры поглощения
каротиноидов –
наличие 3 полос в области
от 400 до 500 нм
40. Спектры поглощения
Эта особенность позволяетСпектры поглощения некоторых
фотосинтетических пигментов (Avers, 1985)
1- хл а; 2- хл в; 3- β-каротин;
4- фикоэритробилин
красным водорослям ,
живущим в глубине моря,
осуществлять фотосинтез,
используя только слабый
голубовато-зеленый свет,
прошедший сквозь толщу
воды
Фикобилины
поглощают свет в желтой и зеленой
областях спектра между 2 максимумами
поглощения света хлорофиллов:
Фикоэритрины- 498-598 нм
Фикоцианины – 585-630 нм
Аллофикацианины- 585-650 нм
41.
Вероятность поглощения света зависит отдлины волны
относительной ориентации его электромагнитного поля по
отношению к электронам в молекуле, которая поглощает этот свет.
На поглощение света влияет
взаимное размещение электронов в атоме или молекуле; это связано
с тем, что электроны обладают спином.
Величина спина всех электронов одинакова, но поскольку спин
является векторной величиной, он может иметь разные
направления в пространстве (в атоме имеется внутреннее магнитное
поле).
Поэтому возможны 2 ориентации
спин электрона может быть направлен параллельно локальному
магнитному полю – спин «+»
спин электрона может быть направлен антипараллельно
локальному магнитному полю – спин «-»
42.
Весь спин атома или молекулы является векторнойсуммой спинов всех электронов.
Спин = h/2π
+1/2 -1/2
Величина полного спина обозначается символом S.
Cпиновая мультиплентность
количество возможных ориентаций в пространстве
полного спина атома или молекулы –– выражается
формулой 2S + 1, где S – величина полного спина целого
атома или молекулы.
если S = 0 (спин =+1/2+ (-1/2)=0),
проекция спинов всех электронов на направление
магнитного поля взаимно умножается и
2S + 1=2·0+1=1
Состояние Хл, когда полный спин S=0 - синглетное
(single-один, единственный).
когда
S
=
1, то такое положение называется
триплетным (2S + 1 = 3).
43. Принцип Паули
Наиболее устойчивы те состояния атомов, вкоторых валентные электроны занимают самые
низкие энергетические уровни и распределены
по ним согласно принципу Паули:
Если атом имеет четное количество электронов,
то их спины (векторы магнитных моментов,
равные +1/2 или –1/2) направлены
противоположно друг другу и суммарный спин
всех электронов атома равен 0. Синглетное
состояние (S=0)
Если же число электронов в атоме четное, но
спины двух электронов параллельны, то полный
спин равен 1 (S=1). Триплетное состояние.
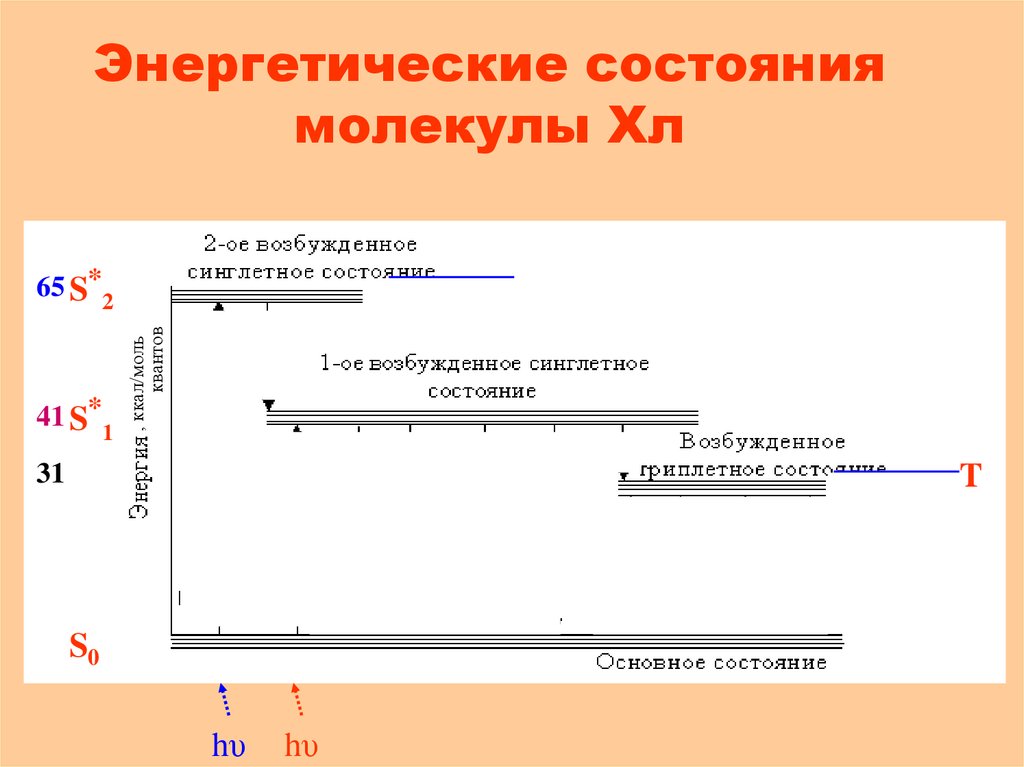
44. Энергетические состояния молекулы Хл
41 S*1, ккал/моль
квантов
65 S*2
теплота
31
T
S0
430
hυ
680
hυ
45.
У молекулы Хл фотохимическиактивным
является долгоживущее
триплетное состояние
(А.Н. Теренин)продолжительность жизни
молекул сопоставима со
скоростями химических
процессов; становится
возможным превращение
световой энергии в химическую.
46. Дезактивация электронного возбуждения
Время нахождения электрона на верхнем уровне, ввозбужденном состоянии очень мало. При возвращении из
возбужденного в основное состояние (дезактивация
электронного возбуждения) энергия может выделяться
1) в виде тепла (безизлучательные переходы),
2) в виде света (флуоресценция, фосфоресценция) (излучательные переходы),
3) затрачиваться на фотохимическую работу (фотохимическая
дезактивация)
4) передаваться другим молекулам, которые перейдут, в свою
очередь, в возбужденное состояние (передача возбуждения).
Время, необходимое для реакции дезактивации
возбужденного состояния, выражают через время жизни.
47. Миграция энергии в системе фотосинтетических пигментов
передача энергии возбуждения со ССК(светособирающего комплекса) на РЦ
(реакционный центр)
безизлучательный перенос электронного
возбуждения от одной молекулы к другой,
пока это возбуждение не попадет на РЦ
МЭ происходит от более коротковолновых
к более длинноволновым формам:
Хл650 Хл660 Хл665 Хл670 Хл680
от каротиноидов к хлорофиллам,
от хл b к хл а:
каротин (440–550 нм) → хлорофилл b (650 нм) →
→ хлорофилл а (660–675 нм) → Р680 (II система).
48.
общепризнанным механизмомпередачи электронного возбуждения
между молекулами пигментов
является так называемый
резонансный перенос.
Для того, чтобы произошел этот
перенос энергии, возбужденная
молекула должна индуцировать
возбужденное состояние в другой
молекуле, находящейся в
непосредственной близости от нее.
49.
Хл- оптический сенсибилизатордля резонансного переноса электронного
возбуждения
(легко возбуждается при
необходимо, чтобы энергия, которую
может передать
поглощении
света и обладает
возбужденная молекула, соответствовала
энергии,
которую
способностью
передавать
может принять другая молекула. энергию (служить донором
энергии) другим молекулам
передача энергии возможна лишь при условии, что
(акцепторам энергии))
спектр флуоресценции пигмента-донора перекрывается
со спектром поглощения пигмента-акцептора.
резонансный перенос энергии между молекулами
хлорофилла возможен только в том случае, когда молекулы
расположены относительно близко одна от другой и в
определенной последовательности при расстоянии между
ними порядка 5–10 нм.
Расстояние (~ 2,8 нм) между центрами молекул хлорофилла
в тилакоидных мембранах хлоропластов должно обеспечить
резонансный перенос энергии возбуждения.
Как спектральные свойства хлорофилла, так и расстояние
между его молекулами в мембране содействуют
эффективной миграции энергии возбуждения от молекулы к
молекуле по механизму резонансного переноса.


































 biology
biology








