Similar presentations:
Задачи по химическому уравнению, если один из реагентов взят в избытке (9 класс)
1.
Задачи по химическому уравнению,если один из реагентов взят в избытке
2.
Помните:1. Задача состоит из 3-ёх частей:
I - химическая – краткая запись данных,
составление уравнения реакции;
II - аналитическая – анализ данных в условии и
уравнения реакции;
III - математическая – расчеты по уравнению
реакции.
2. Данный тип задач предполагает дополнительное
действие: определение реагента, который взят в
избытке.
3. Массу (количество, объем) продукта определяют
по веществу, полностью израсходованному в
реакции( т.е. количество вещества которого
меньше).
3.
Пример решения задачи №1Рассчитайте массу ртути,
выделившейся в результате
взаимодействия 3,2г меди и
20г раствора нитрата ртути
4.
Этапы решения задачи:1. Записываем
уравниваем его:
уравнение
реакции
и
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
2. Находим количество вещества в моль тех
веществ, массы которых нам даны в условии:
n(Cu) = m\M =3.2 г \ 64 г\моль = 0,05 моль
n (Hg(NO3)2) = m\M = 20г \ 324г\моль = 0,06 моль
5.
3. Сравниваем количество моль веществ и определяем недостаток:0,05 моль
0,06 моль
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
1 моль
1 моль
по уравнению реакции медь и нитрат ртути реагируют 1:1, значит, их
количество моль, по условию задачи, тоже должно быть одинаковым
0,05 моль < 0,06 моль — медь в недостатке
Задачи на «избыток и недостаток» всегда решаются
ПО НЕДОСТАТКУ
Почему по недостатку? Иначе я получу НЕРЕАЛЬНЫЙ (завышенный) результат
6.
4. Вычисляем массу продукта по количествумоль, соответствующему недостатку:
0,05 моль ——> 0,05 моль
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
1 моль
1 моль
m(Hg)= n *М = 0,05 моль * 200 г\моль = 10 г
7.
Решите задачи 7, 81. Записываем уравнение реакции и
уравниваем его
2. Находим количество моль тех веществ,
массы которых нам даны в условии
3. Сравниваем количество моль веществ и
определяем недостаток
(Задачи на избыток и недостаток всегда решаются ПО НЕДОСТАТКУ)
4.Вычисляем массу продукта по количеству
моль, соответствующему недостатку
8.
Пример задачи №2, где вещества вдругом соотношении:
На 24г металлического магния
подействовали 100г 30%-го раствора
соляной кислоты. Найдите массу
образовавшегося хлорида магния.
9.
те же самые этапы решения1 моль 0.822 моль
1.
Mg + 2HCl = MgCl2 + H2
1 моль
2 моль
2. n (Mg) = m\M = 24г\24г/моль= 1 моль
m (HCl) = ω * m(р-ра) = 0,3 * 100 = 30г
n (HCl) = m\M =30г\36,5г/моль = 0.822 моль
в этом уравнении все не так очевидно, как в предыдущем, поэтому
нужно просто прикинуть:
1 моль









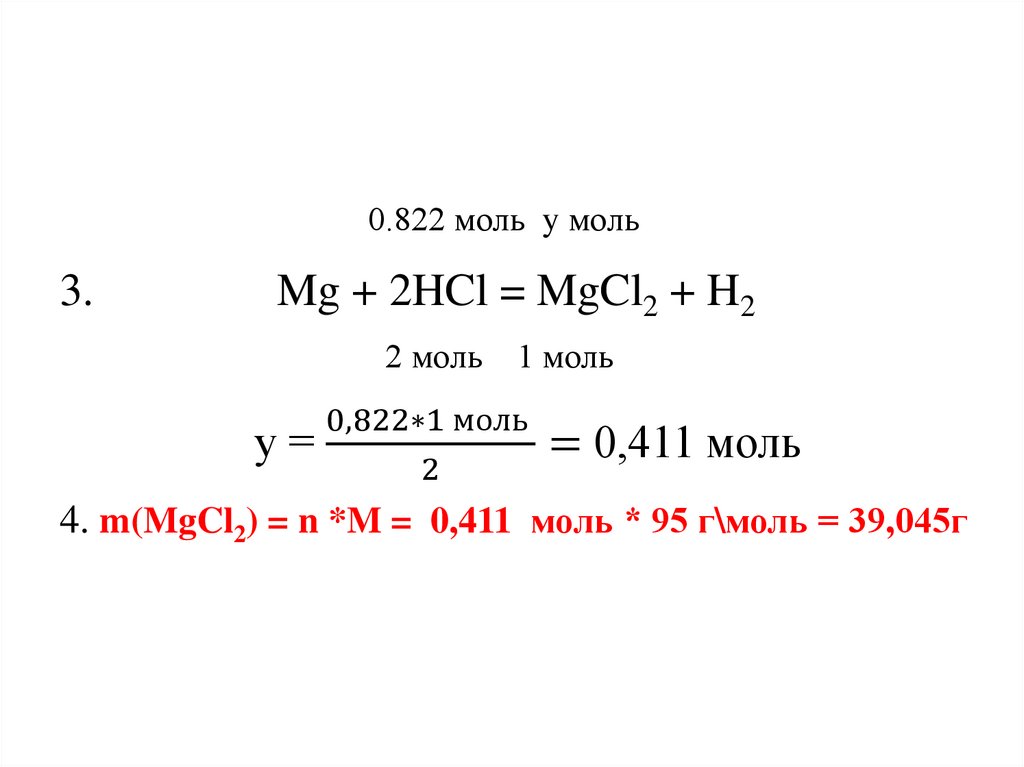

 chemistry
chemistry








