Similar presentations:
Решение задач с использованием химического уравнения, если одно из веществ дано в избытке
1. Решение задач с использованием химического уравнения, если одно из веществ дано в избытке
2.
Алгоритм расчетов по химическимуравнениям, если одно из реагирующих
веществ дано в избытке:
1.
2.
3.
4.
5.
6.
Записать условие и вопрос задачи (дано,
найти).
Записать уравнение реакции (исходные
вещества, продукты, расставить
коэффициенты).
Найти количества исходных веществ.
Определить избыточный и недостаточный
реагенты.
Рассчитать искомое вещество по реагенту,
находящемуся в недостатке.
Правильно записать ответ.
3.
Пример решения задачиСмешали два раствора, содержащих соответственно 33,3
г хлорида кальция и 16,4 г фосфата натрия.
Вычислите массу образовавшегося фосфата кальция.
4.
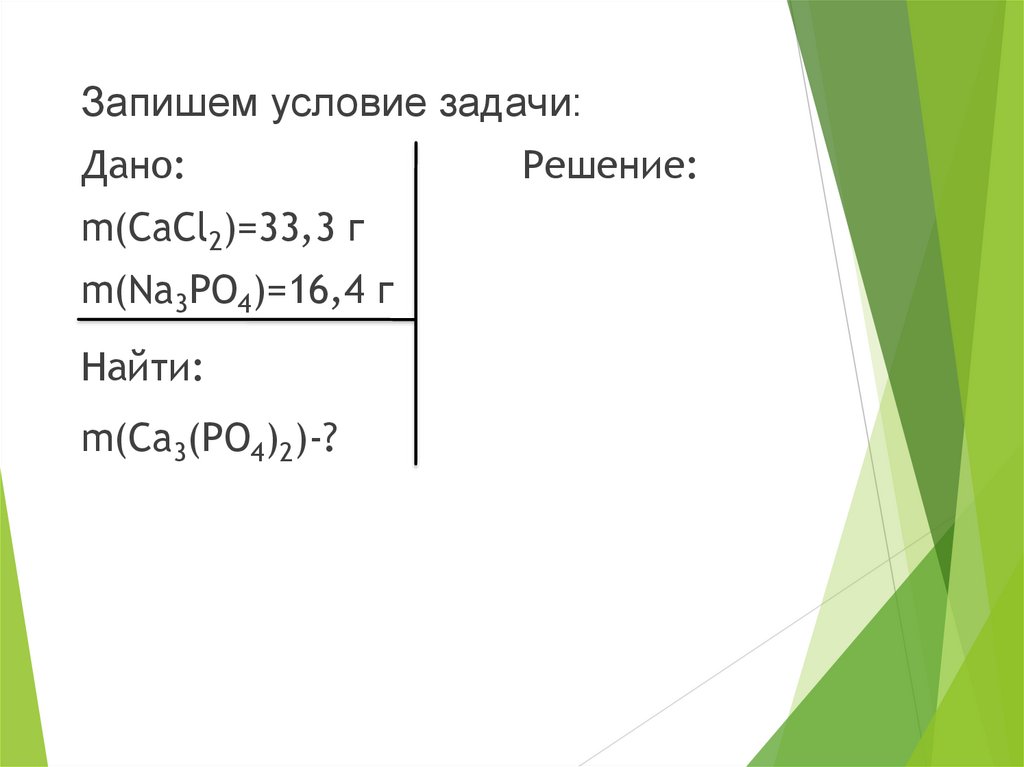
Запишем условие задачи:Дано:
m(CaCl2)=33,3 г
m(Na3PO4)=16,4 г
Найти:
m(Ca3(PO4)2)-?
Решение:
5. 1) Запишем уравнение реакции, расставим коэффициенты:
3CaCl2 + 2Na3PO4 = Ca3(PO4)2 ↓ +6NaCl
2) Найдем количества веществ, масса
которых дана в условии задачи:
m
n
M
M(CaCl2)= 1*40 + 2*35,5 = 111 г/моль
M(Na3PO4)= 3*23 + 1*31 + 4*16 = 164 г/моль
n(CaCl2 )
33,3г
0,3 моль
111 г
моль
6. 0,3 моль 0,1 моль х моль 3CaCl2 + 2Na3PO4 = Ca3(PO4)2 ↓ + 6NaCl 3 моль 2 моль 1 моль
16.4 гn( Na3 PO4 )
0,1моль
164 г
моль
3) Над формулами веществ запишем данные о
количестве веществ, найденных из условия
задачи, а под формулами – стехиометрические
соотношения, отображаемые уравнением
реакций
0,3 моль 0,1 моль
х моль
3CaCl2 + 2Na3PO4 = Ca3(PO4)2 ↓ +
6NaCl
3 моль
2 моль
1 моль
7. CaCl2 – в избытке, Na3PO4 – в недостатке. Расчет ведем по Na3PO4.
4) Определим, какой из реагентов взят визбытке. Для этого составим пропорцию
соотношений количеств реагирующих
веществ по условию и уравнению реакций:
0,3 моль 0,1моль
;
3 моль
2 моль
0,1 ˃ 0,05, значит
8. 7) Запишем ответ: Ответ: m(Ca3(PO4)2)= 15,5 г
5)Вычислим количество вещества, массукоторого требуется найти. Для этого
составим пропорцию:
0,1 х
0,1*1
; х
0,05
2
1
2
n(Ca3(PO4)2) = 0,05 моль
6) Найдем массу вещества, которую
требуется вычислить:
m=n*M
M(Ca3(PO4)2)= 3*40 + 2*31 + 8*16 = 310 г/моль
m(Ca3(PO4)2)= 0,05 моль * 310 г/моль = 15,5 г
7) Запишем ответ:
Ответ: m(Ca3(PO4)2)= 15,5 г
9. №2-59. Вычислите массу соли, образовавшейся при взаимодействии азотной кислоты массой 6,3 г с раствором, содержащим гидроксид
Решение задач№2-59. Вычислите массу соли,
образовавшейся при взаимодействии
азотной кислоты массой 6,3 г с
раствором, содержащим гидроксид
натрия массой 2 г.
10. Дано: Решение: m(HNO3)=6,3 г 0,1 моль 0,05 моль х моль m(NaOH)=16,4 г HNO3 + NaOH = NaNO3+ H2O Найти: 1 моль 1 моль 1 моль
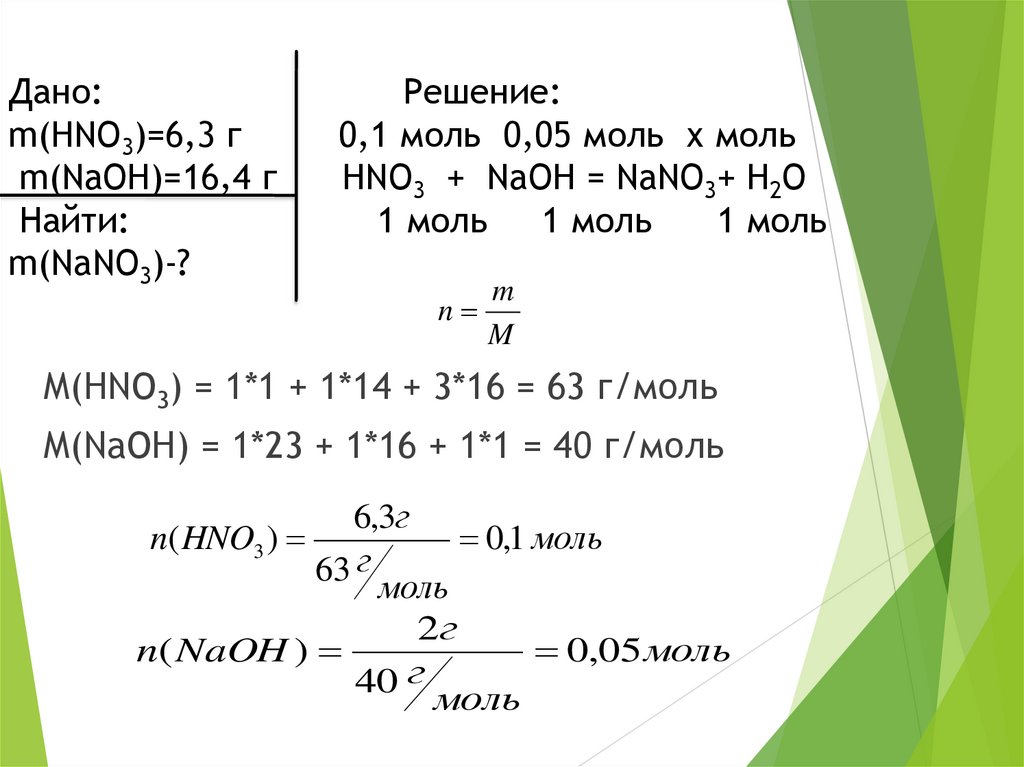
Дано:m(HNO3)=6,3 г
m(NaOH)=16,4 г
Найти:
m(NaNO3)-?
Решение:
0,1 моль 0,05 моль х моль
HNO3 + NaOH = NaNO3+ H2O
1 моль
1 моль
1 моль
m
n
M
M(HNO3) = 1*1 + 1*14 + 3*16 = 63 г/моль
M(NaOH) = 1*23 + 1*16 + 1*1 = 40 г/моль
6,3г
n( HNO3 )
0,1 моль
63 г
моль
2г
n( NaOH )
0,05 моль
г
40
моль
11. 0,1 ˃ 0,05, значит HNO3 – в избытке, NaOH – в недостатке. Расчет ведем по NaOH.
0,1 моль 0,05 моль1 моль
1 моль
0,1 ˃ 0,05, значит HNO3 – в избытке,
NaOH – в недостатке.
Расчет ведем по NaOH.
0,05 х
0,05 *1
; х
0,05
1
1
1
n(NaNO3) = 0,05 моль
m=n*M
M(NaNO3) = 1*23 + 1*14 + 3*16 = 85 г/моль
m(NaNO3) = 0,05 моль * 85 г/моль = 4,25 г
Ответ: m(NaNO3) = 4,25 г
12. Решение задач
№2-63. Вычислите массу соли,образовавшейся при взаимодействии
серной кислоты массой 9,8 г с
раствором, содержащим гидроксид
кальция массой 14,8 г.
13.
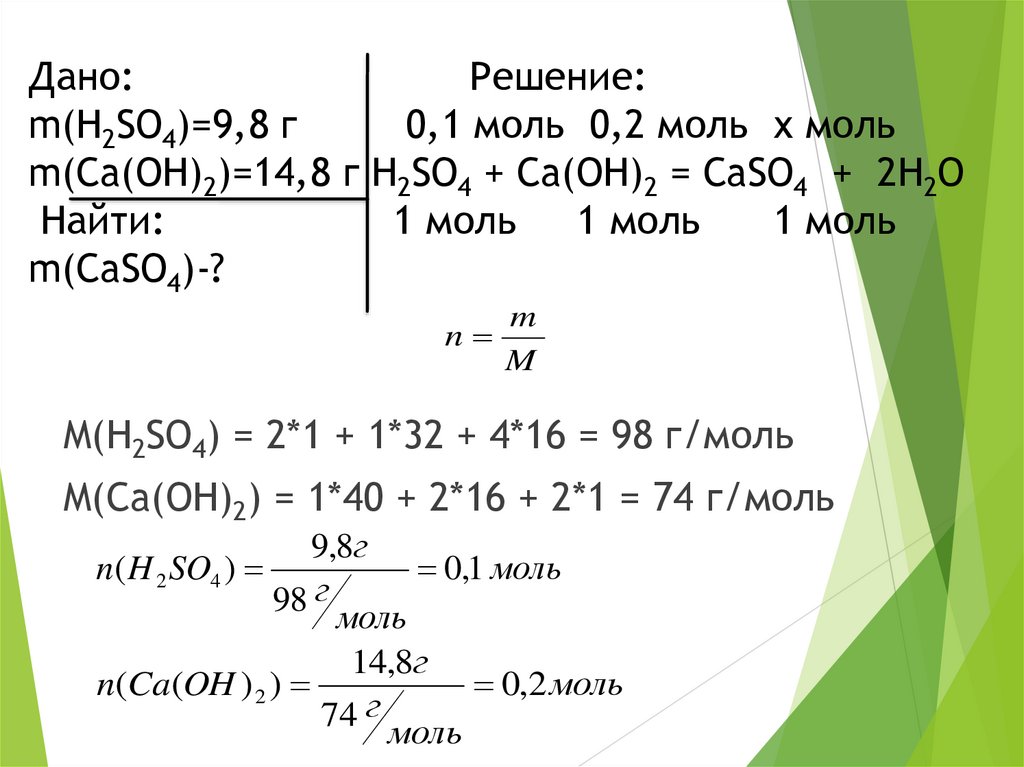
Дано:Решение:
m(H2SO4)=9,8 г
0,1 моль 0,2 моль х моль
m(Ca(OH)2)=14,8 г H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
Найти:
1 моль 1 моль
1 моль
m(CaSO4)-?
n
m
M
M(H2SO4) = 2*1 + 1*32 + 4*16 = 98 г/моль
M(Ca(OH)2) = 1*40 + 2*16 + 2*1 = 74 г/моль
9,8г
n( H 2 SO4 )
0,1 моль
98 г
моль
14,8г
n(Ca(OH ) 2 )
0,2 моль
74 г
моль
14.
0,1 моль 0,2 моль1 моль
1 моль
0,1 ˂ 0,2 , значит
H2SO4 – в недостатке,
Ca(OH)2– в избытке.
Расчет ведем по H2SO4.
0,1 х
0,1*1
; х
0,1
1 1
1
n(CaSO4) = 0,1 моль
m=n*M
M(CaSO4) = 1*40 + 1*32 + 4*16 = 136 г/моль
m(CaSO4) = 0,1 моль * 136 г/моль = 13,6 г
15. Домашнее задание:
Задача 1К водному раствору, содержащему хлорид хрома (III) массой 3,17 г, прилили
раствор, содержащий сульфид калия массой 3,85 г. определите массу осадка.
Задача 2
Железо массой 14 г сплавили с серой массой 4,8 г. к полученной смеси веществ
добавили избыток соляной кислоты. Какие газы при этом образуются? Определите
объём этих газов.
Задача 3
В результате реакции между железом массой 22,4 г и хлором объёмом 15,68 л (н. у.)
получили хлорид железа (III), который растворили в воде массой 500 г. определите
массовую долю хлорида железа (III) в полученном растворе.
Задача 4
В закрытом сосуде смешаны оксид азота (II) массой 30 г и кислород массой 20 г.
Вычислите массу получившегося оксида азота (IV). Какой газ останется в избытке?
Какова масса этого газа?













 chemistry
chemistry








