Similar presentations:
Что такое степень окисления?
1.
Разработала:Квятковская
О.С.
учитель
химии
1 категории
ГБОУ школа
№217
2.
Повторим основные понятия:1.
2.
3.
H2SO3
Что такое степень окисления?
Правила определения степени окисления атомов в
соединении.
H2+1Sx O3-2
(+1) * 2 +X*1 + (-2) . 3 = 0
X = +4
H2+1S+4O3 -2
3.
СВОЯ ИГРА4.
РАУНД I«Я знаю и умею»
Класс
соединений
20
30
40
50
Металла,
неметаллы
20
30
40
50
А все - таки
что?
20
30
40
50
5.
Тема: «Класс соединений»20б
написать формулу,
определить класс соединений,
степень окисления
оксид алюминия
+3 -2
Al2O3
6.
Тема: «Класс соединений»30б
написать формулу,
определить класс соединений,
степень окисления
гидроксид магния
+2
-2
+1
Mg (OH)2
7.
Тема: Класс соединений40б
написать формулу,
определить класс соединений,
степень окисления в соединении:
серная кислота
+1 +6 -2
Н2 S O4
8.
Тема: «Класс соединений»50б
написать формулу,
определить класс соединений,
степень окисления
сульфат меди (II)
+2 +6 -2
CuSO4
9.
Тема: «Металлы, неметаллы»20б
Назовите элемент II периода, 1 группы,
главной подгруппы,
определите степень окисления как простого
вещества
литий (самый легкий металл)
0
Li
10.
Тема: «Металла, неметаллы»30б
Назовите элемент IV периода, 2 группы,
главной подгруппы, определите степень
окисления как простого вещества
Кальций (необходим в составе костей скелета )
0
Ca
11.
Тема: «Металлы, неметаллы»40б
Дайте характеристику элементу в Периодической
системе:
порядковый номер, период, группа, подгруппа
С
определите степень окисления как простого вещества
(Входит в состав известного витамина, необходимого в
весеннее время)
N=6, 2 период, IV группа, главная подгруппа, степень
окисления равна 0.
12.
Тема: «Металлы, неметаллы»50б
Дайте характеристику элементу в Периодической
системе: порядковый номер, период, группа, подгруппа
F (он необходим для сохранения в норме эмали зубов
человека )
N=9, 2 период, VII группа, главная
подгруппа, степень окисления равна 0.
13.
Тема: «А все-таки что?»20б
Какая кислота всегда находится в желудке
человека?
Определите степень окисления элементов
в данном соединении.
+1 -1
HCl - соляная кислота
14.
Тема: «А все-таки что?»30б
Какое вещество гасят водой, хотя оно не горит?
(оксид кальция)
+2 -2
СаО - Негашеная известь
15.
Тема: «А все - таки что?»40б
Выброс каких продуктов сгорания (ОКСИДЫ)
производят теплоэлектростанции,
работающие на каменном угле? Напишите
формулы оксидов.
оксиды углерода СО, СО2
оксиды серы SO2, SO3
16.
Тема: «А все-таки что?»50б
Какой царский напиток не пил ни один царь?
Назовите его состав? Определите степени
окисления элементов в соединениях.
царская водка, состоит из 1 объёма азотной кислоты и 3
объёмов соляной кислоты - кислоты концентрированные.
17.
Окислительновосстановительныереакции
Брожение
Реакции горения
Разряд молнии
S + O2 = SO3
18.
Цель:сформировать понятие об окислительновосстановительных реакциях, как
химических реакциях по признаку изменения
степени окисления
Задачи:
Знать понятия и уметь определять
окислитель и восстановитель, процессы
окисления и восстановления.
Выработать умения расставлять
коэффициенты методом электронного
баланса
19.
Реакциязамещения
30
40
50
Реакция
соединения
30
40
50
Реакция
разложения
30
40
50
20.
Внимание!Чтобы жизнь свою
Не подвергать опасности,
Соблюдайте, ребята
Правила безопасности.
21.
Тема: «Реакция замещения»30б
1) нитрат серебра + HCl
2) 2HCl + цинк
Ag
ZnCl2
+ HNO3
+
H2
22.
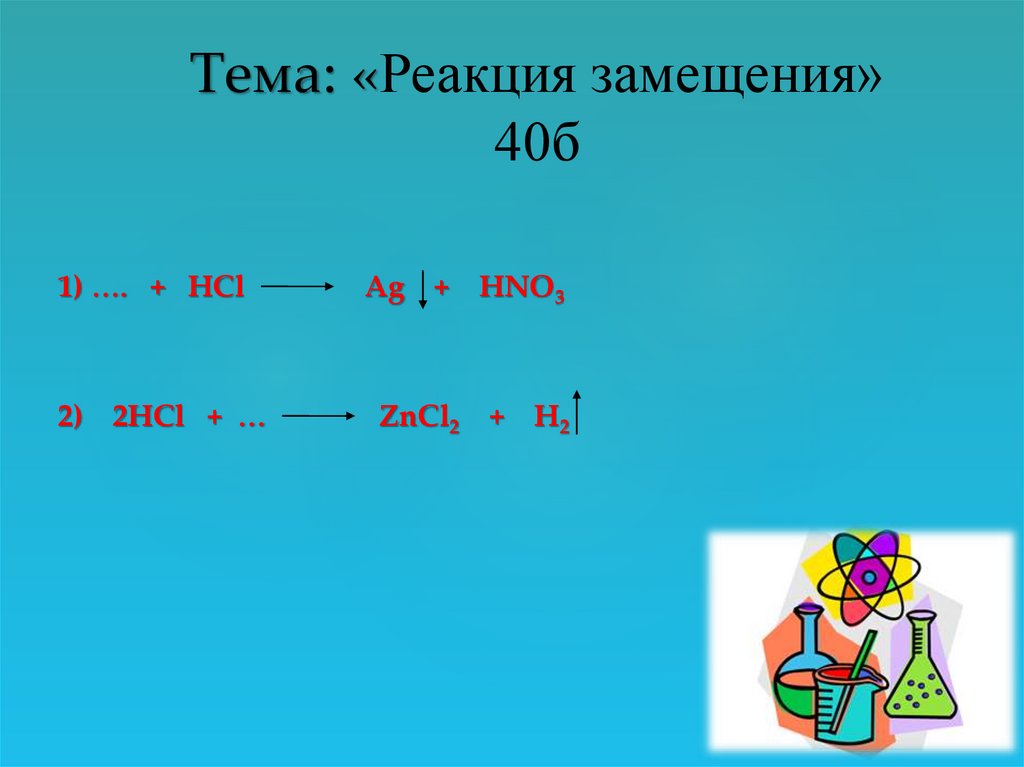
Тема: «Реакция замещения»40б
1) …. + HCl
2) 2HCl + …
Ag +
ZnCl2
HNO3
+ H2
23.
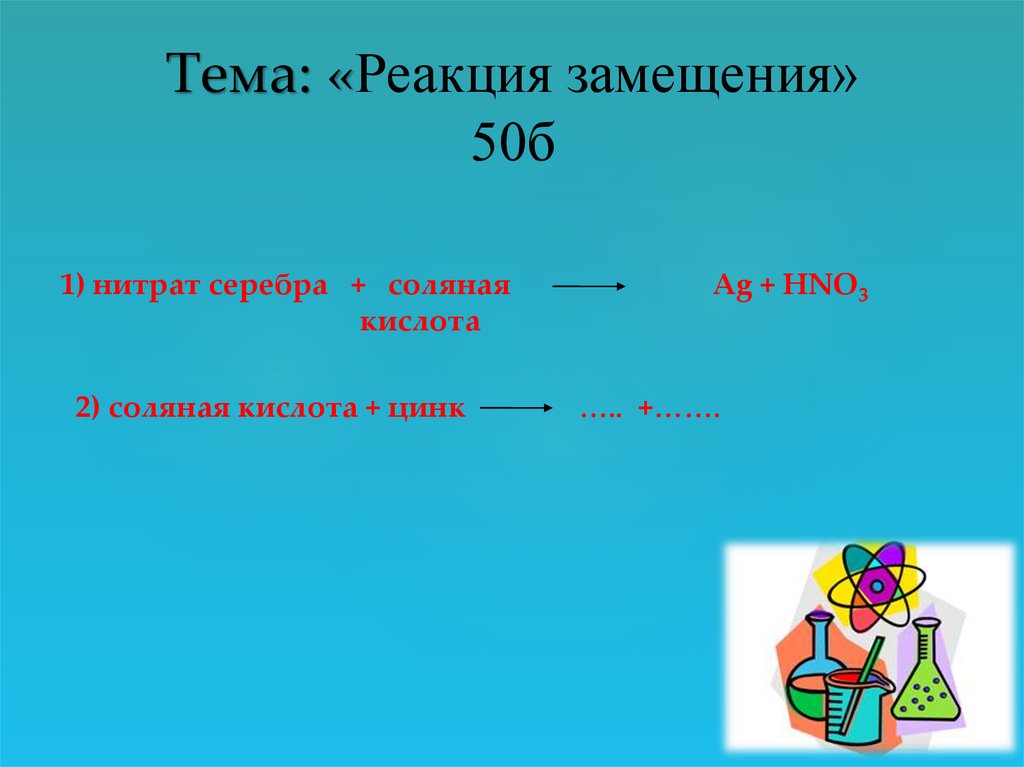
Тема: «Реакция замещения»50б
1) нитрат серебра + соляная
кислота
2) соляная кислота + цинк
Ag + HNO3
….. +…….
24.
Тема: «Реакция соединения»30б
1)Сульфат
меди (II)
+
хлорид
бария
2) магний + кислород
BaSO4 + СuCl2
….+…..
25.
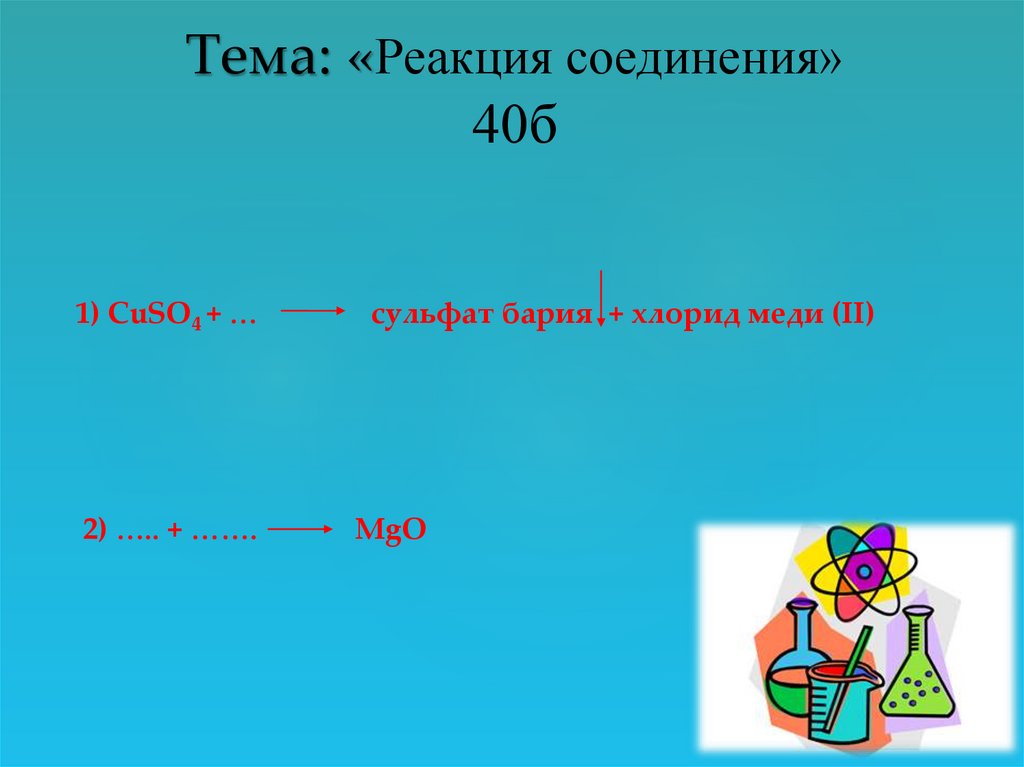
Тема: «Реакция соединения»40б
1) CuSO4 + …
2) ….. + …….
сульфат бария + хлорид меди (II)
MgO
26.
Тема: «Реакция соединения»50б
1) сульфат меди (II) + хлорид бария
2) углерод + кислород
….
….+…..
27.
Тема: «Реакция разложения»30б
1) FeCl3 + 2 NaOH → Fe (OH)3 + NaCl
2) KMnO4
K2MnO4 + MnO2 + O2
28.
Тема: «Реакция разложения»40б
1) FeCl3 + 2 NaOH → Fe (OH)3 + хлорид натрия
2) перманганат
калия
K2MnO4
+
оксид
+ O2
марганца ( IV)
29.
Тема: «Реакция разложения»50б
1) Хлорид железа (III) + 2 NaOH → гидроксид железа (III) + NaCl
2) перманганат калия
K2MnO4 + MnO2 + …..
30.
Расстановка коэффициентов методомэлектронного баланса
Zn0 + 2H+1Cl-1
восстановитель Zn0 - 2e- =
Zn+2Cl-12 + H02
Zn+2
1
окисление
1
восстановление
2
окислитель
2H+1 +2e-
=
H02
31.
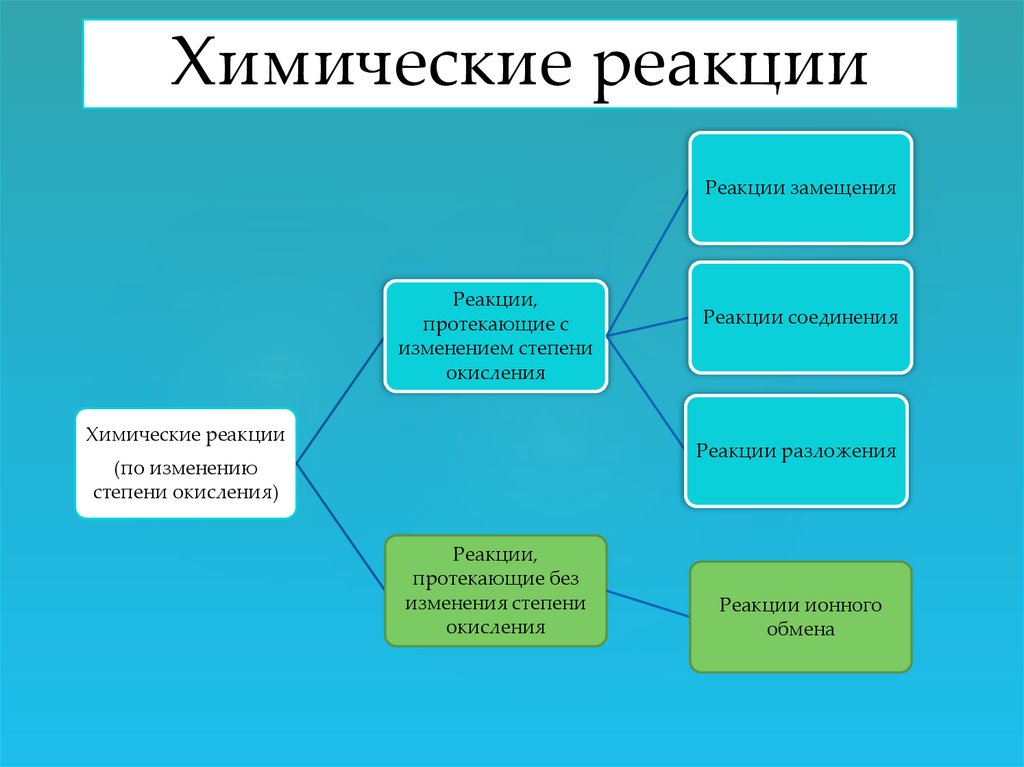
Химические реакцииРеакции замещения
Реакции,
протекающие с
изменением степени
окисления
Химические реакции
Реакции соединения
Реакции разложения
(по изменению
степени окисления)
Реакции,
протекающие без
изменения степени
окисления
Реакции ионного
обмена
32.
Основные понятияпри составлении ОВР
Степень
окисления
Окислитель
Восстановитель
Восстановление
ОВР
Окисление
33.
Окислительно-восстановительныереакции – это
реакции, протекающие
с изменением степени
окисления.
34.
Окислитель-это частица (атом, ион), которая в ходе
окислительно-восстановительного процесса
принимает электроны
Zn0 - 2e- = Zn+2
Восстановитель-
это частица (атом, ион), которая в ходе
окислительно-восстановительного процесса
отдает электроны
2H+1 + 2e-
=
H02
35.
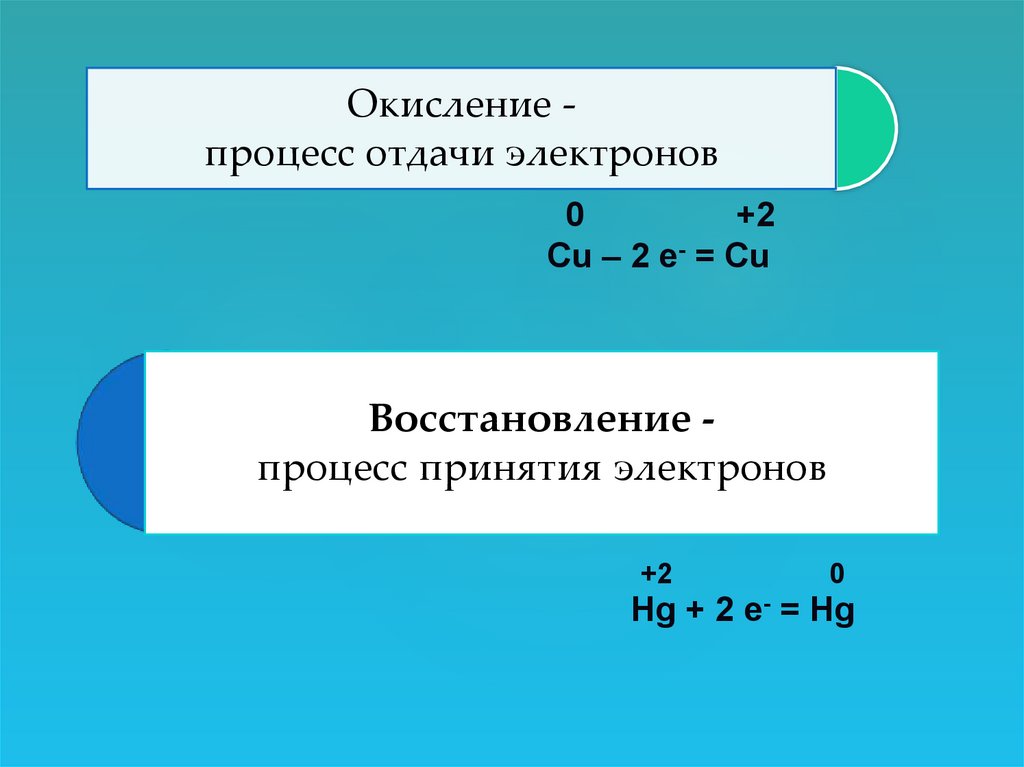
Окисление процесс отдачи электронов0
+2
Cu – 2 e- = Cu
Восстановление процесс принятия электронов
+2
0
Hg + 2 e- = Hg
36.
Проблемная ситуация????
На уроке технологии школьник поранил
руку, педагог обработал рану 3%-м
раствором пероксида водорода.
ОТВЕТ:
Причина, по которой происходит вспенивание,
заключается в том, что клетки крови и непосредственно
кровь содержат фермент, называемый каталазой. Так как
порез или царапина всегда сопровождаются выделением
крови и поврежденными клетками, вокруг раны всегда
образуется много каталазы.
но все-таки, почему перекись водорода пенится на ране?
Когда каталаза контактирует с ней, она превращает
перекись водорода (H2O2) в воду (H2O) и кислород (O2).
37.
Медицина и ОВРОкислительно-восстановительные
реакции активно происходят как на
стадиях разложения организмов, так и
на стадии заживления ран, излечивания
от болезней.
+1
-1
+1
-2
0
Н2О2 → Н2О + О2
38.
РАУНД III «Закрепи»Окисление
30
/восстановитель
40
50
Восстановление
/окислитель
40
50
30
39.
Тема: «Окисление, восстановитель»30б
Дать определение процессу окисления
ОТВЕТ: Процесс окисления – это процесс отдачи
электронов.
40.
Тема: «Окисление, восстановитель»40б
1. определите в данном процессе, сера отдает
или принимает электроны: S-2 ??? 8е - = S+6
2. Сера является восстановителем или
окислителем в данном процессе?
ОТВЕТ: в данном процессе сера отдает электроны: S-2 - 8е - = S+6
является восстановителем
41.
Тема: «Окисление, восстановитель»50б
определите, как изменяется степень окисления у водорода в
реакции
Fe + H2SO4
Fe SO4 + H2
ОТВЕТ: 2Н+1 + 2е - = Н2 0
42.
Тема: Восстановление, окислитель30б
Дать определение процессу восстановления
ОТВЕТ: процессу восстановления – это процесс принятия
электронов.
43.
Тема: Восстановление, окислитель40б
определите, в данном процессе азот отдает или принимает
электроны: N+5 ??? 8е - = N-3
ОТВЕТ: в данном процессе азот
принимает электроны: N+5 + 8е - = N-3
44.
Тема: «Восстановление, окислитель»50б
Какая схема превращения азота
соответствует данному
уравнению реакции
4NH3 +5O 2 → 4NO + 6H2O
1) N+3 → N+2
2) N+3 → N-3
3) N-3 → N-2
4) N-3 → N+2
Ответ: 4






































 chemistry
chemistry








