Similar presentations:
Интегрированный урок по биологии и химии (10 класс)
1.
Стремякова Оксана Александровна, учитель биологииСмирнова Полина Николаевна, учитель химии
2.
3.
«Жизнь – естьспособ
существования
белковых тел»
Ф. Энгельс
4.
Полипептиднуютеорию
строения белков
предложил в 1907 году
немецкий ученый
Э.Фишер.
5.
Выдающим достижениеморганической химии стал
синтез окситоцина –
белкового гормона, который
стимулирует выделение
молока молочными
железами. Он состоит из
остатков 9 аминокислот. В
1932 году американский
биохимик Винсент Виньо
установил его структуру, а в
1954 году осуществил его
полный синтез, за что был
награжден Нобелевской
премией.
6.
В 1945 году английскийбиохимик Фредерик
Сенгер приступил к
изучению природного
белка – инсулина
(гормон поджелудочной
железы, регулирующий
содержание глюкозы в
крови).
7.
Сенгер расшифровалстроение инсулина. Он
состоит из двух
полипептидных цепей,
связанных в двух местах
дисульфидными мостиками.
Одна цепочка состоит из
21аминокислотного остатка,
а 2- из 30. Работа по синтезу
инсулина продолжалась 9 лет,
была завершена в 1963 году и
награждена Нобелевской
премией. Это был триумф
синтетической органической
химии (практический выход
синтетического инсулина был
мал 0,02-0,07%!)
8.
Выход нашел американский химикМеррифилд, он открыл метод
синтеза белков на полимерных
носителях. В 1969 году он получил
сразу несколько полипептидов:
брадикинин (гормон,
оказывающий
сосудорасширяющее действие),
ангиотензин (гормон
повышающий кровяное давление),
рибонуклеазу (фермент,
катализующий гидролиз РНК).
Выход продуктов был настолько
высок, что позволил наладить на
основе автоматизации
промышленное производство
полипептидов
9.
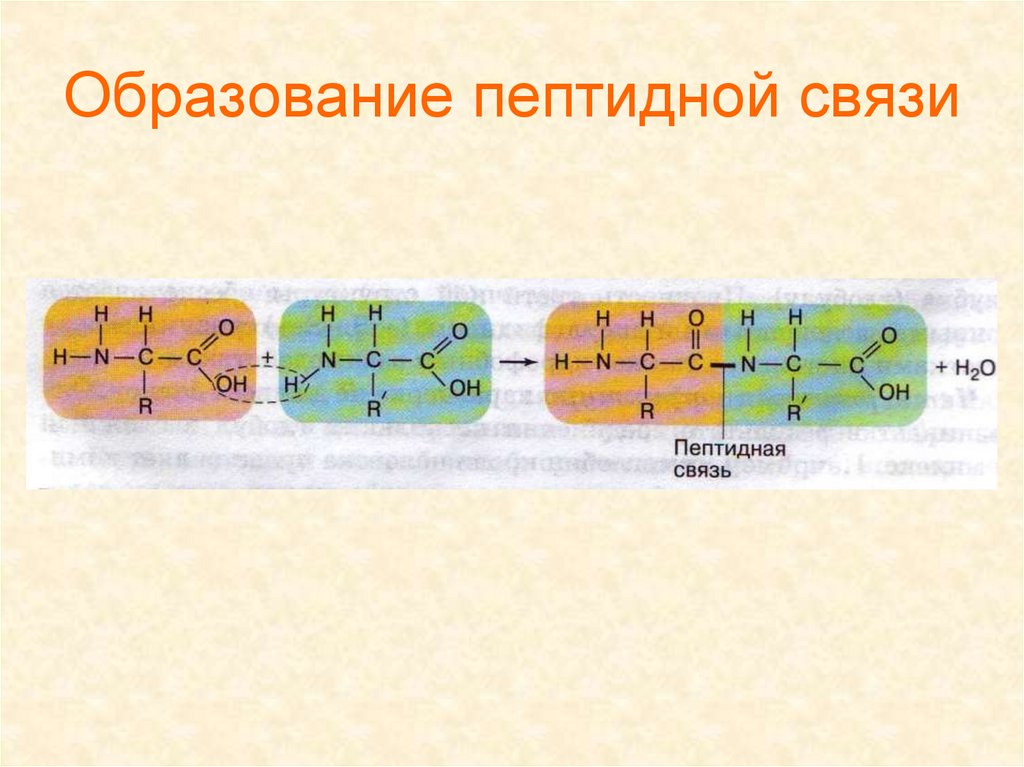
10. Белки - сложные высокомолекулярные природные соединения, построенные из остатков α-аминокислот. Аминокислоты в белках связаны
пептидными связями. Около 20 видоваминокислот входят в состав белков.
11. Разнообразие аминокислот
12. Образование пептидной связи
13.
Протеины(только из белков)
Простые
(только из аминокислот)
Протеиды
(содержат небелковую часть)
Сложные
(гликопротеиды,
липопротеиды,
нуклеопротеиды и др.)
Есть белки, растворимые (например, фибриноген) и нерастворимые
(например, фибрин) в воде.
Есть белки очень устойчивые (например, кератин) и неустойчивые
(например, фермент каталаза с легко изменяющейся структурой).
У белков встречается разнообразная форма молекул — от нитей
(миозин - белок мышечных волокон) до шариков (гемоглобин)
14.
Первичная структура белка – этопоследовательность аминокислот
в полипептидной цепи.
пептидная связь
15.
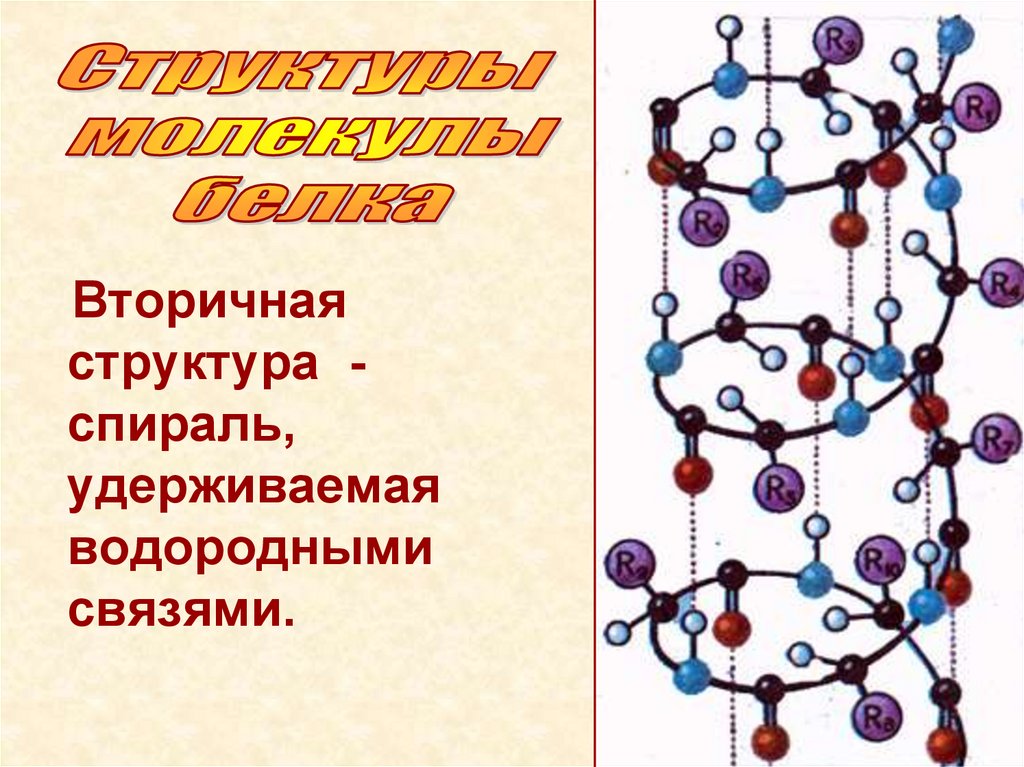
Вторичнаяструктура спираль,
удерживаемая
водородными
связями.
16.
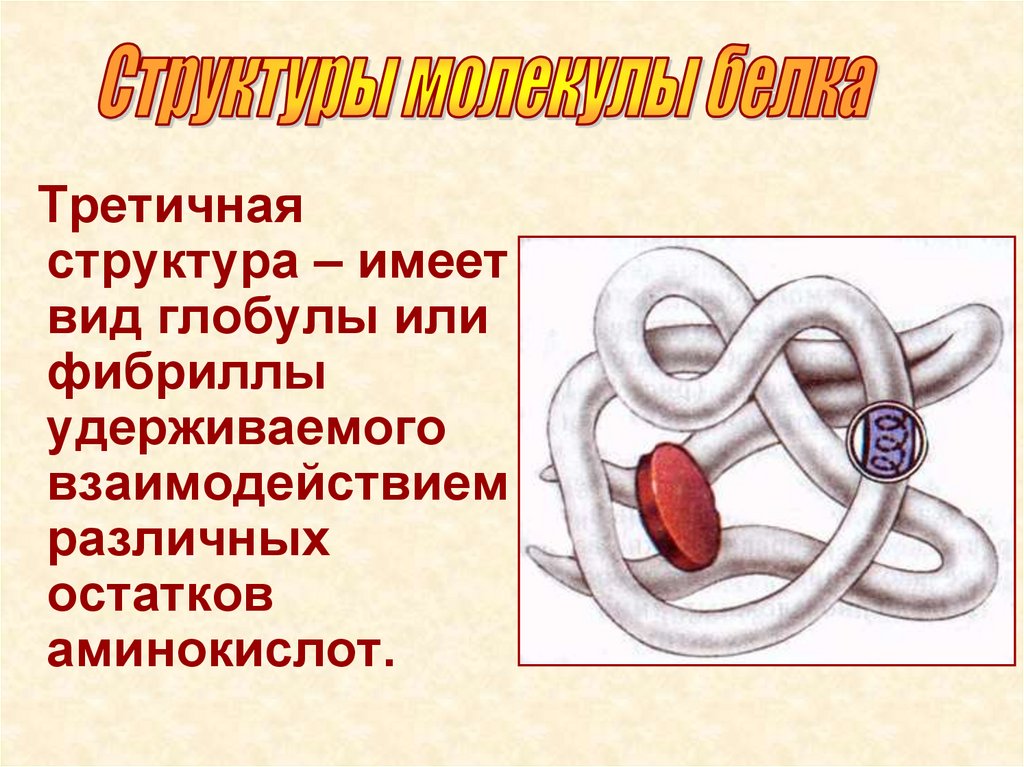
Третичнаяструктура – имеет
вид глобулы или
фибриллы
удерживаемого
взаимодействием
различных
остатков
аминокислот.
17. Дисульфидный мостик
-NH-CH-CO|цистеин
CH2
|
SH
|
S
|
SH
|
CH2
|
цистеин
-CO-CH-NH-
S
|
+H2
18. Сложноэфирный мостик
-NH-CH-CO|CH2
|
OH
серин
|
O
|
COOH
C=O
|
(CH2)2
|
аспарагиновая |
-NH-CH-COкислота
+H2O
19. Солевой мостик
-NH-CH-CO|(CH2)4
|
: N H2
лизин
|
+
N H3
|
-
O
COOH
|
|
(CH2)2
|
аспарагиновая C=O
-CO-CH-NHкислота
|
20.
Четвертичнаяструктура –
характерна
только для
некоторых
белков,
соединяет
несколько
полипептидных
цепей.
21.
• Гидролиз• Денатурация и ренатурация
• Цветные реакции
22. Гидролиз
23.
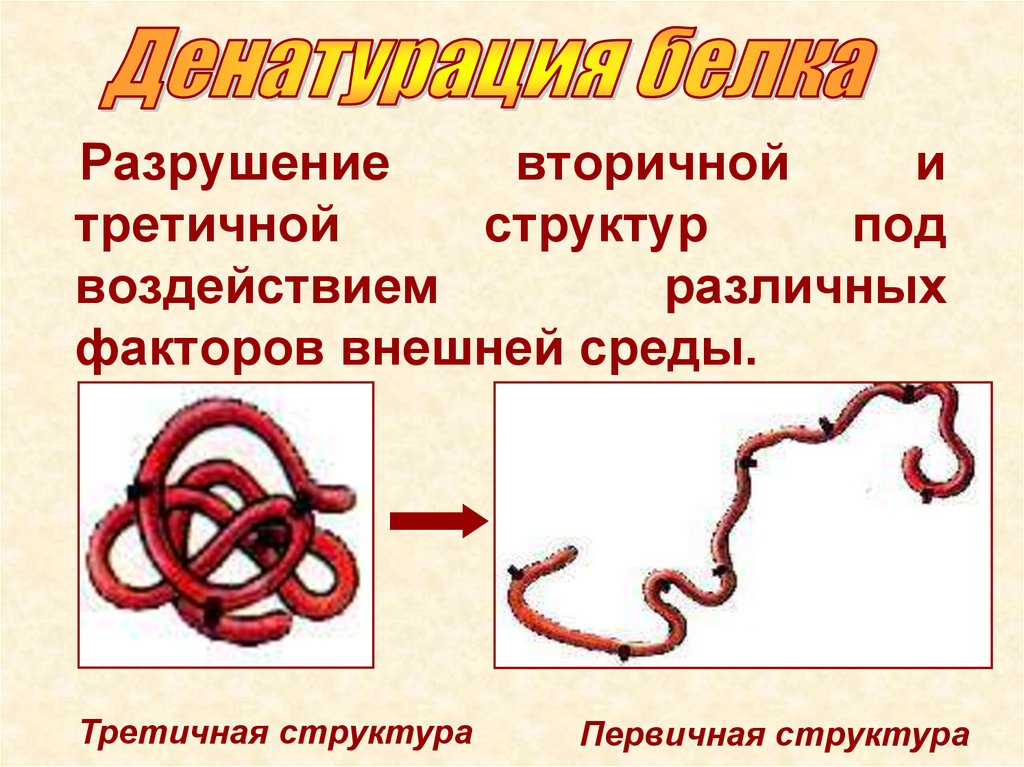
Разрушениевторичной
и
третичной
структур
под
воздействием
различных
факторов внешней среды.
Третичная структура
Первичная структура
24.
под воздействиемвысоких температур
25.
26.
Под действием химических веществ –щелочей, кислот, солей тяжелых металлов,
спиртов.
27.
28.
29.
Ксантопротеиноваяреакция – желтое
окрашивание в
присутствии НNO3
при нагревании.
Биуретовая реакция –
красно – фиолетовое
окрашивание в
присутствии CuSO4.
30. Цветные реакции
31.
• Строительная (структурная) – белки участвуют в образованииоболочки клетки, органоидов и мембран клетки (коллаген, кератин,
эластин, оссеин, актин, тубулин)
• Каталитическая – все клеточные катализаторы – белки (активные
центры фермента) – пепсин, трипсин
• Регуляторная (инсулин, гормон роста)
• Двигательная – сократительные белки вызывают всякое движение
(реснички, жгутики, сокращение мышц – актин и миозин, движение
листьев
• Транспортная – перенос веществ как внутри клетки, так и в организме
в целом (альбумин, глобулин, гемоглобин, миоглобин)
• Защитная – выработка белковых тел (токсины бактерий, растений и
животных) и антител для обезвреживания чужеродных веществ.
(фибриноген, тромбин, интерферон)
• Энергетическая – 1 г белка эквивалентен 17,6 кДж.
• Рецепторная – реакция на внешний раздражитель
• Запасная или питательная (казеин, альбумин, клейковина ,зеин)
32.
СтроительнаяБелки участвуют в образовании всех
мембран и органоидов клетки
(коллаген, кератин, эластин, оссеин, актин, тубулин)
белок
кератин
33.
КаталитическаяВ каждой клетке имеются сотни ферментов.
Они помогают осуществлять биохимические
реакции, действуя как катализаторы
(белки - активные центры фермента) – пепсин, трипсин
34.
ТранспортнаяБелки связывают и переносят
различные
вещества и внутри
клетки, и по всему организму
(альбумин, глобулин, гемоглобин, миоглобин)
Например, г е м о г л о б и н
крови переносит кислород.
35.
РегуляторнаяБелки гормоны регулируют
различные физиологические
процессы
(инсулин, гормон роста)
Например, инсулин регулирует
уровень углеводов в крови.
36.
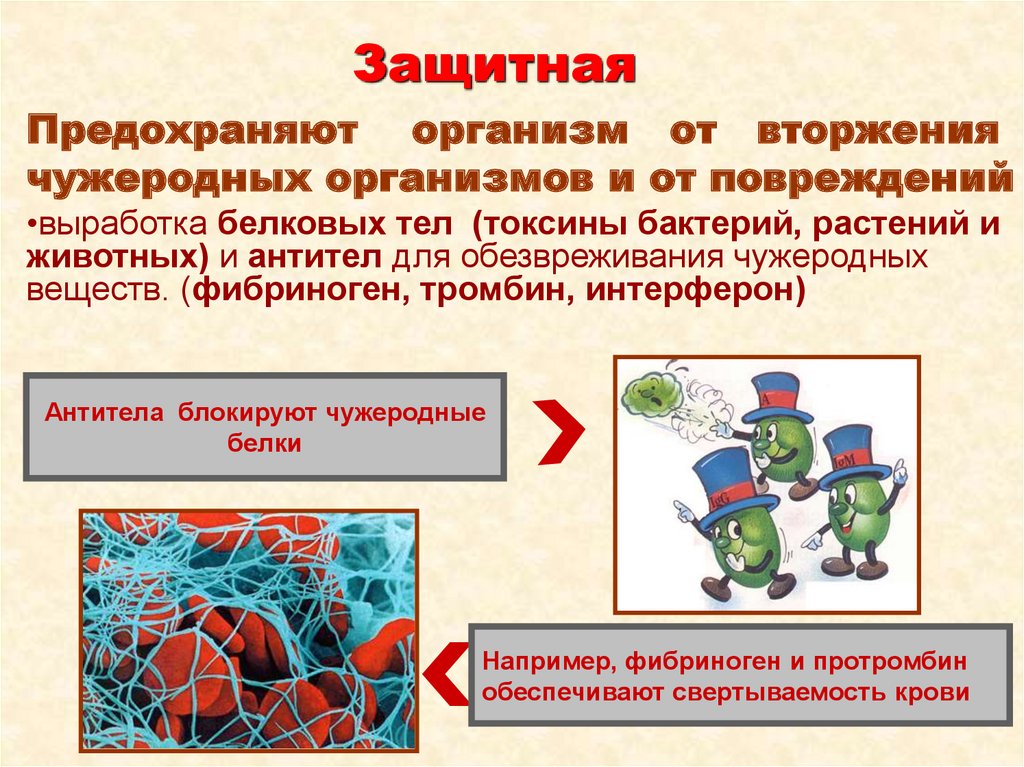
ЗащитнаяПредохраняют организм от вторжения
чужеродных организмов и от повреждений
•выработка белковых тел (токсины бактерий, растений и
животных) и антител для обезвреживания чужеродных
веществ. (фибриноген, тромбин, интерферон)
Антитела блокируют чужеродные
белки
Например, фибриноген и протромбин
обеспечивают свертываемость крови
37.
СократительнаяБелки - участвуют в сокращении
мышечных волокон
•сократительные белки вызывают всякое движение
(реснички, жгутики, сокращение мышц – актин и
миозин, движение листьев)
Актин и миозин – белки мышц
38.
ЭнергетическаяПри недостатке углеводов или жиров
окисляются молекулы аминокислот
При полном расщеплении белка до конечных продуктов
выделяется энергия:
1г белка - 17.6 кДж
Но в качестве источника энергии белки используются крайне редко.
39. Домашнее задание
§11, вопросы на с. 46, записи в тетради(биология)
40.
• Габриелян О.С. и др. Химия 10 класс.• Потапов В.М. Органическая химия (проб учебник)
• Артеменко А.И. Органическая химия (учебник для
высших учеб. зав.)
• Книга для чтения по органической химии/ сост.
П.Ф.Буцкус.
• Каменский А.А. и др. Биология. Общая биология 1011 класс
• Чебышев Н.В. и др. Биология для поступающих в
ВУЗы
• Богданова Т.Л. Биология. Задания и упражнения.
Пособие для поступающих в Вузы
• Пименов А.В., Гончаров О.В. Биология. Пособие для
поступающих в Вузы


































 biology
biology