Similar presentations:
Химический состав клетки: белки, их строение, свойства и функции. Урок 9-10. 10 класс
1.
УРОК 9 – 10, 10 классХимический состав клетки: белки,
их строение, свойства и функции.
Д/З 3.2.1
2.
«Я всегда говорил и не устаю повторять, чтомир бы не мог существовать, если бы был
так просто устроен». (И.В.Гёте).
20.01.2006
Презентация
Стр. 2
3.
Количество белковВ организме бактерии примерно 3-4 тыс. разных
белков, а у млекопитающих - уже около 50
тысяч.
20.01.2006
Презентация
Стр. 3
4.
Примеры белковБелок интерферон применяется при лечении
насморка и гриппа, т.к. убивает вызывающие эти
болезни вирусы.
Альбумин - яичный белок ,
кератин - рога, шерсть ,
коллаген - кожа ,
гемоглобин – кровь,
фибрин, фибриноген - кровь ,
пепсин - желудочный сок ,
трипсин - поджелудочный сок ,
миозин – мышцы,
глобулин - вакцина ,
родопсин - зрительный пурпур ,
лиозин - слюна ,
инсулин - поджелудочная железа.
20.01.2006
Презентация
Стр. 4
5.
История изучения белковВ 1745 году итальянский учёный Беккари
опубликовал отчёт об исследовании
клейковины, выделенной из пшеничной муки.
По своим свойствам она напоминала вещества,
которые можно получить из животных
продуктов. Например, яичный белок, поэтому
этот класс веществ он назвал белками
20.01.2006
Презентация
Стр. 5
6.
В XIX в. Голландский учёный – химик и врач –Мульдер, который изучал состав белков,
предложил второй термин для обозначения
этой группы веществ – «протеин» (греч.
«про'тос» - «первый», «важнейший»),
20.01.2006
Презентация
Стр. 6
7.
В 1888 году русский биохимик А.Я.Данилевскийвысказал мысль о том, что белки состоят из
остатков аминокислот, соединённых амидной
или пептидной связью.
Это было подтверждено в 1902 году немецким
учёным Фишером. В 1907г. он синтезировал
полипептид, содержащий 18 аминокислотных
остатков.
20.01.2006
Презентация
Стр. 7
8.
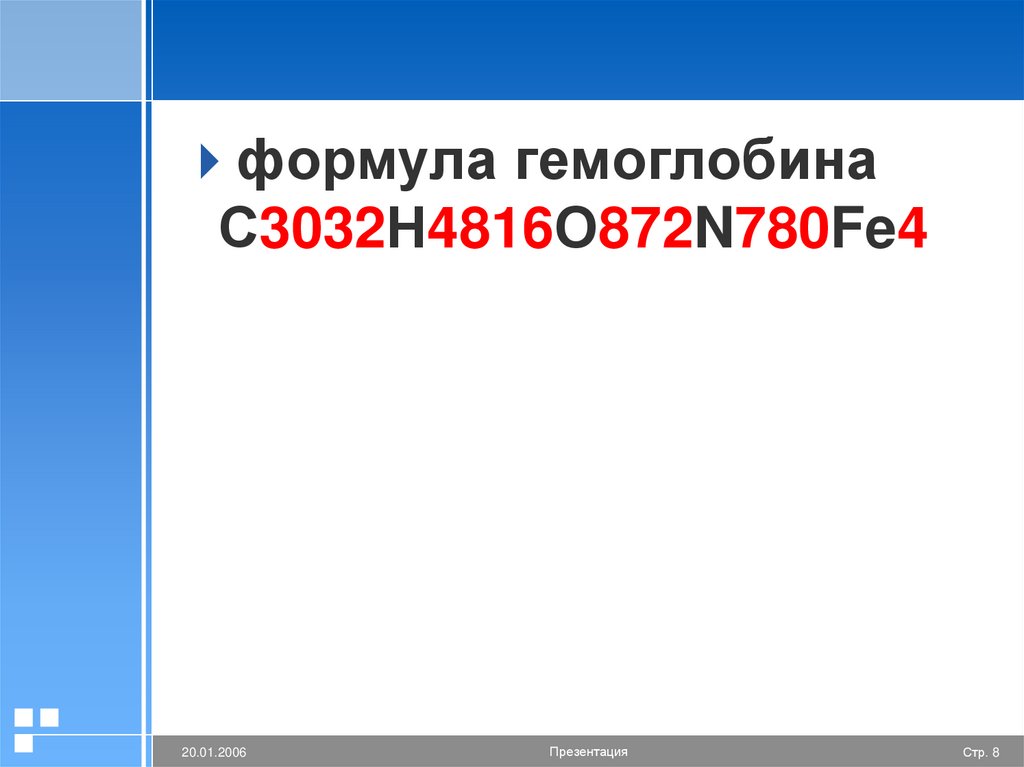
формула гемоглобинаС3032Н4816О872N780Fe4
20.01.2006
Презентация
Стр. 8
9.
Химический составОсновные химические элементы, входящие в
состав белков
С(углерод) – 50%
O(кислород) – 17-24%
H(водород) – 6,5-7,3%
N(азот) – 15-18%
S(сера) – 0,2-2,4%
20.01.2006
Презентация
Стр. 9
10.
Белки– это сложные органические вещества с
высокой молекулярной массой ( свыше
10 000), это биополимеры, полипептиды,
состоящие из остатков всего 20 различных
α - аминокислот.
В среднем длина белка 300 аминокислот.
20.01.2006
Презентация
Стр. 10
11.
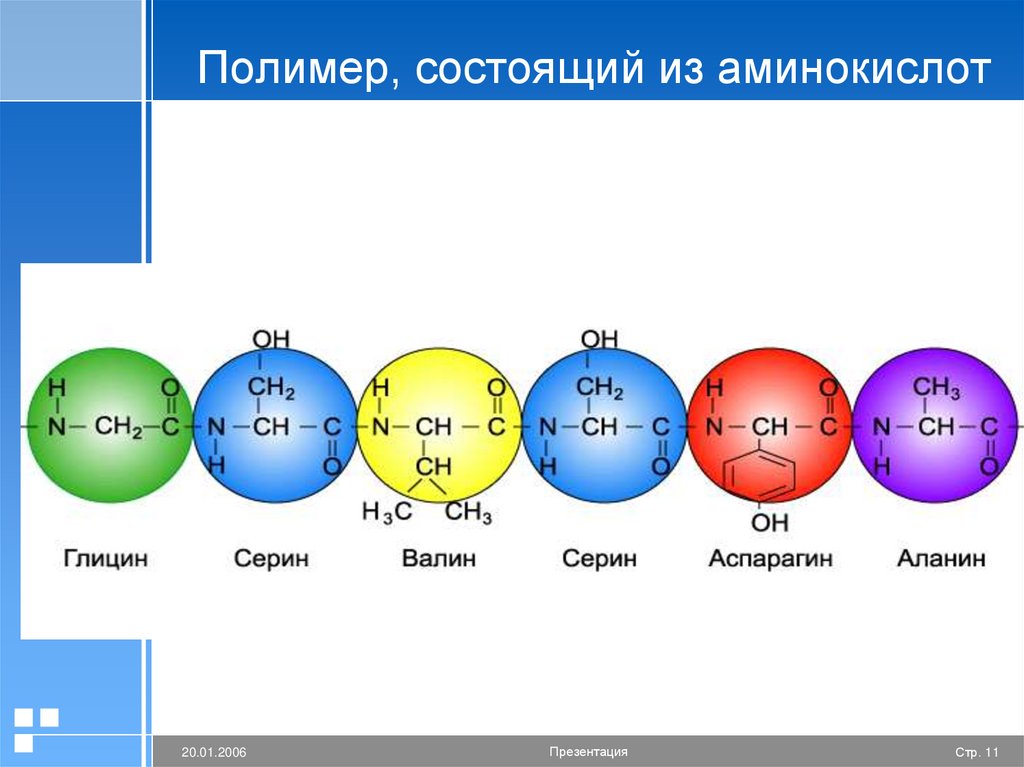
Полимер, состоящий из аминокислот20.01.2006
Презентация
Стр. 11
12.
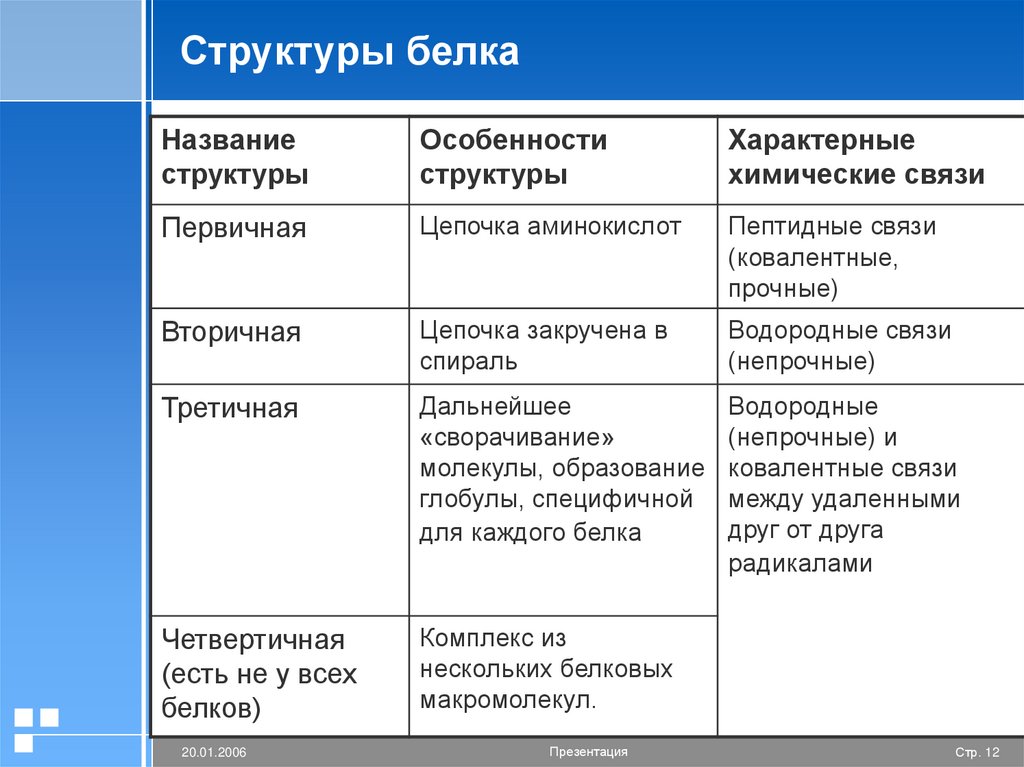
Структуры белкаНазвание
структуры
Особенности
структуры
Характерные
химические связи
Первичная
Цепочка аминокислот
Пептидные связи
(ковалентные,
прочные)
Вторичная
Цепочка закручена в
спираль
Водородные связи
(непрочные)
Третичная
Дальнейшее
«сворачивание»
молекулы, образование
глобулы, специфичной
для каждого белка
Водородные
(непрочные) и
ковалентные связи
между удаленными
друг от друга
радикалами
Четвертичная
(есть не у всех
белков)
Комплекс из
нескольких белковых
макромолекул.
20.01.2006
Презентация
Стр. 12
13.
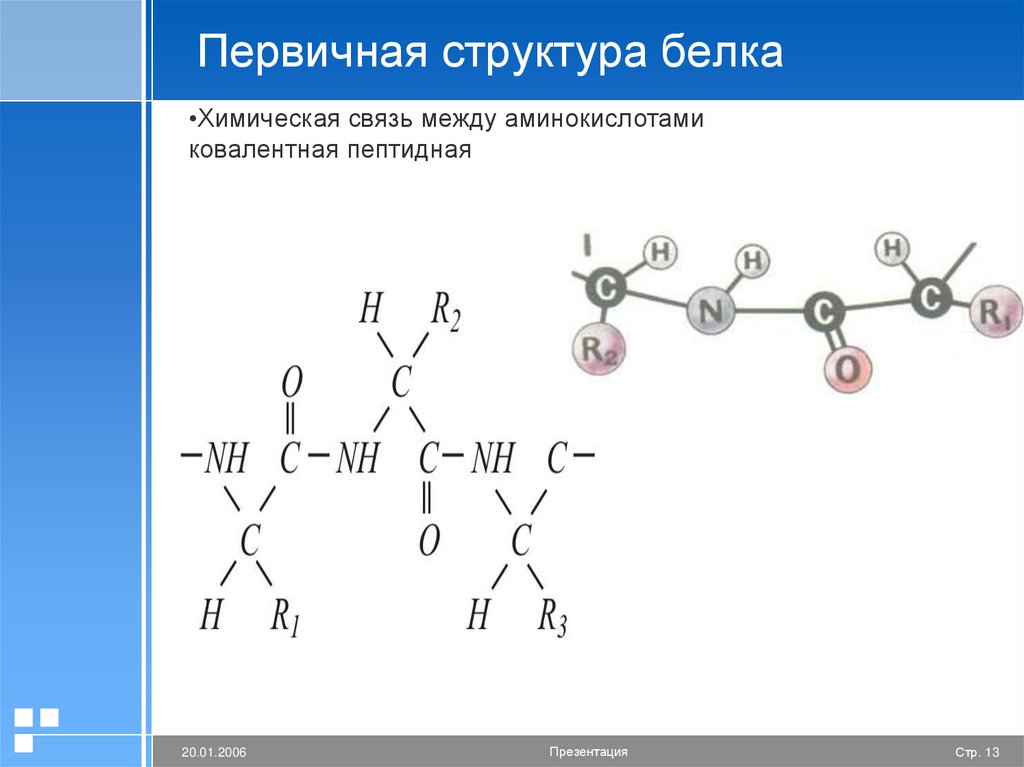
Первичная структура белка•Химическая связь между аминокислотами
ковалентная пептидная
20.01.2006
Презентация
Стр. 13
14.
20.01.2006Презентация
Стр. 14
15.
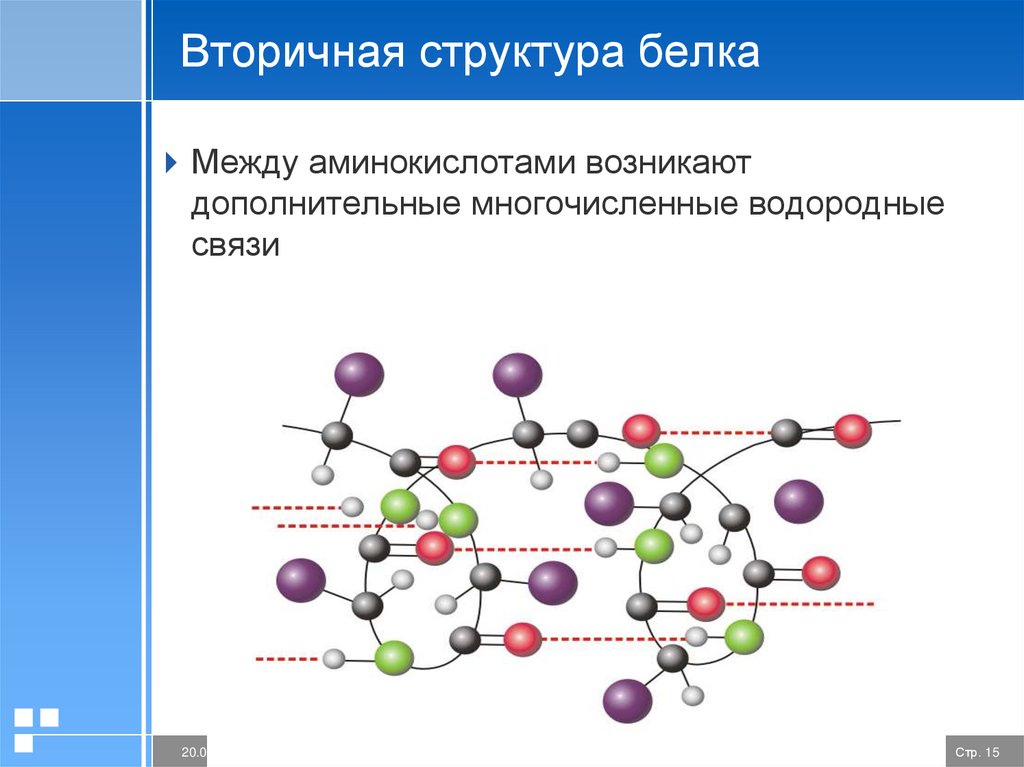
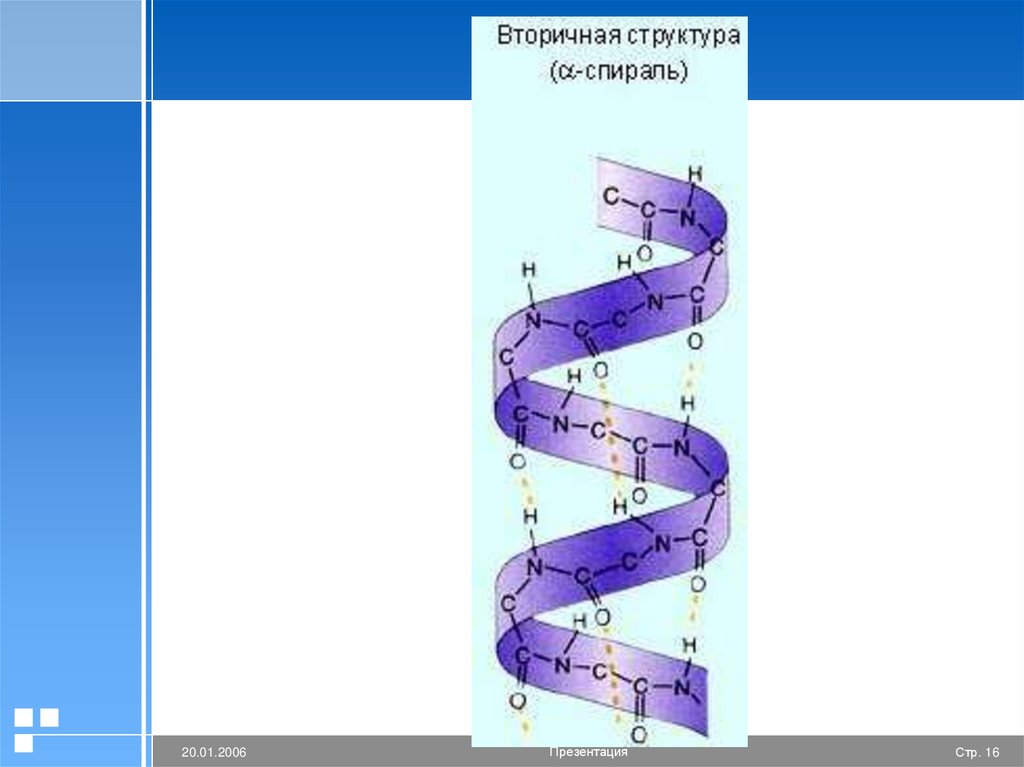
Вторичная структура белкаМежду аминокислотами возникают
дополнительные многочисленные водородные
связи
20.01.2006
Презентация
Стр. 15
16.
20.01.2006Презентация
Стр. 16
17.
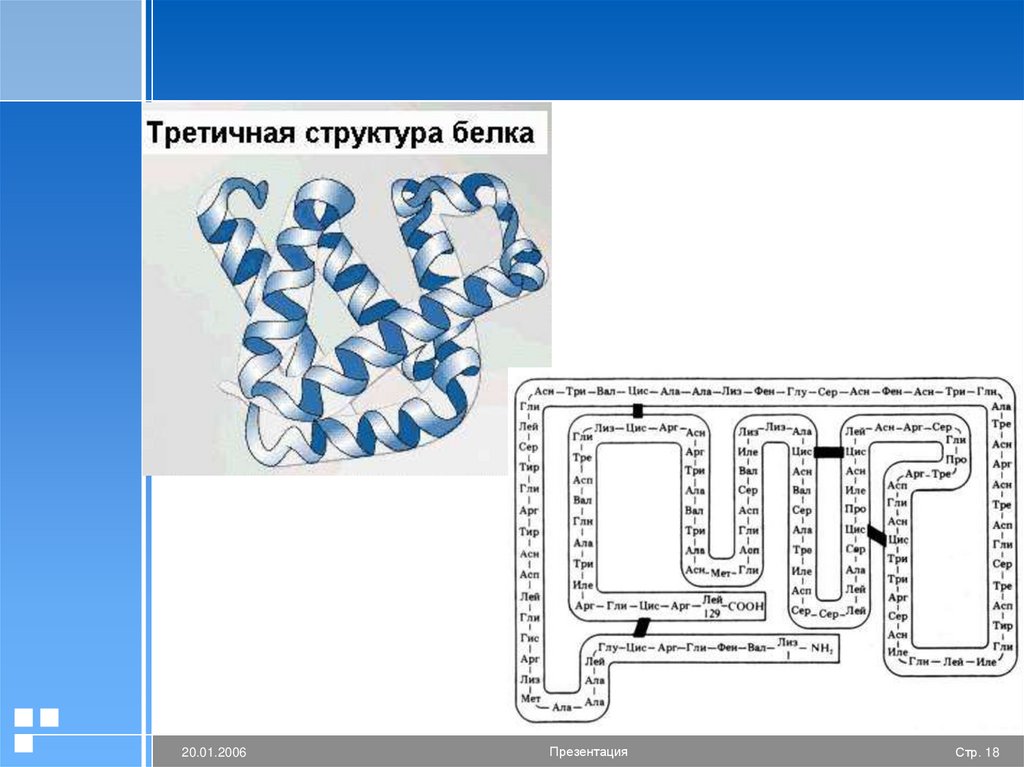
Третичная структура белкаОбразована дисульфидными (S-S-),
гидрофобными и ионными связями
20.01.2006
Презентация
Стр. 17
18.
20.01.2006Презентация
Стр. 18
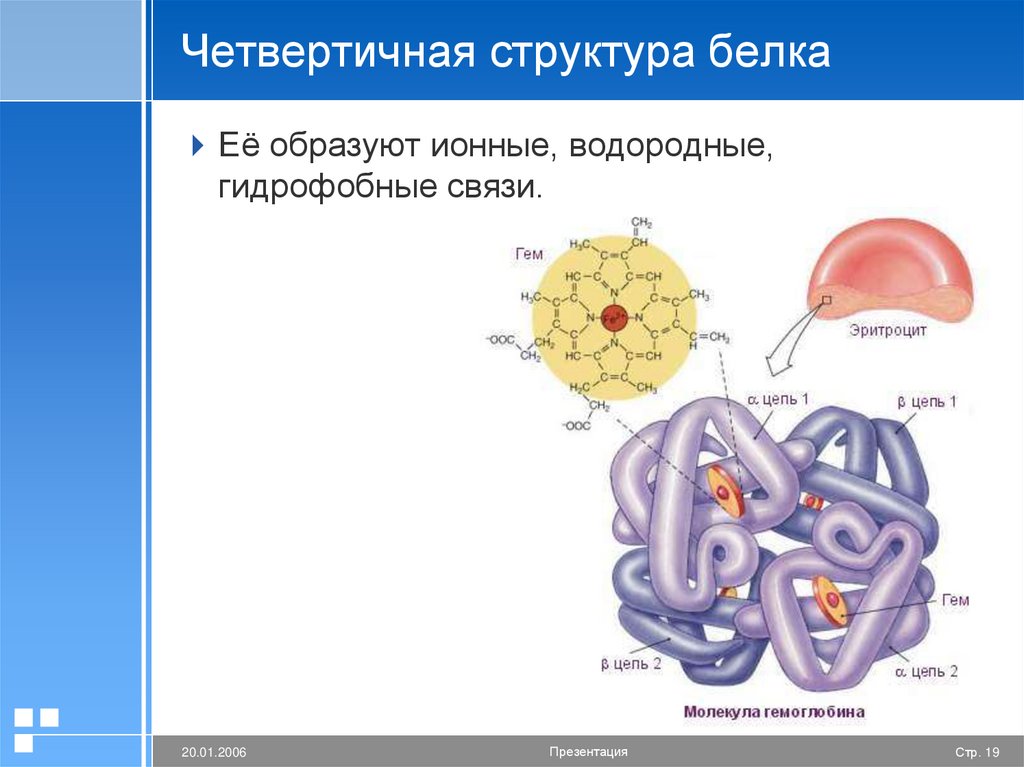
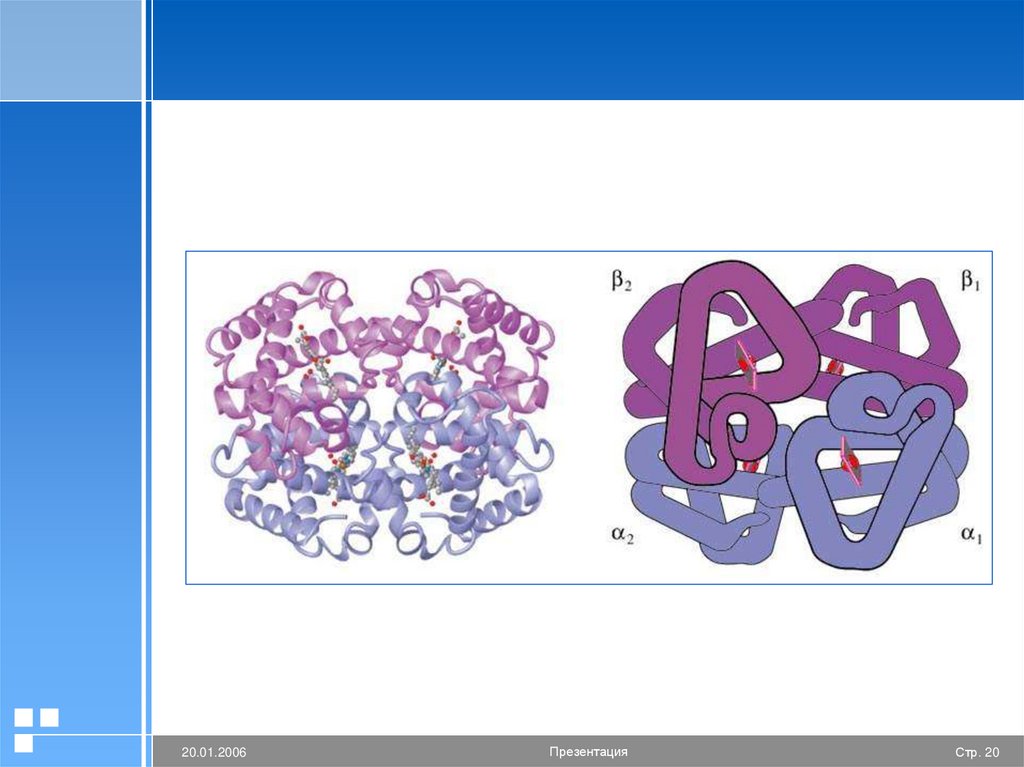
19.
Четвертичная структура белкаЕё образуют ионные, водородные,
гидрофобные связи.
20.01.2006
Презентация
Стр. 19
20.
20.01.2006Презентация
Стр. 20
21.
Классификация белковК простым относятся белки, состоящие
только из аминокислот, сывороточный
альбумин крови, иммуноглобулин
(антитела), фибрин, некоторые ферменты
(трипсин)
а к сложным - содержащие белковую часть и
небелковую (простатическую) - ионы металлов,
углеводы, липиды и др. Все протеолипиды и
гликопротеиды, гемоглобин, большинство
ферментов и т. д.
20.01.2006
Презентация
Стр. 21
22.
Функция белковСтруктурная.
Белки входят в состав клеточных
мембран и органелл клетки. Стенки
кровеносных сосудов, хрящи,
сухожилия, волосы, ногти, когти у
высших животных состоят
преимущественно из белков.
20.01.2006
Презентация
Стр. 22
23.
Каталитическая(ферментативная).
Белки-ферменты катализируют протекание всех
химических реакций в организме. Они
обеспечивают расщепление питательных
веществ в пищеварительном тракте, фиксацию
углерода при фотосинтезе, реакции матричного
синтеза и т. п.
20.01.2006
Презентация
Стр. 23
24.
Транспортная.Белки способны присоединять и переносить
различные вещества. Альбумины крови
транспортируют жирные кислоты, глобулины ионы металлов и гормоны. Гемоглобин
переносит кислород и углекислый газ.
Молекулы белков, входящие в состав
плазматической мембраны, принимают участие
в транспорте веществ в клетку и из нее.
20.01.2006
Презентация
Стр. 24
25.
Защитная.Ее выполняют иммуноглобулины (антитела)
крови, обеспечивающие иммунную защиту
организма. Фибриноген и тромбин участвуют в
свертывании крови и предотвращают
кровотечение.
20.01.2006
Презентация
Стр. 25
26.
Сократительная.Обеспечивается движением относительно друг
друга нитей белков актина и миозина в мышцах
и внутри клеток. Скольжение микротрубочек,
построенных из белка тубулина, объясняется
движение ресничек и жгутиков.
20.01.2006
Презентация
Стр. 26
27.
Регуляторная.Многие гормоны являются олигопептидами или
белками, например: инсулин, глюкагон,
аденокортикотропный гормон и др.
20.01.2006
Презентация
Стр. 27
28.
Рецепторная.Некоторые белки, встроенные в клеточную
мембрану, способны изменить свою структуру
на действие внешней среды. Так происходят
прием сигналов из внешней среды и передача
информации в клетку. Примером может служить
фитохром - светочувствительный белок,
регулирующий фотопериодическую реакцию
растений, и опсин - составная часть родопсина пигмента, находящегося в клетках сетчатки
глаза.
20.01.2006
Презентация
Стр. 28
29.
Свойства белков.Денатурация. Под денатурацией
подразумевают утрату трехмерной
конформации, присущей данной белковой
молекуле. Вызывать денатурацию белков могут
разнообразные факторы: нагревание или
воздействие каких-либо излучений; сильные
кислоты, сильные щелочи или
концентрированные растворы солей; тяжелые
металлы; органические растворители.
20.01.2006
Презентация
Стр. 29
30.
Денатурация.20.01.2006
Презентация
Стр. 30
31.
РенатурацияИногда денатурированный белок в подходящих
условиях вновь спонтанно приобретает свою
структуру. Этот процесс называется
ренатурацией. Ренатурация показывает, что
третичная структура белка полностью
определяется его первичной структурой.
20.01.2006
Презентация
Стр. 31
32.
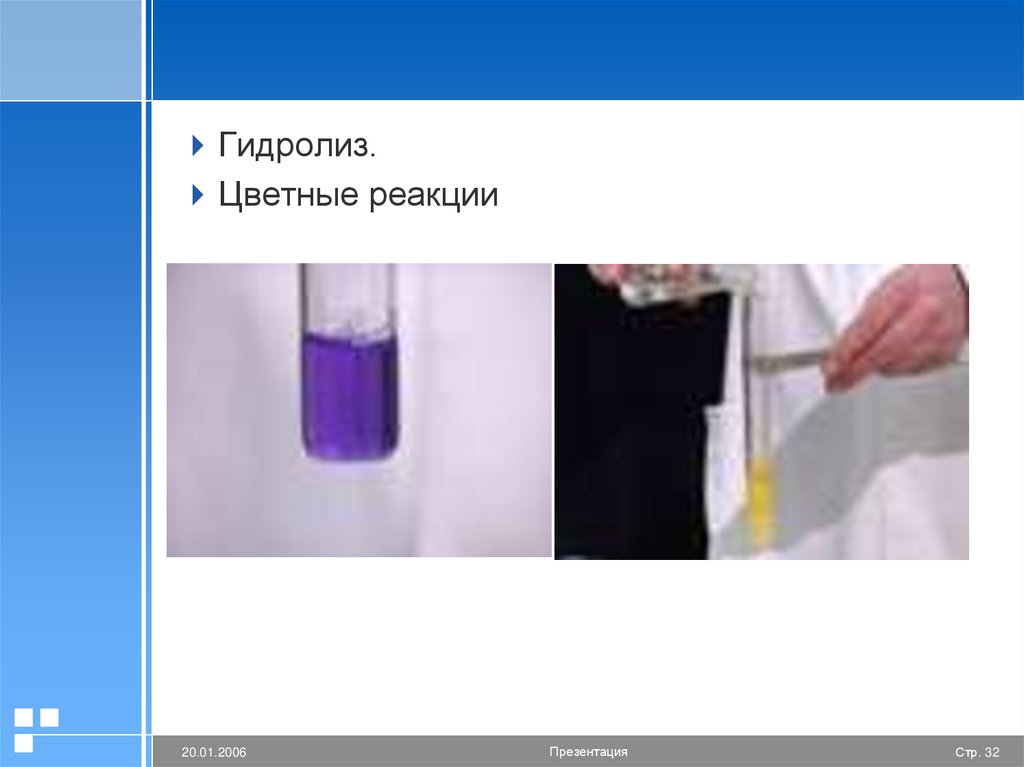
Гидролиз.Цветные реакции
20.01.2006
Презентация
Стр. 32



















 biology
biology chemistry
chemistry








