Similar presentations:
Біоенергетика. АТФ, потенціали, молекулярні машини
1. Біоенергетика
АТФ, потенціали, молекулярні машини2. Як ефективно використовувати енергію у мікромасштабах ?
• Неможливість заощадження механічної енергії• Ентропія
• Електричні ефекти
• Хімічна енергія
• Молекулярні машини
3. І - В’язкість
• Неможливість використовувати інерційну енергію:- При зменшенні маси об’єктів, сили в’язкості
рідкого середовища ефективно гасять інерційний рух
(гідродинаміка при малих числах Рейнольдса).
Лосось рухається надаючи прискорення
воді, що його оточує.
Бактерія створює напруження зсуву для
переміщення у в’язкому середовищі.
Характерна довжина її інерційного руху ~ 10-12 м
VS
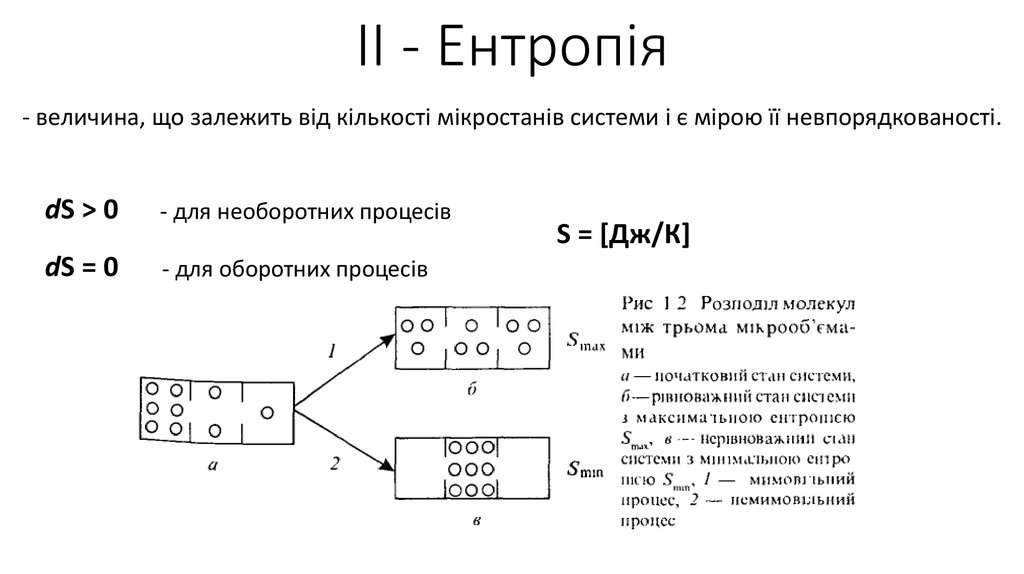
4. ІІ - Ентропія
- величина, що залежить від кількості мікростанів системи і є мірою її невпорядкованості.dS ˃ 0
- для необоротних процесів
dS = 0
- для оборотних процесів
S = [Дж/К]
5. ІІ - Ентропія
Q=U+A- Перший закон термодинаміки:
Теплота Q, яку було поглинуто системою із зовнішнього
середовища, використовується на збільшення внутрішньої енергії U
та роботи проти зовнішніх сил A.
А = А’max + pv - У загальному випадку А включає в себе роботу проти сил зовнішнього
тиску pv та максимальну роботу під час хімічної реакції А’max .
F = U – TS
G = U – TS + pv
pv -> 0
ΔG ≈ ΔF
- Вільна енергія Гіббса ΔG та Гельмгольца ΔF характеризує напрямок розвитку
процесу, різницю між рівноважними станами (для рівноважної системи) або
є мірою розсіювання енергії для нерівноважної системи.
6. ІІ – Ентропія – гідрофобний ефект
- Енергетичний баланс заміщенняводневого зв’язку пептид-вода на пептидпептид збільшує кількість станів свободи
молекул води. Це збільшує ентропію і тому
є енергетично вигідним.
- Збільшення ентропії розчинника
компенсує зменшення ентропії
поліпептиду.
- Енергетичний бар’єр такого переходу
невеликий – близько 6.2 КДж/моль,
тому водневі зв’язки білків
знаходяться близько «межі стабільності»
7.
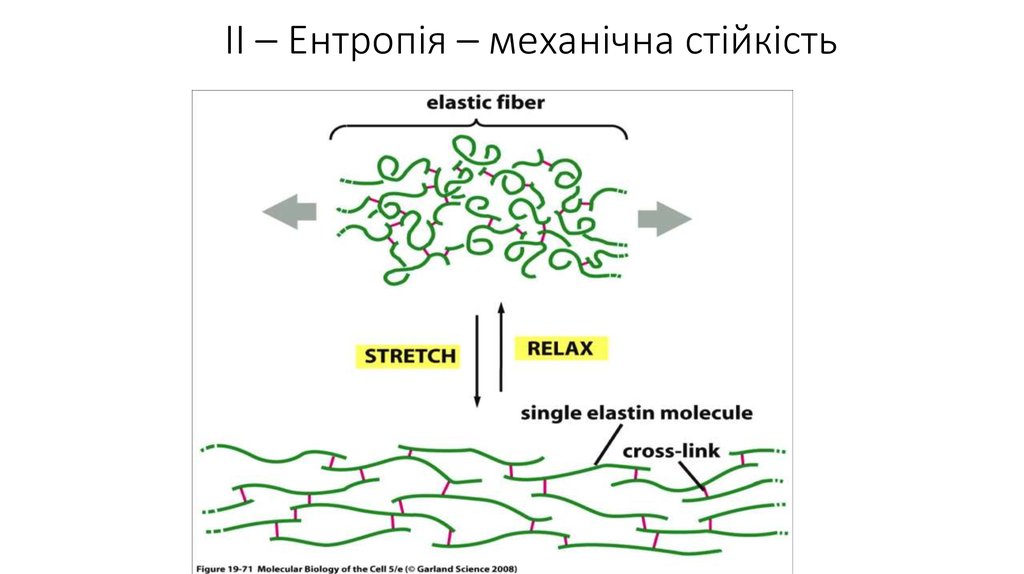
ІІ – Ентропія – механічна стійкість8.
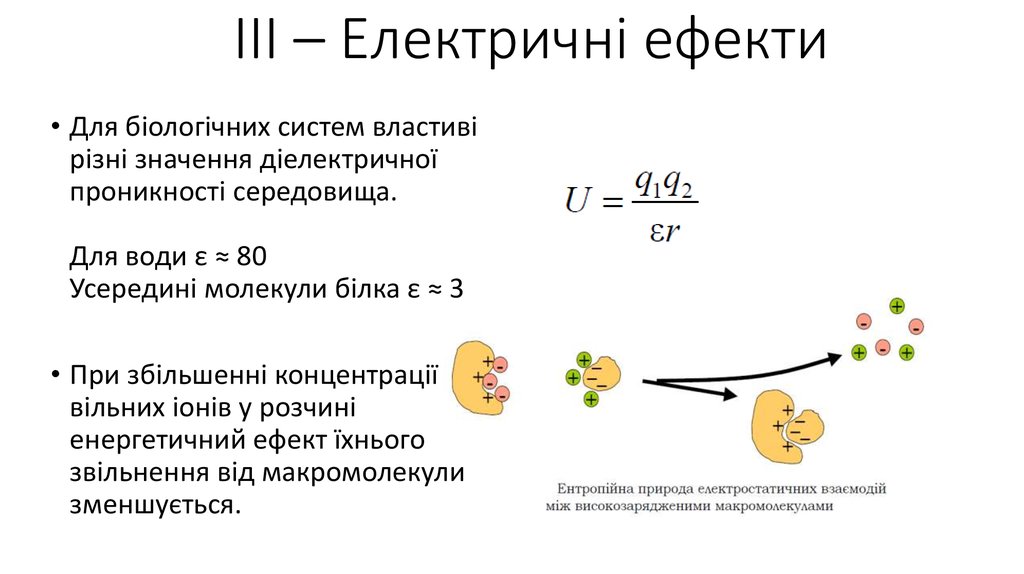
ІІI – Електричні ефекти• Для біологічних систем властиві
різні значення діелектричної
проникності середовища.
Для води ε ≈ 80
Усередині молекули білка ε ≈ 3
• При збільшенні концентрації
вільних іонів у розчині
енергетичний ефект їхнього
звільнення від макромолекули
зменшується.
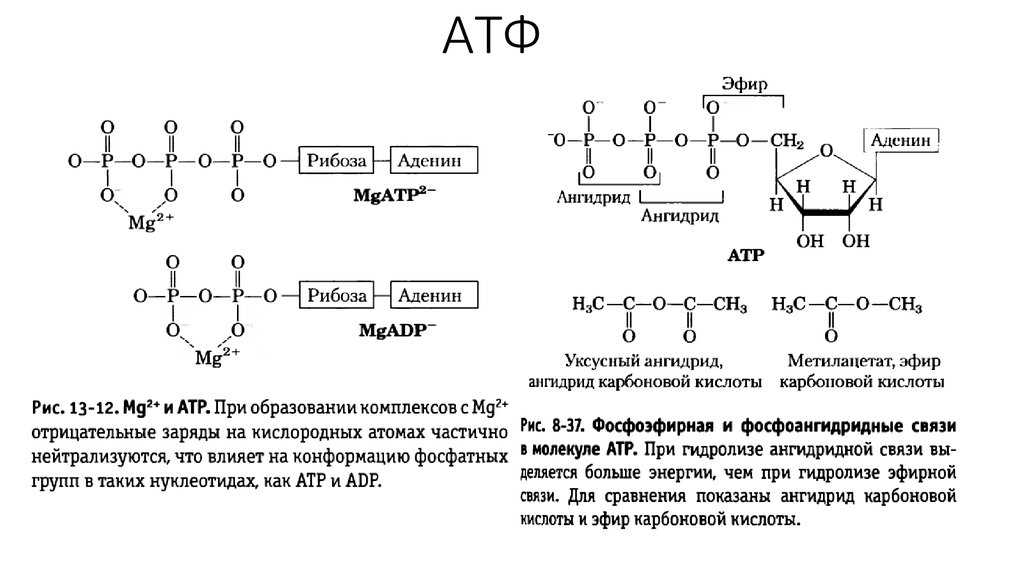
9. АТФ
10. АТФ
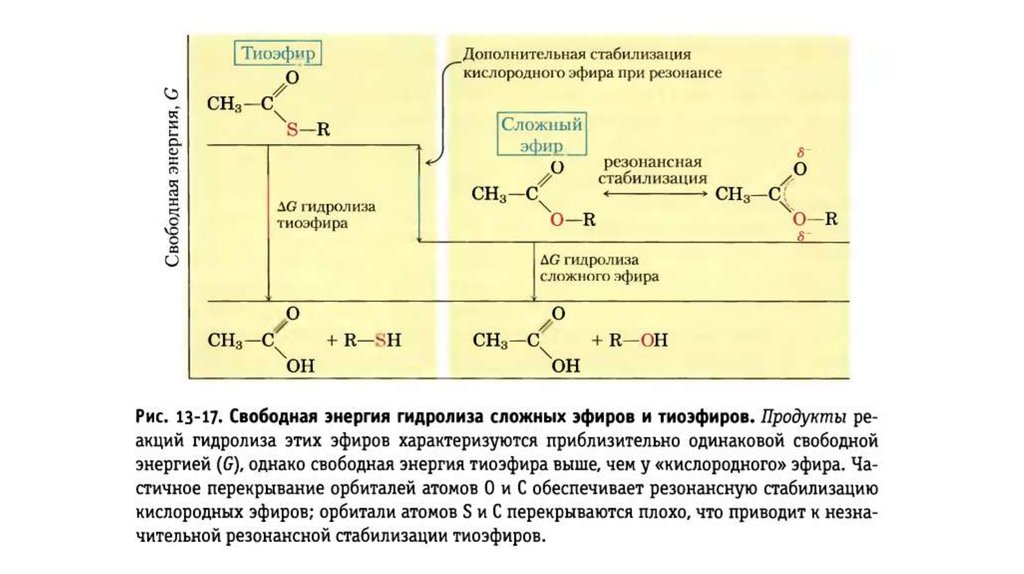
• Енергетичний ефект гідролізу АТФ:1) Зниження електростатичного відштовхування
2) У продуктів гідролізу більше резонансних
форм, що стабілізують ці продукти.
3) Іонізація АДФ2- із вивільненням протонів у
середовище
4) Продукти Рі + АДФ є більш гідратованими,
отже стабільнішими ніж АТФ.
Енергетичний ефект залежить від концентрацій
компонентів реакції у клітині, що не є
універсальною величиною.
11.
12.
13.
Енергетичний ефект гідролізу АТФ:- Перенесення Рі, РРі або АМР на продукт первинної
реакції збільшує енергію інтермедіату і забеспечує
подальший перебіг реакції.
- Прямий гідроліз АТФ відбувається у таких процесах як:
скорочення м’язів, роботі геліказ, Rec-A білків та деяких
топоізомераз.
Його функція – конформаційне перемикання.
- Сигнальні ГТФази також використовують прямий
гідроліз.
-
Через високу (200-400 КДж/моль) енергію активації
гідролізу АТФ є кінетично стабільним у водному
розчині !
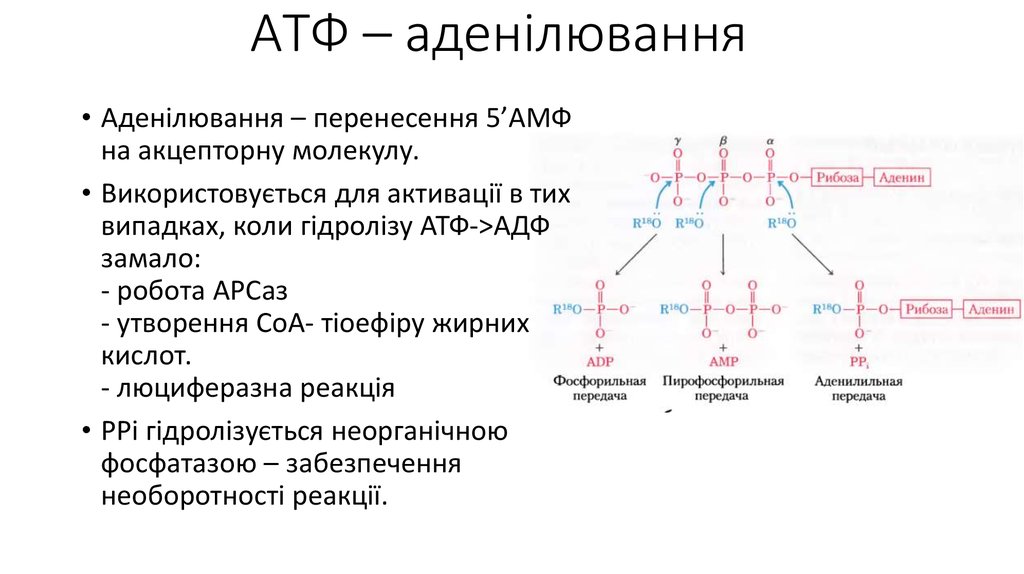
14. АТФ – аденілювання
• Аденілювання – перенесення 5’АМФна акцепторну молекулу.
• Використовується для активації в тих
випадках, коли гідролізу АТФ->АДФ
замало:
- робота АРСаз
- утворення СоА- тіоефіру жирних
кислот.
- люциферазна реакція
• РРі гідролізується неорганічною
фосфатазою – забезпечення
необоротності реакції.
15.
Електрохімічна енергія- Якщо у розчині присутні дві редокс-пари, то
перенесення електрону від донора однієї пари до
акцептора іншої відбувається спонтанно.
Напрямок такої окисно-відновної реакції визначається
зміною енергії, яка характеризується окисно-відновним
потенціалом.
16.
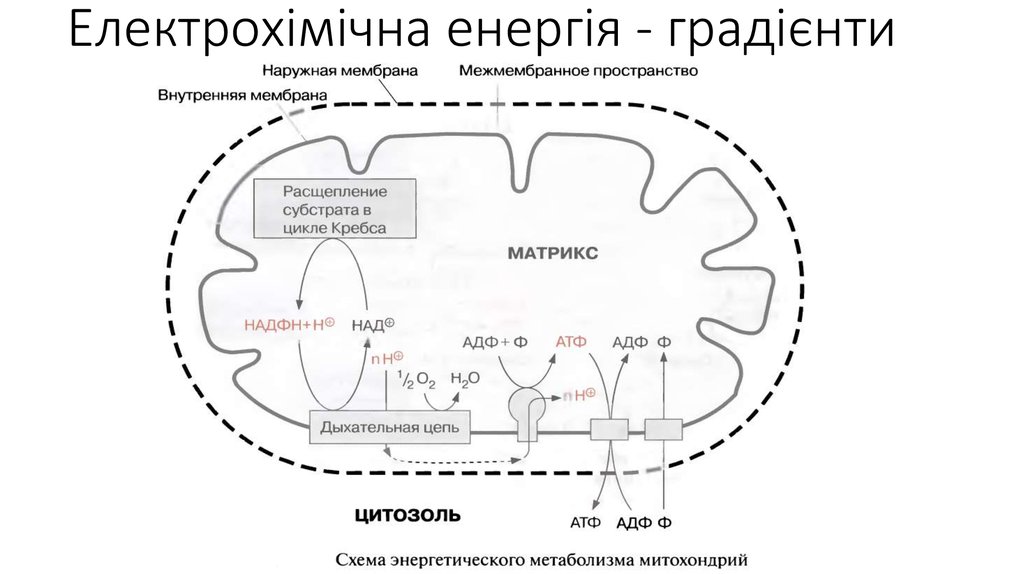
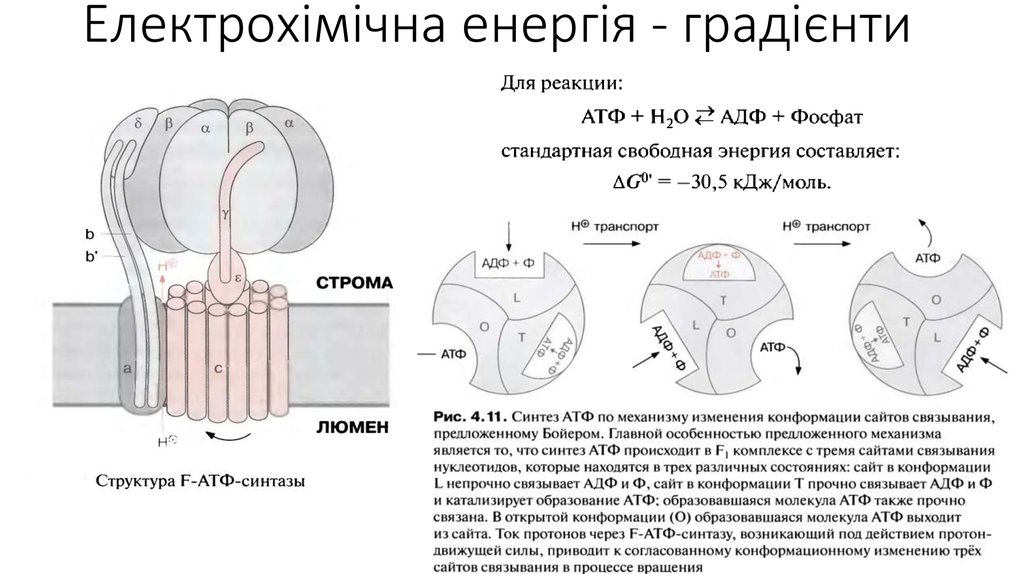
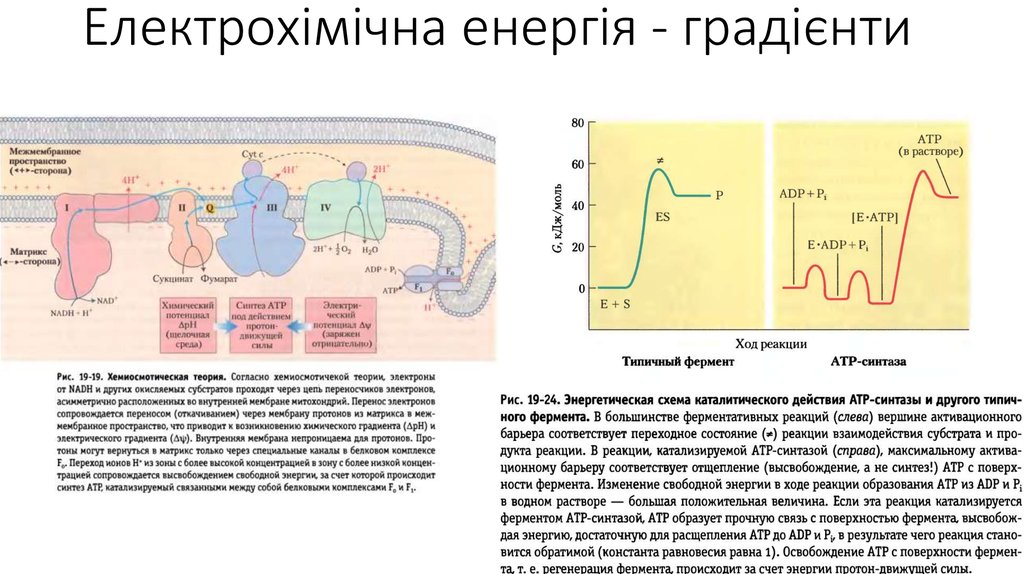
17. Електрохімічна енергія - градієнти
18.
Електрохімічна енергія - градієнти19. Електрохімічна енергія - градієнти
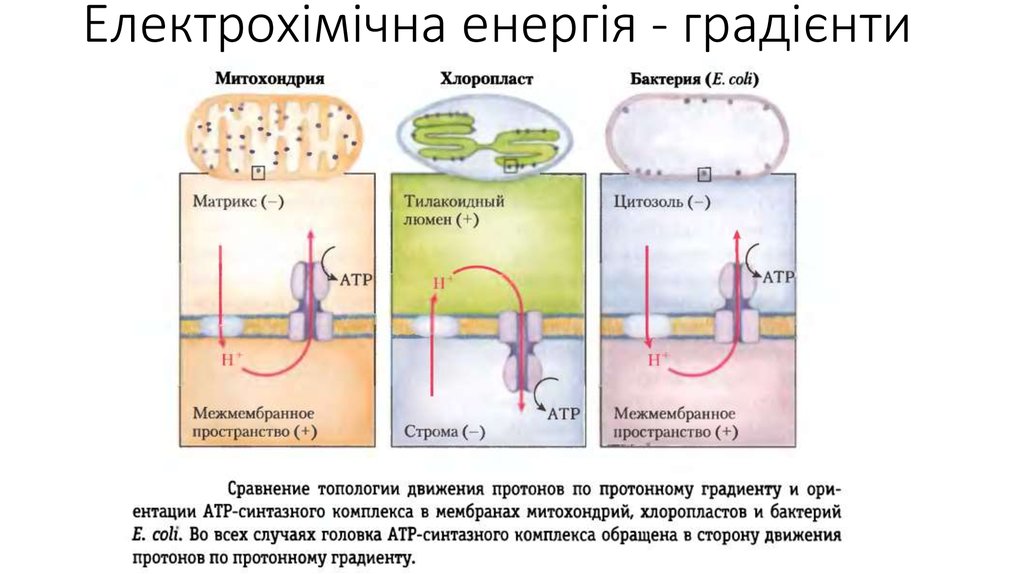
20.
Електрохімічна енергія - градієнти21. Електрохімічна енергія - градієнти
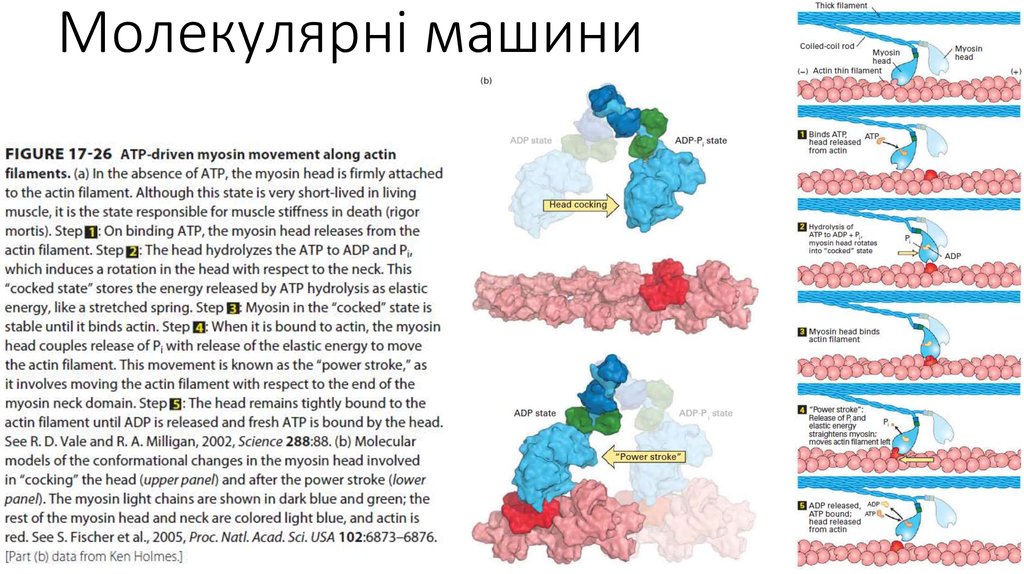
22. Молекулярні машини
• Молекулярна машина піддається тепловому руху своїхвласних частин і зовнішніх молекул
• Конформаційна рухливість дозволяє існування декількох
структурних станів
• Ці стани мають різну різну спорідненість до певних лігандів.
• Взаємодії з лігандами (факторами) фіксують певні стани.
• Хімічні реакції, які каталізуються машиною, приводять до
заміни лігандів, а відповідно і до переходу в інший
структурний стан.
• Рушійною силою для переміщення блоків є тепловий рух:
блоки рухаються хаотично (хоча й у відповідності з
конструкцією машини); зв’язування лігандів та заміна їх
унаслідок реакцій каналізують ці рухи в певних напрямках.
• Результатом структурних перебудов є переміщення
структурних блоків у просторі та / або зміна характеру
взаємодії машини зі своїм оточенням рух або всієї машини,
або відносний рух її частин.













 industry
industry








