Similar presentations:
Ингибирование ферментов (обратимое и необратимое)
1.
Ингибирование ферментов(обратимое и необратимое)
Выполнил: ст. гр. МТБ02-23-01
Мошарина Н.Л.
Принял: проф., д-р хим. наук
Зорин В.В.
2.
Ингибиторы ферментовСоединения, которые снижают активность ферментов
Классификация ингибиторов (по Э. Уэббу):
1. Ингибиторы, связывающиеся с апоферментом.
2. Ингибиторы, образующие комплекс с субстратом, который хуже
связывается с ферментом или подвергается каталитическому превращению с
меньшей скоростью.
3. Ингибиторы, связывающие кофермент.
4. Ингибиторы, связывающие активатор.
5. Ингибиторы, взаимодействующие с фермент-субстратными комплексами.
2
3.
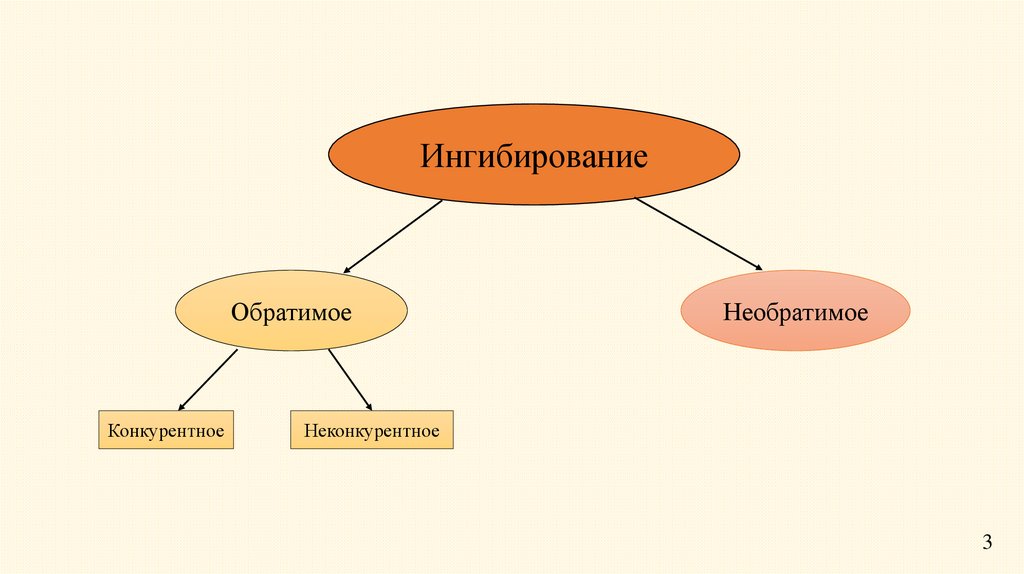
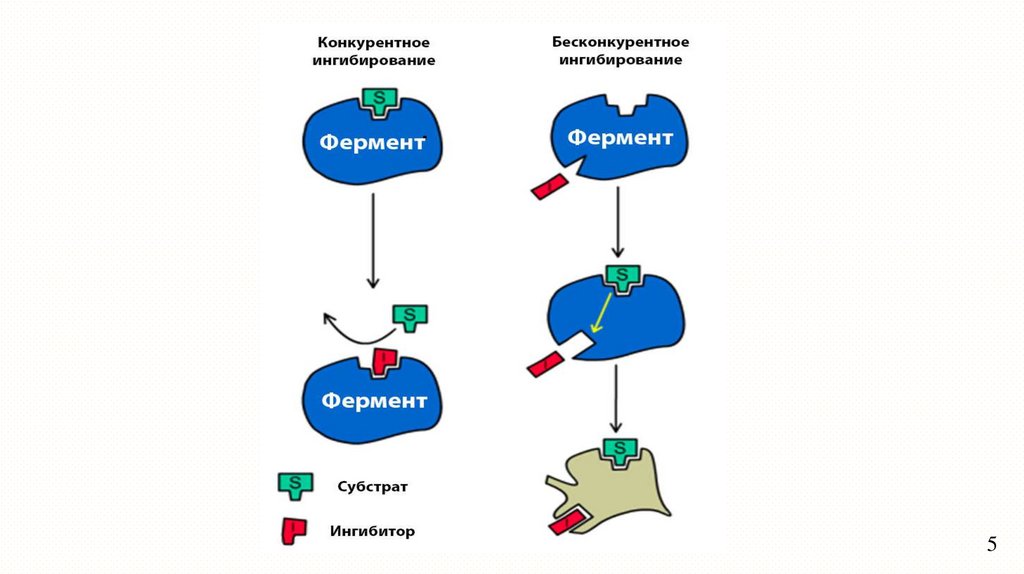
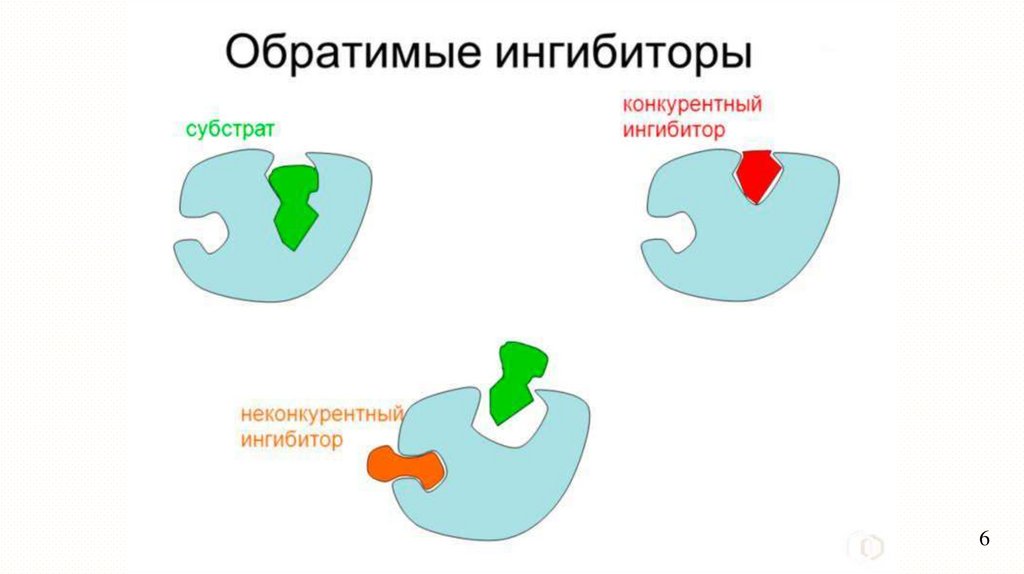
ИнгибированиеОбратимое
Конкурентное
Необратимое
Неконкурентное
3
4.
Обратимое ингибированиеПри обратимом ингибировании происходит непрочное
связывание ингибитора с функциональными группами фермента,
вследствие
чего
активность
фермента
постепенно
восстанавливается. При определенных условиях ингибитор
может быть легко отделен от фермента.
4
5.
56.
67.
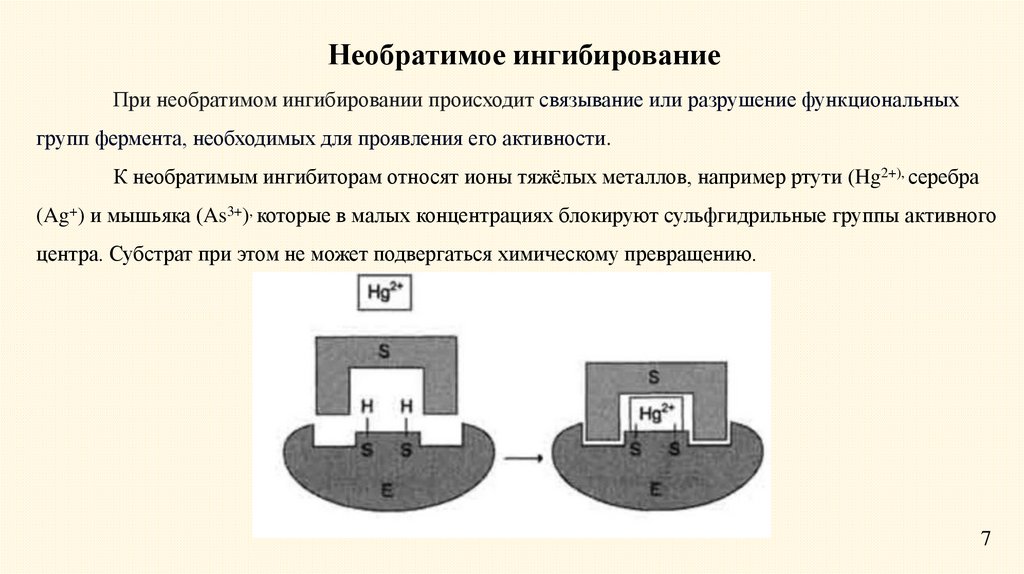
Необратимое ингибированиеПри необратимом ингибировании происходит связывание или разрушение функциональных
групп фермента, необходимых для проявления его активности.
К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра
(Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного
центра. Субстрат при этом не может подвергаться химическому превращению.
7
8.
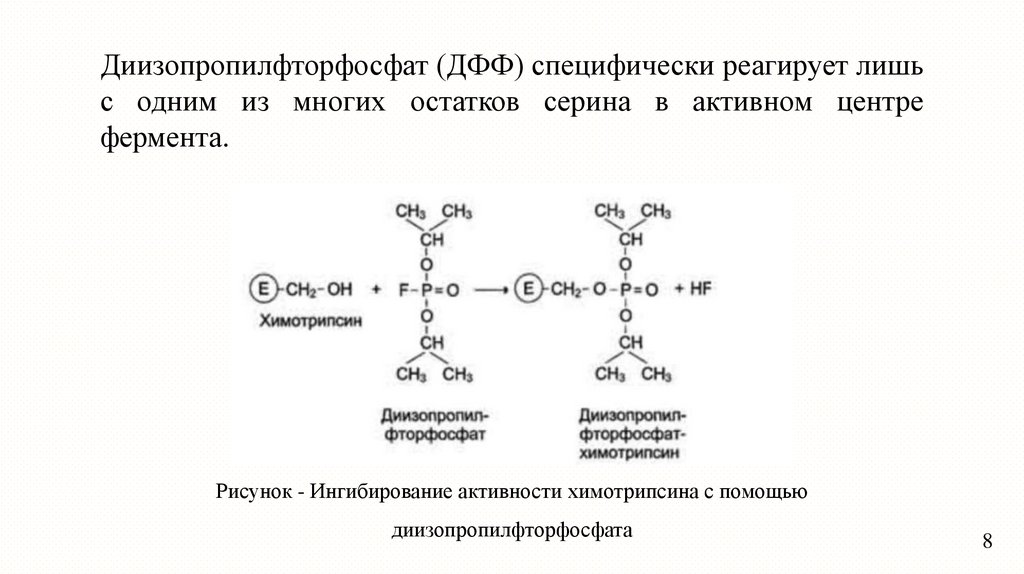
Диизопропилфторфосфат (ДФФ) специфически реагирует лишьс одним из многих остатков серина в активном центре
фермента.
Рисунок - Ингибирование активности химотрипсина с помощью
диизопропилфторфосфата
8
9.
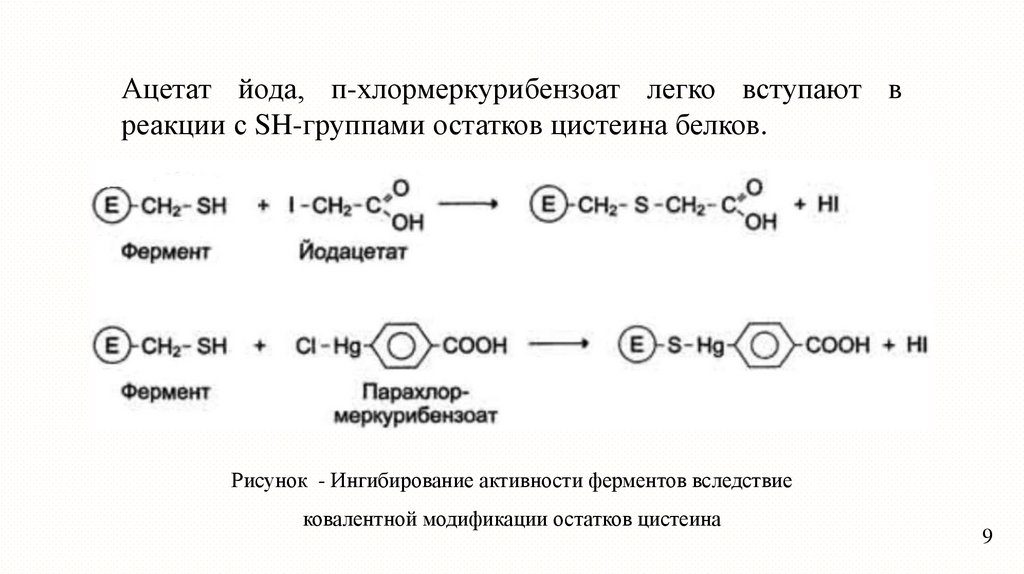
Ацетат йода, п-хлормеркурибензоат легко вступают вреакции с SH-группами остатков цистеина белков.
Рисунок - Ингибирование активности ферментов вследствие
ковалентной модификации остатков цистеина
9



 biology
biology