Similar presentations:
Получение оснований. Применение оснований. Реакции нейтрализации
1.
13.04.20.«Получение оснований .
Применение оснований.
Реакции нейтрализации»
2.
Задание №1 «НазовиКОН
меня»
гидроксид калия
Ca(ОН)2 гидроксид кальция
Fe(ОН)3 гидроксид железа(III)
Cu(ОН)2 гидроксид меди(II)
3.
Задание №2 «ОхарактеризуйNaОН
гидроксид натрия
меня»
Al(ОН)3
гидроксид алюминия
однокислотный
многокислотный
растворимый
нерастворимый
сильный
слабый
4.
Задание №3 «Составьl
• Гидроксид натрия –
• Гидроксид алюминия
–
l
Na(OH)
ll
• Гидроксид железа(ll) –
меня»
l
Fe(OH)2
lll
l
Al(OH)3
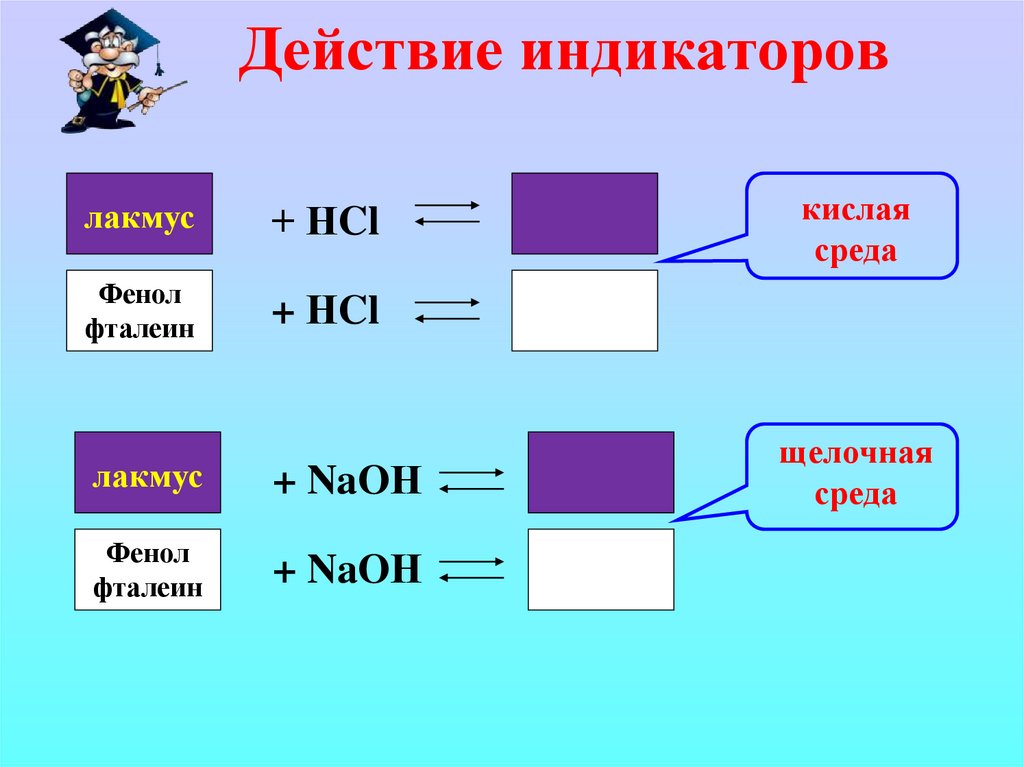
5. Действие индикаторов
лакмус+ НCl
Фенол
фталеин
+ НCl
лакмус
+ NaOН
Фенол
фталеин
+ NaOН
кислая
среда
щелочная
среда
6.
Mg(OH)2ПОВТОРИМ
ХИМИЧЕСКИЕ
СВОЙСТВА
ОСНОВАНИЙNaOH ЩЕЛОЧЕЙ
Fe(OH)3
7.
Кислотныйоксид
Соответствующая
кислота
SO2
H2SO3
SO3
H2SO4
P2O5
H3PO4
N2O5
HNO3
CO2
H2CO3
SiO2
H2SiO3
Кислотный
остаток в соли
MeSO3 (II)
сульфит
MeSO4 (II)
сульфат
MePO4 (III)
фосфат
MeNO3 (I) нитрат
MeCO3 (II)
карбонат
MeSiO3 (II)
силикат
8.
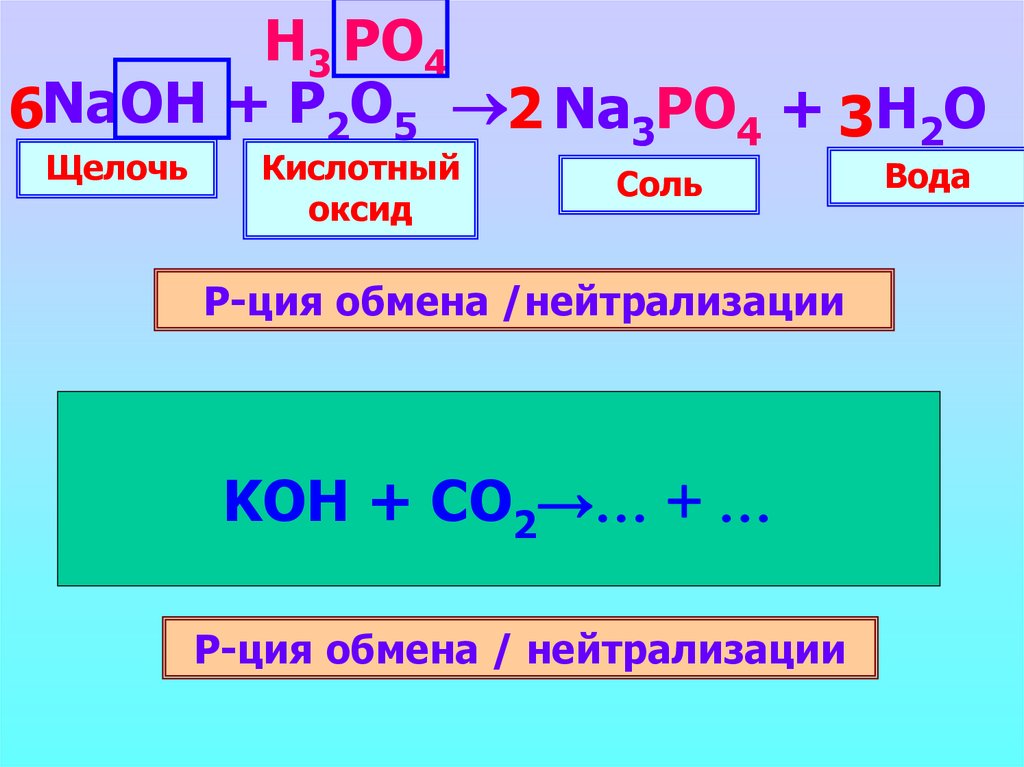
Н3 PO46NaOH + P2O5 2 Na3PO4 + 3H2O
Щелочь
Кислотный
оксид
Соль
Р-ция обмена /нейтрализации
Н2 CO3
+
…
2KOHKOH
+ CO+2 CO
K
CO
+
H2O
2→…
2
3
Р-ция обмена / нейтрализации
Вода
9.
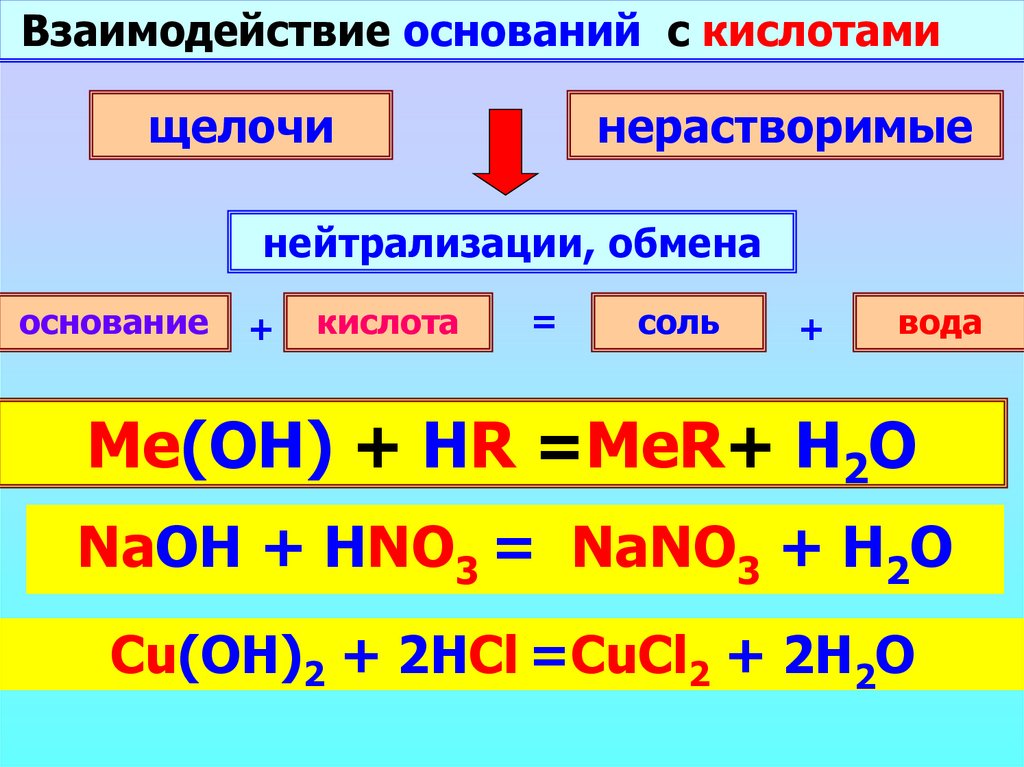
Взаимодействие оснований с кислотамищелочи
нерастворимые
нейтрализации, обмена
основание
+
кислота
=
соль
+
вода
Me(OH) + HR =MeR+ H2O
NaOH
++
HNO
NaNO
+
H
O
NaOH
HNO
…
+
…
3=
3
2
3
Cu(OH)
Cu(OH)
2HCl+=CuCl
… 2 + 2H2O
2 + HCl
2 + …
10.
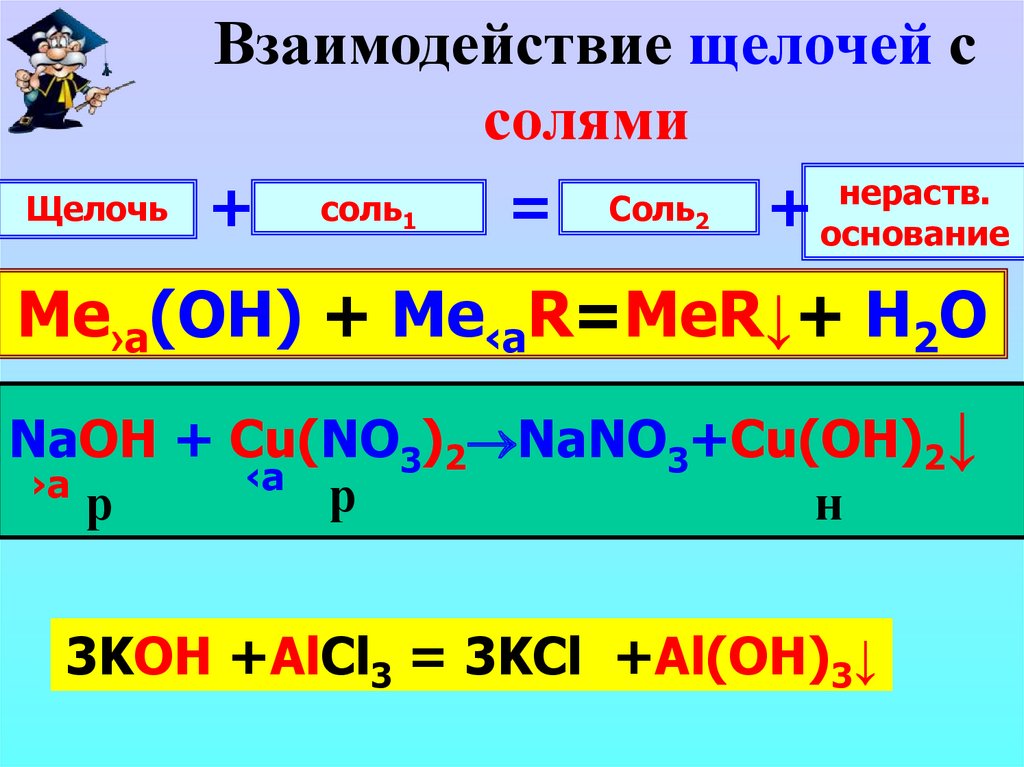
Взаимодействие щелочей ссолями
Щелочь
+
соль1
=
Соль2
+
нераств.
основание
Me›а(OH) + Me‹aR=MeR↓+ H2O
NaOH + Сu(NO 3)2 NaNO
3+Cu(OH)2↓
‹a
›а
р
р
н
KOH
+AlCl
= … ++Al(OH)
…
3KOH
+AlCl
3 3KCl
3 =
3↓
11.
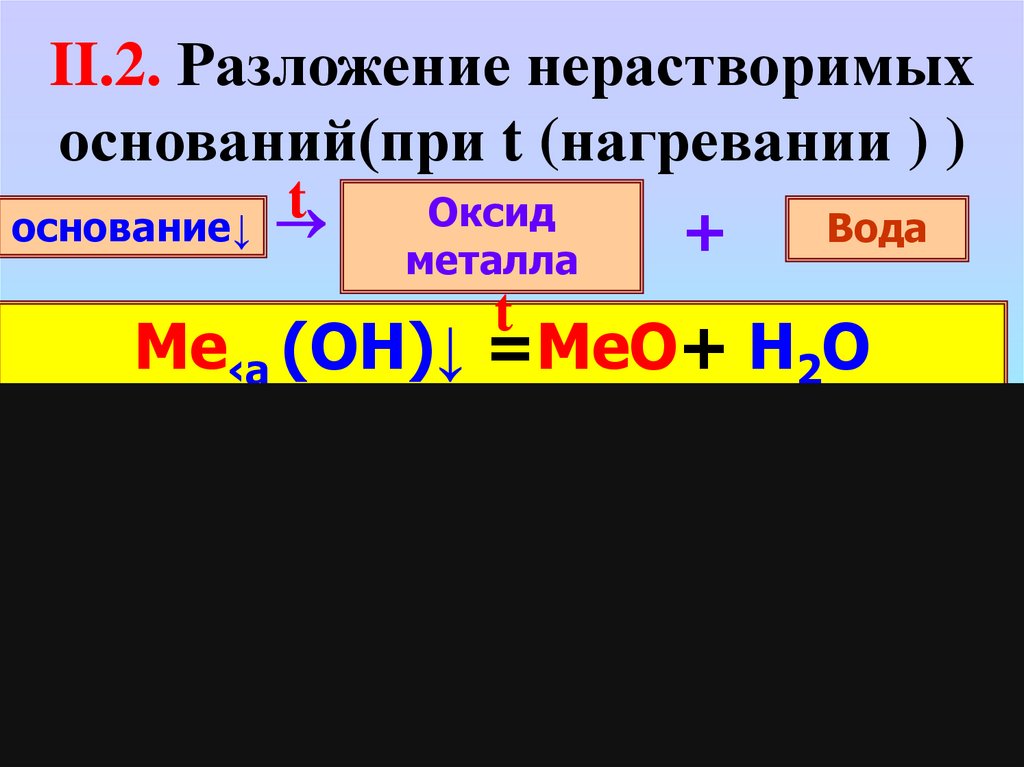
II.2. Разложение нерастворимыхоснований(при t (нагревании ) )
основание↓
t
Оксид
металла
+
t
Вода
Me‹a (OH)↓ =MeO+ H2O
t
Cu(OH)2↓ = CuO + H2O
t
Fe(OH)
↓
…
+
…
3
2Fe(OH)3↓ Fe2O3 + 3H2O
12. Правила техники безопасности при работе с щелочами:
Щелочи – едкие вещества,разъедают кожу, дерево,
бумагу. Гидроксид натрия
NaOH - называют «едкий
натр», а гидроксид калия КОН
– «едкое кали».
Если раствор щелочи попал на
кожу, может образоваться
язва. Чтобы этого не
случилось, немедленно смойте
ее большим количеством
проточной воды и протрите
поврежденный участок
слабым раствором борной
кислоты.
13. Тест
1. К основаниям относится каждое из двух веществ:а) Na₂SO₄, H₂S
б) KOH, CO₂
г
в) H₂CO₃, N₂O₅
г) NaOH, Cu(OH)₂
2. Формула, которая соответствует
гидроксиду железа (II):
в а) FeO б) Fe(OH)₃
в) Fe(OH)₂
г) Fe₂O₃
3. Какое основание разлагается при нагревании:
б а) NaOH б) Fe(OH)₃ в) KOH
г) Ba(OH)₂
4. В цепочке превращений веществом Х является:
Na→ X → NaOH
в а) NaСl
б) NaOH
в) Na₂O
г) Na₂SO₄
14.
III.Применениеоснований и их роль в
жизни человека.
15.
• Твёрдое белое вещество, гигроскопичное ипоэтому расплывающееся на воздухе; хорошо
растворяется в воде, при этом выделяется
теплота.
• Раствор гидроксида натрия в воде мылкий на
ощупь и очень едкий. Он разъедает кожу, ткани,
бумагу и другие материалы, поэтому его
называют едкий натр.
• С гидроксидом натрия и его растворами надо
обращаться осторожно, опасаясь, чтобы они не
попали на одежду, а тем более на руки и лицо.
• Гидроксид натрия применяют в мыловарении,
кожевенной и фармацевтической
промышленности.
16.
• Твёрдое белое вещество, хорошорастворяется в воде с выделением
большого количества теплоты.
• Раствор гидроксида калия мылок на
ощупь и очень едок. Поэтому
гидроксид калия иначе называют
едкое кали.
• Применяют его в качестве добавки
при производстве мыла, тугоплавкого
стекла.
17.
• Гашёная известь – рыхлый белыйпорошок, немного растворимый в воде.
• Получается при взаимодействии
негашёной извести СаО с водой.
• Применяют в строительстве при кладке
и штукатурке стен, для побелки
деревьев, для получения хлорной
извести, которая является
дезинфицирующим средством.
18.
Все моющие средства, мыло,шампунь это слабощелочные
растворы. Именно щелочная
среда создает эффект мылкости,
растворяет жир и смывает грязь.
Щелочи обладают и
дезинфицирующим свойством.
Поэтому совершенно верно показывают в
рекламе после применения мыла “Сейфгард”
уменьшение бактерий.
Раствор аммиака и
стеклоочиститель –
это также основания.
19.
Щелочной раствор гидроксидакальция Са(ОН)2 (гашеная известь)
мы наносим на стены при побелке.
На основе нерастворимых в воде
оснований – гидроксидов хрома,
железа, кобальта, марганца, меди
изготавливают малярные и
художественные краски.
А из гидроксида никеля прессуют
пластины щелочных аккумуляторов.
Щелочные батарейки мы
используем как источники
питания для приборов.
20. Задание 1. Допишите уравнения реакций. Назовите вещества.
Домашнее заданиеЗадание 1. Допишите
уравнения
реакций. Назовите вещества.
1). NaOH + H2SO4 =
2). КOH + SO3 =
3). LiOH + CuSO4 =
4). NaOH + фенолфталеин =
5). Zn(OH)2 =
21. Задание 2. С какими из веществ будет реагировать KOH.Напишите реакции. Назовите вещества.
H3PO4 ;CaO ; СO2 ;Al2 (SO4)3 ;NaOH22. Тест
1. Гидроксид натрия реагирует:а) H₂SO₄ б) Na₂O
в) Fe(OH)₂
г) CaCO₃
а
2. Какое основание разлагается при нагревании:
б
а) NaOH б) Fe(OH)₃
в) KOH
г) Ba(OH)₂
3. Гидроксид бария взаимодействует:
б) CaO
в) KOH
г) H₂O
а а) SO₂
4. С какой кислотой вступает в реакцию Cu(OH)₂↓:
в
а) H₂CO₃ б) H₂SiO₃
в) HNO₃
г) H₂S
5.Гидроксид калия реагирует:
а) гидроксидом меди(I)
б) оксид натрия
г в) хлорид серебра (I)
г) хлорид железа(III)

















 chemistry
chemistry








