Similar presentations:
Реакции ионного обмена
1.
Реакцииионного
обмена
2.
Цель: закрепить навыксоставления уравнений
реакций в ионном виде
3.
Вставьте пропущенные слова:Уравнения реакций, в которых вещества записаны в
молекулярными
форме молекул, называются _________________.
Уравнения реакций, в которых вещества записаны в виде
ионными
ионов, называются ___________.
Чтобы составить ионное уравнение, надо записать в виде
сильные ____________.
электролиты
ионов все _________
Сильными электролитами являются:
соли: ______________,
растворимые
серная, соляная, азотная
кислоты: ________________________,
NaOH, KOH, Ba(OH)2, Ca(OH)2
основания: ____________________________.
4.
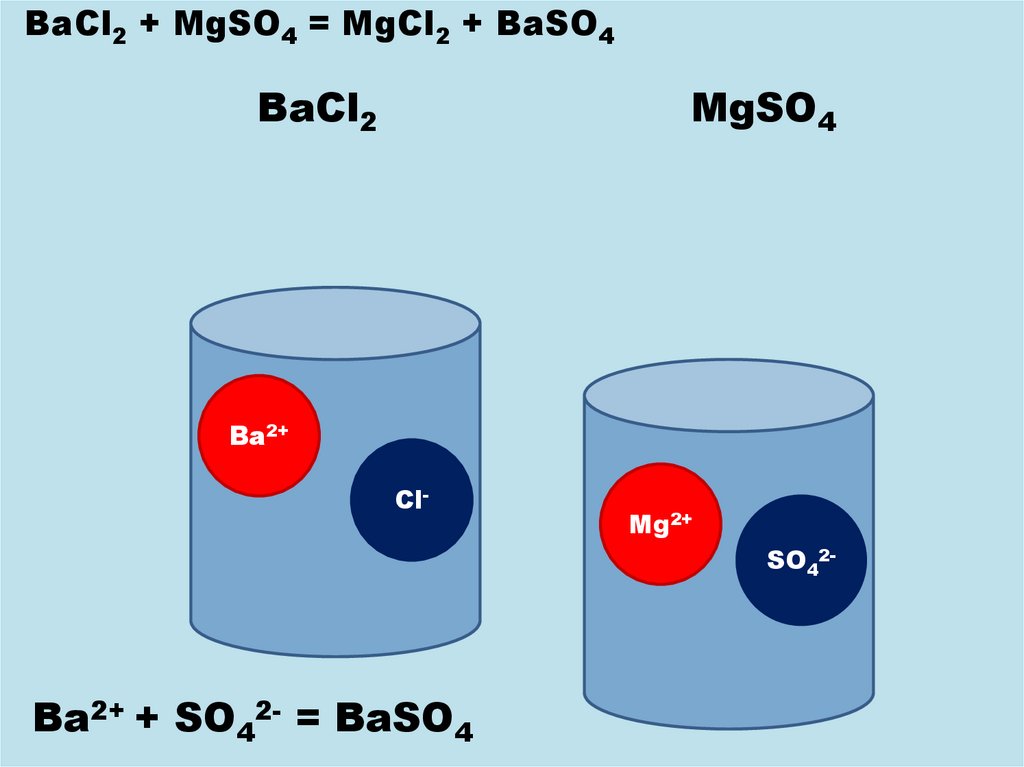
BaCl2 + MgSO4 = MgCl2 + BaSO4BaCl2
MgSO4
Ba2+
Cl-
Mg2+
SO42-
Ba2+ + SO42- = BaSO4
5.
+ -+2- = 2Na
+
2- +
22+NaOH
Na
2 OH
2+H+H
+SO
SO
Na
SO
+
SO
+
22
H2HO2O
2
44
2
4 4
2 OH- + 2 H+
=
2 H2O
OH- + H+
=
H2O
Чтобы составить ионное уравнение, надо
записать в виде ионов все сильные
растворимые электролиты
6.
Распределите вещества в два столбикаРасписываем на ионы
Оставляем в виде молекул
H2O
NaOH
SO2
H2SO4
MgS
Na2CO3
Fe(OH)2
K2SiO3
7.
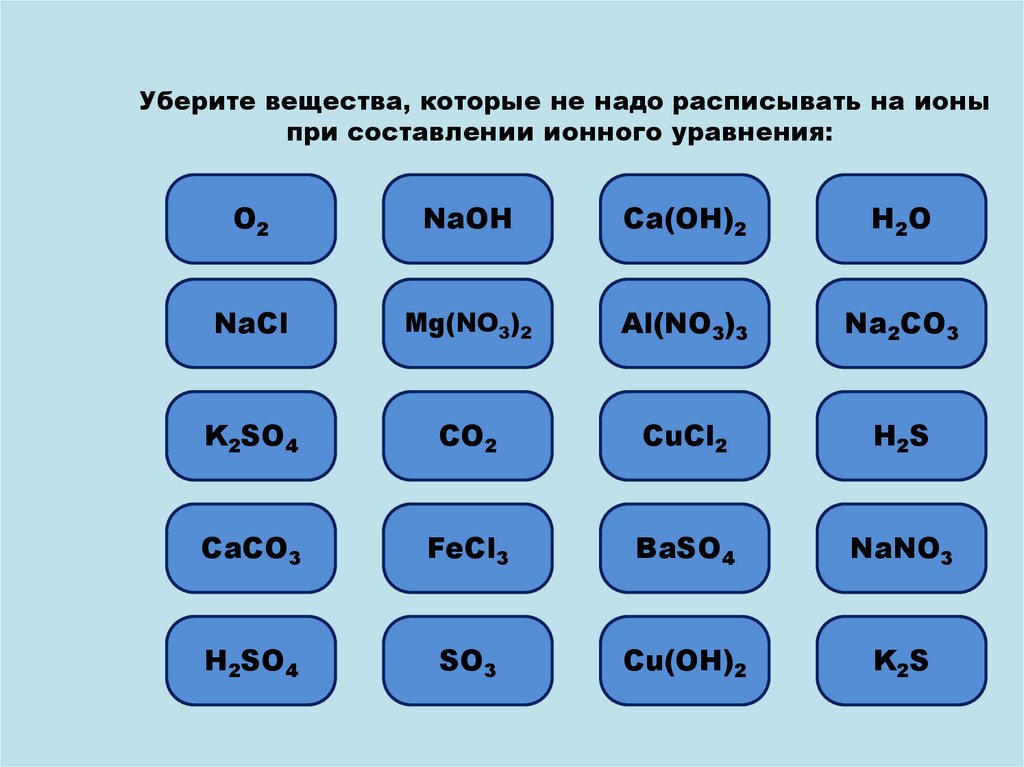
Уберите вещества, которые не надо расписывать на ионыпри составлении ионного уравнения:
О2
Ошибка
NaOH
Ошибка 2
Ca(OH)
H2O
Ошибка
NaCl
Ошибка3)2
Mg(NO
Ошибка3)3
Al(NO
Ошибка
Na
2CO3
KОшибка
2SO4
CO2
Ошибка2
CuCl
Н2S
CaCO3
Ошибка3
FeCl
BaSO4
Ошибка 3
NaNO
HОшибка
2SO4
SО3
Cu(OH)2
Ошибка
K2S
8.
Ученик составил полные ионные уравнения для данныхмолекулярных. Исправьте ошибки. Составьте сокращенные
ионные уравнения.
Fe (OH)3 + 3 HCl = FeCl3 + 3 H2O
Fe3+ + 3 OH- + 3 H+ + 3 Cl- = Fe 2+ + 3 Cl - + 3 H2O
Са (OH)2 + 2 HCl = CaCl2 + 2 H2O
Ca2+ + OH- + 2 H+ + Cl- = Ca2+ + Cl- + 2 H2O
Ba (NO3)2 + Na2SO4 = BaSO4 + 2 NaNO3
Ba + 2 NO3 + 2 Na + SO4 = BaSO4 + 2 Na + 2 NO3
9.
Закончить уравнения реакций вмолекулярном виде. Записать их в
ионном виде.
К2СО3 + HCl =
NaОH + ZnCl2 =
Mg(ОH)2 + HNO3 =
К2SО4 + NaCl =
10.
Реакции ионного обменаосуществимы, если
образуется
осадок ( )
или
газ ( )
или
вода
11.
Са2+NO3-
Cl -
PO43-
SO42-
Ba2+
Al3+
Na+
Br -
К+
Какие из данных ионов не могут находиться в растворе
одновременно?
Составьте сокращенные ионные уравнения.
Предложите возможные молекулярные уравнения для
данных ионных.
12.
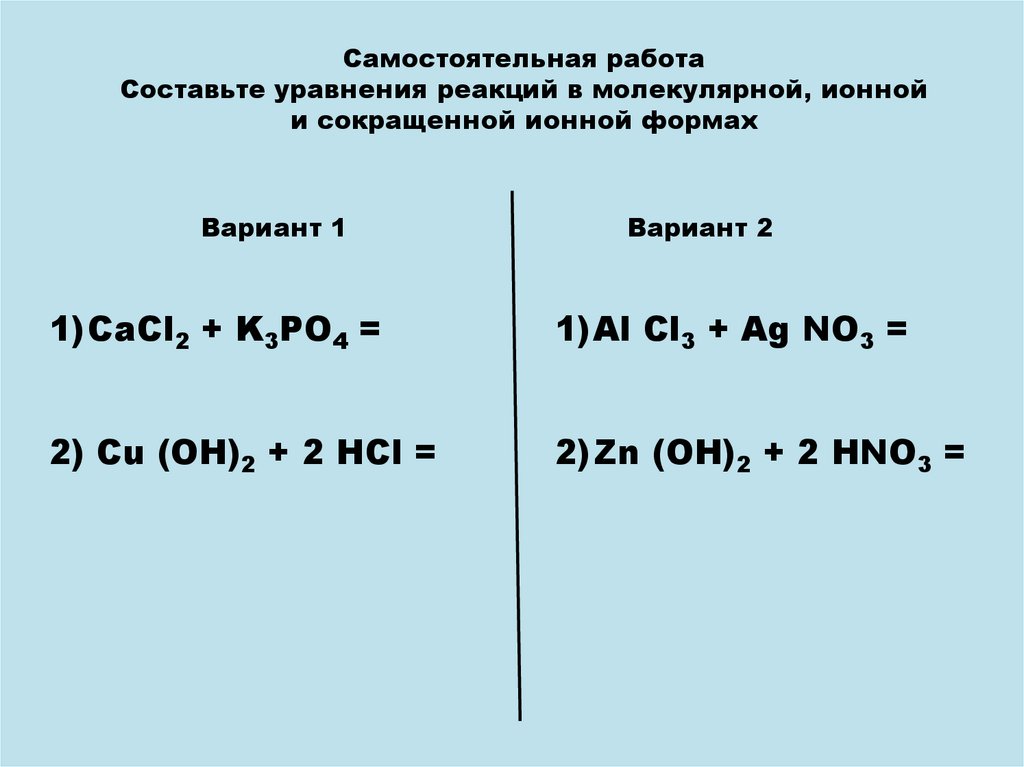
Самостоятельная работаСоставьте уравнения реакций в молекулярной, ионной
и сокращенной ионной формах
Вариант 1
Вариант 2
1)CaCl2 + K3PO4 =
1)Al Cl3 + Ag NO3 =
2) Cu (OH)2 + 2 HCl =
2)Zn (OH)2 + 2 HNO3 =
13.
Проверь себя:Вариант 1
1) 3 CaCl2 + 2 K3PO4 = Ca3 (PO4)2 + 6 KCl
3 Са2+ + 6 Cl- + 6 K+ + 2 PO43- = Ca3 (PO4)2 + 6K+ + 6Cl3 Са2+ + 2 PO43- = Ca3 (PO4)2
2) Cu (OH)2 + 2 HCl = CuCl2 + 2 H2O
Cu (OH)2 + 2 H+ + 2Cl- = Cu2+ + 2 Cl- + 2 H2O
Cu (OH)2 + 2 H+ = Cu2+ + 2 H2O
Вариант 2
1) Al Cl3 + 3 Ag NO3 = Al (NO3)3 + 3AgCl
Al3+ + 3Cl- + 3 Ag+ + 3 NO3- = Al3+ + 3NO3- + 3AgCl
Cl- + Ag+ = AgCl
2) Zn (OH)2 + 2 HNO3 = Zn (NO3)2 + 2 H2O
Zn (OH)2 + 2 H+ + 2 NO3- = Zn2+ + 2 NO3- + 2 H2O
Zn (OH)2 + 2 H+ = Zn2+ + 2 H2O
14.
Домашнее задание:§ 37 (повторить).
Придумать свои реакции, в которых бы:
А) образовался осадок;
Б) выделился газ;
В) реакции не происходило.
Составить уравнения в молекулярном и
ионном виде.











 chemistry
chemistry








