Similar presentations:
Кислоты. Определение и классификация
1.
2. Кислоты
1. Определение и классификация2. Отдельные представители
3. Обнаружение кислот
4.Техника безопасности
5. Типичные реакции кислот
7. Проверка знаний
3.
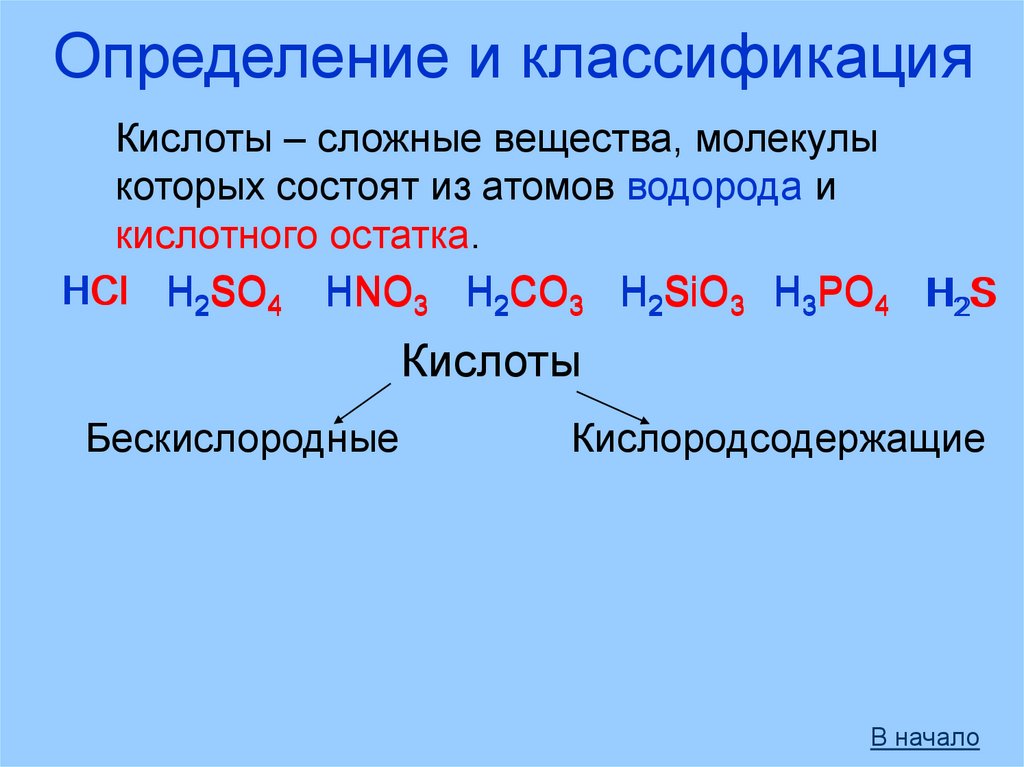
Определение и классификацияКислоты – сложные вещества, молекулы
которых состоят из атомов водорода и
кислотного остатка.
HCl H2SO4 HNO3 H2CO3 H2SiO3 H3PO4 H2S
Кислоты
Бескислородные
Кислородсодержащие
В начало
4.
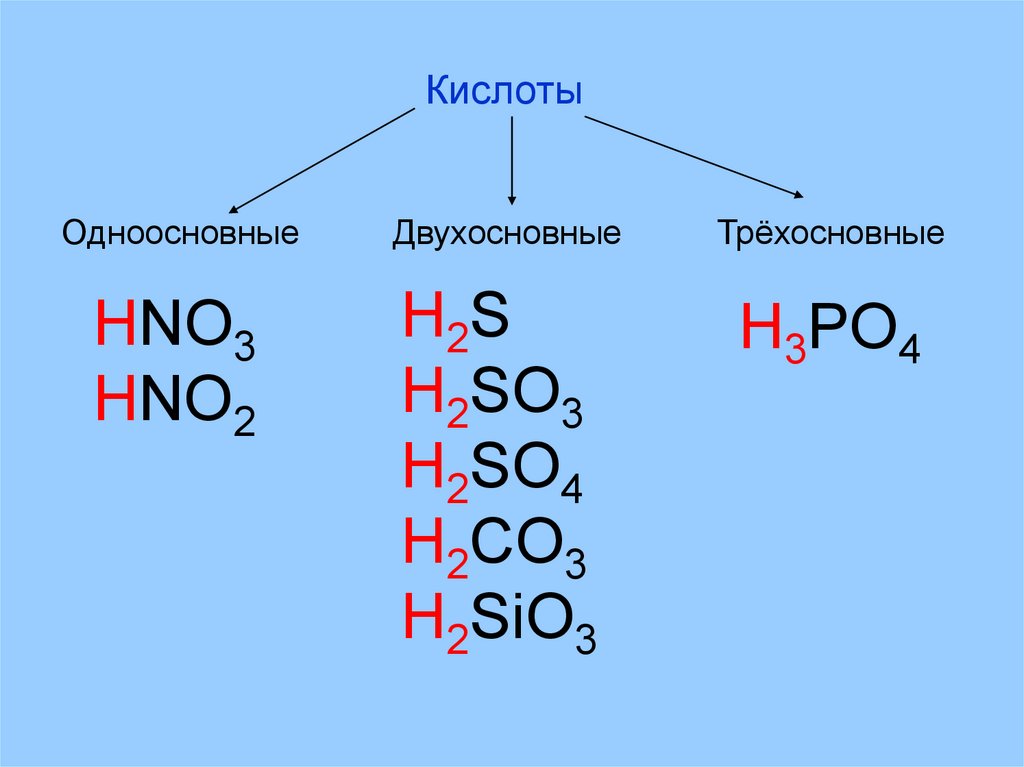
КислотыОдноосновные
Двухосновные
Трёхосновные
HNO3
HNO2
H2 S
H2SO3
H2SO4
H2CO3
H2SiO3
H3PO4
5.
В началоОрганические кислоты, встречаемые вами
в повседневной жизни
Щавелевая
Уксусная
Лимонная
Молочная
Аскорбиновая
6.
Серная кислотаH2SO4
Серная кислота – бесцветная
жидкость, вязкая, как масло, не имеющая
запаха, почти вдвое тяжелее воды.
Серная кислота поглощает влагу из
воздуха и других газов. Это свойство
серной кислоты используют для осушения
некоторых газов.
В начало
7.
Угольная кислотаH2CO3
УГОЛЬНАЯ КИСЛОТА - очень слабая
и непрочная кислота.
Образуется при растворении диоксида
углерода в воде, например, в минеральной
воде.
В начало
8.
Соляная кислотаНCl
СОЛЯНАЯ КИСЛОТА - бесцветная,
«дымящая» на воздухе жидкость.
Составная часть желудочного сока.
В начало
9.
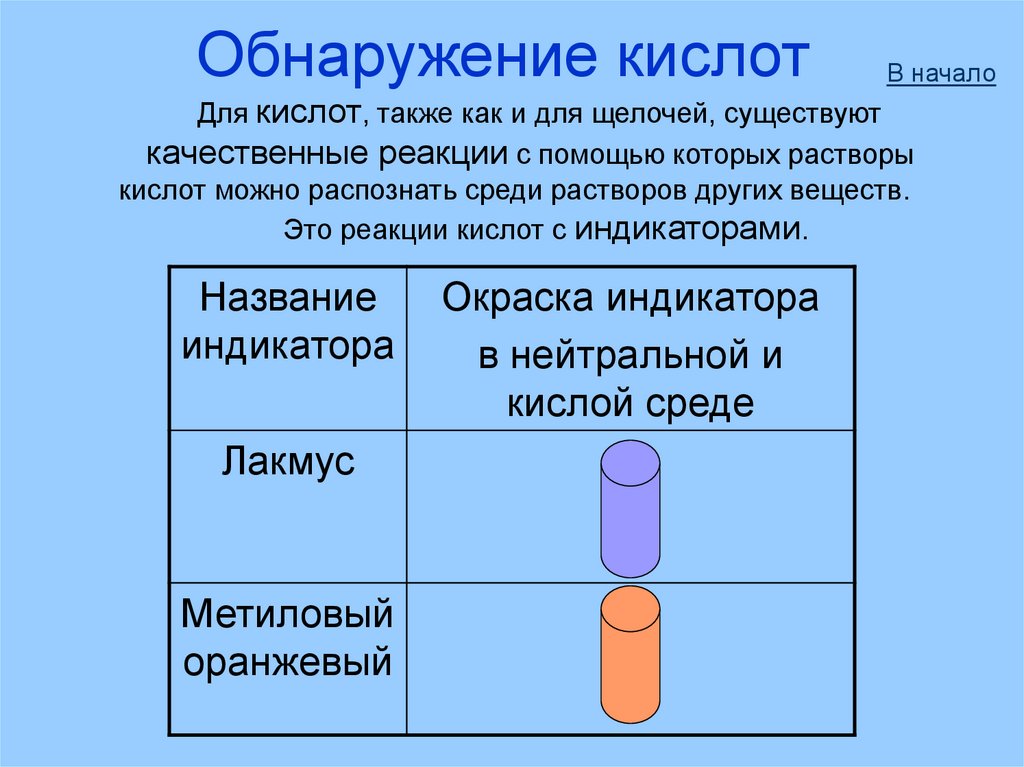
Обнаружение кислотВ начало
Для кислот, также как и для щелочей, существуют
качественные реакции с помощью которых растворы
кислот можно распознать среди растворов других веществ.
Это реакции кислот с индикаторами.
Название
индикатора
Лакмус
Метиловый
оранжевый
Окраска индикатора
в нейтральной и
кислой среде
10.
Техника безопасностиПри растворении серной кислоты нужно вливать её
тонкой струёй в воду при помешивании
В начало
11.
Типичные реакции кислот1. Кислота + основание → соль + вода
Н Сl + Na OH →
(H2O)
+
2. Кислота + оксид металла → соль + вода
2 H Cl + Mg O →
2
+
2
3. Кислота + металл → соль + водород
2 H Cl + Mg →
+
2
2
4. Кислота + соль → новая кислота + новая соль
H Cl + Ag NO3 →
+
В начало
12.
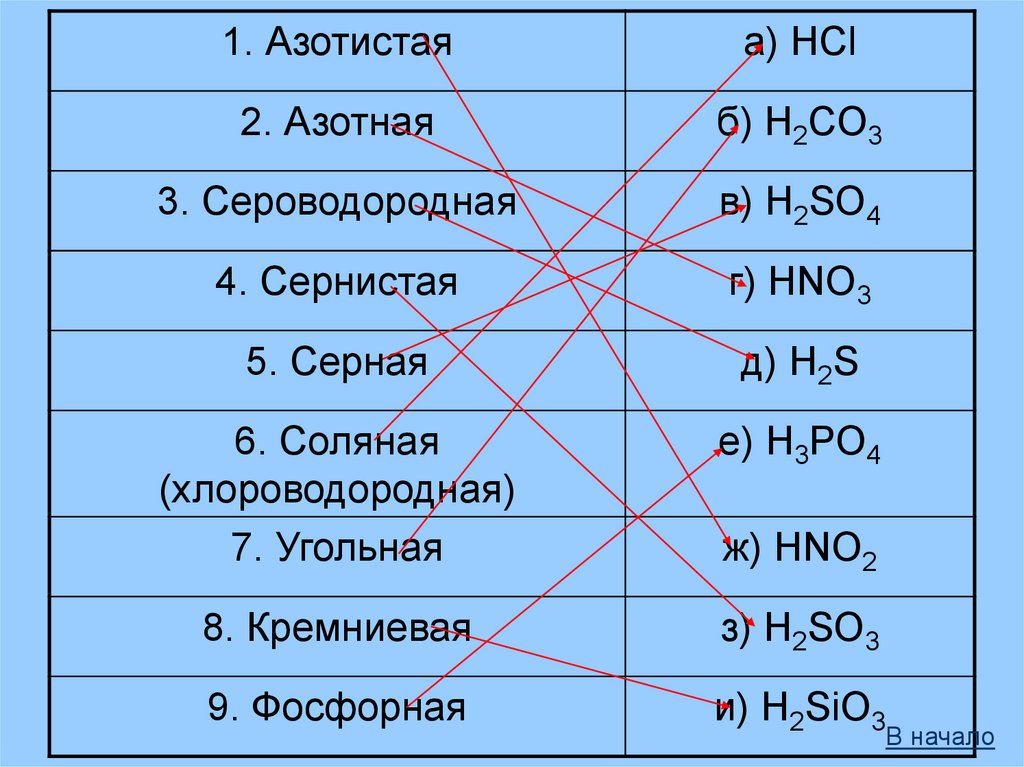
1. Азотистаяа) HCl
2. Азотная
б) H2CO3
3. Сероводородная
в) H2SO4
4. Сернистая
г) HNO3
5. Серная
д) H2S
6. Соляная
(хлороводородная)
7. Угольная
е) H3PO4
8. Кремниевая
з) H2SO3
9. Фосфорная
и) H2SiO3
ж) HNO2
В начало
13.
Каким правилом техники безопасности пренебрёглаборант?
В начало
14.
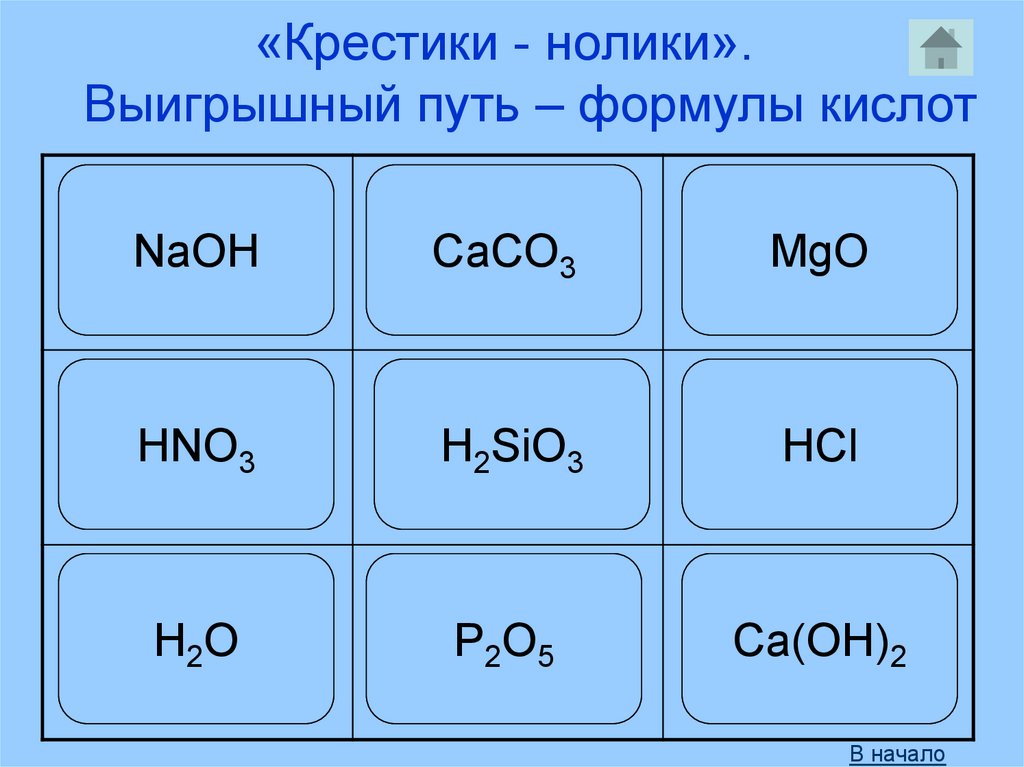
«Крестики - нолики».Выигрышный путь – формулы кислот
NaOH
CaCO3
MgO
HNO3
H2SiO3
HCl
H 2O
P2O5
Ca(OH)2
В начало









 chemistry
chemistry








