Similar presentations:
Сероводород. Сульфиды
1.
06.12 Тема:Сероводород.Сульфиды.
Записать число, тему урока , составить
план урока и написать краткие ответы
на каждый пункт плана.
2.
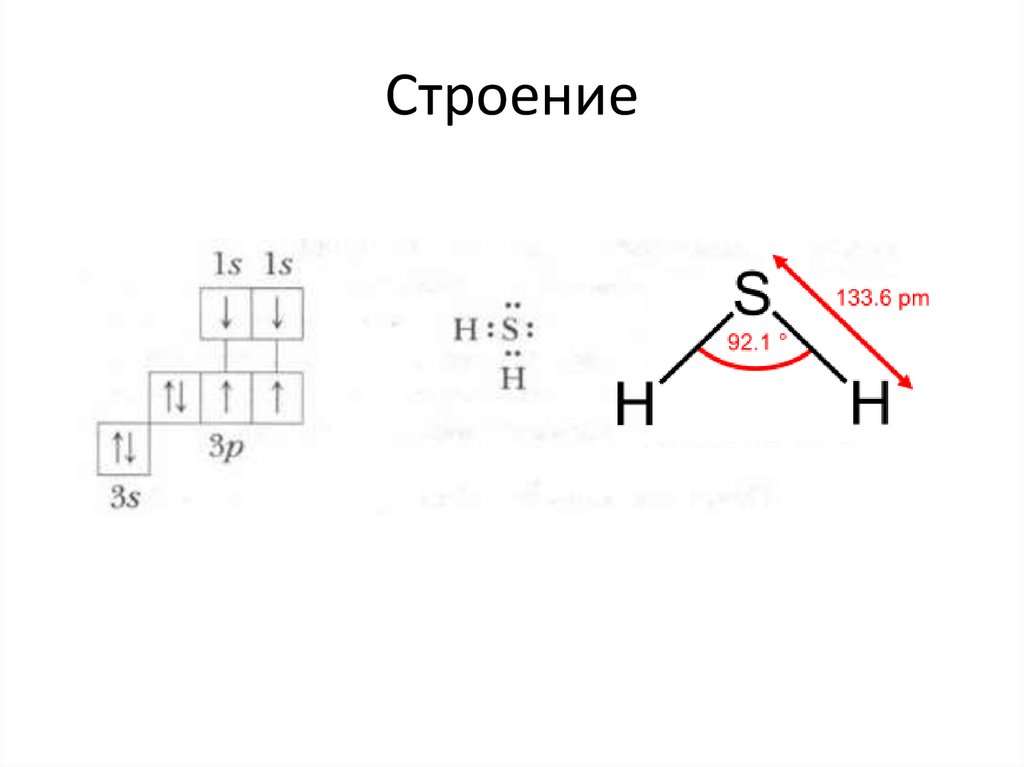
Строение3.
Физические свойства• Бесцветный газ с запахом тухлых яиц
• Растворим в воде (в 1V H2O растворяется 3V
H2S при н.у.)
• Тяжелее воздуха
• t°пл. = -86°C
• t°кип. = -60°С.
4.
Влияние на организмВнимание!
Ядовит. При вдыхании этого газа в большом
количестве быстро наступает паралич
дыхательных нервов и человек перестает
ощущать запах.
Какой вывод из этого следует? Какие меры
безопасности нужно предпринимать при
работе с сероводородом?
5.
Получениеt
1) H2 + S → H2S↑
2) FeS + 2HCl → FeCl2 + H2S↑
6.
Химические свойства сероводорода1) Взаимодействие с водой. (Диссоциация)
1 ступень: H2S → H+ + HS(образуется гидросульфид - ион)
2 ступень: HS- → H+ + S2(образуется сульфид - ион)
7.
Химические свойства2)
Взаимодействие с основаниями.(Образуются
средние (сульфиды) и кислые (гидросульфиды)
соли):
H2S + NaOH → H2O + NaHS – гидросульфид натрия;
H2S + 2NaOH → 2H2O + Na2S – сульфид натрия;
Какая соль образуется в первую очередь?
А как можно превратить кислую соль в среднюю?
Добавить основание:
NaHS + NaOH → H2O + Na2S
8.
Химические свойства3)
Сильный восстановитель.
H2S + Br2 → S + 2HBr
4) Горение (окисление) сероводорода.
при избытке O2 : 2H2S + 3O2 → 2S02 + 2H2O
при недостатке O2 : 2H2S + O2 → 2H2O + 2S
5) Серебро при контакте с сероводородом
чернеет:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
9.
Химические свойства6) Качественная реакция на сероводород и растворимые
сульфиды - образование темно-коричневого (почти
черного) осадка PbS или черного осадка сульфида меди
CuS:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Запишите эту реакцию в полной и сокращенной ионной
форме:
2H+ + S2- + Pb2+ + 2NO3- → PbS↓+ 2H+ + 2NO3-- Полная форма
Pb2+ + S2- → PbS↓ - Сокращенная форма
Предложите свою химическую реакцию, которая отвечала
бы этому сокращенному ионному уравнению.
10.
В искусствеЗагрязнение атмосферы вызывает почернение
поверхности картин, написанных масляными
красками, в состав которых входят свинцовые
белила.
Свинцовые белила – это пигмент, представляющий
собой карбонат свинца (II).
PbCO3 + H2S = PbS↓ + CO2 + H2O
Черный
11.
Реставрация: При обработке сульфида свинца (II)пероксидом водорода происходит реакция:
PbS + 4H2O2 = PbSO4 + 4H2O
Белый
12.
Химические свойства сульфидов1) Гидролиз (взаимодействие ионов соли с водой с
образованием малодиссоциирующих веществ)
K2S + H2O → KHS + KOH
S2- + H2O → HS- + OHвследствие чего их водные растворы имеют щелочную
реакцию
2) С сильными кислотами
ZnS + H2SO4 → ZnSO4 + H2S
3) С концентрированной азотной кислотой.
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
13.
Домашнее задание• Параграф 14
• Задание №5, № 7, № 8 стр 80.












 chemistry
chemistry








